本文来自微信公众号:生物世界 (ID:ibioworld),作者:王聪,编辑:王多鱼,原文标题:《AI预测RNA结构,这篇Science封面论文转化出一家新公司,打开药物研发新格局》,题图来自:视觉中国
近日,一家名为 Atomic AI 的创业公司完成了3500万美元A轮融资,该公司通过 AI 预测 RNA 三维结构来开发靶向 RNA 的药物,而该技术平台源自2022年8月发表的一篇 Science 论文。
2021年7月16日,AlphaFold2 横空出世,技惊四座,它仅根据蛋白质的氨基酸序列就能以前所未有的准确度预测其三维结构。DeepMind 团队还在 Nature 期刊发表论文,公布了 AlphaFold2 的开源代码,并介绍了该系统的完整方法论【1】。
仅仅一年之后,DeepMind 宣布,AlphaFold 已经预测出全球几乎所有已知蛋白质结构。AlphaFold 的出现让预测复杂蛋白质结构变得无比简单,有望彻底改变药物研发格局。

一直以来,蛋白质都是药物研发的绝对重点,到目前为止,人类几乎所有的药物都是针对700多种与疾病相关的蛋白质。
而近年来,RNA 药物的出现,例如 siRNA、ASO,以及 mRNA 药物,颠覆了传统药物研发逻辑。而且,相比寥寥数百种蛋白质药物靶点,RNA 可以说是一片蓝海,以 RNA 为靶点,将会极大地扩展药物靶点选择,新药研发开辟了广阔天地。
我们常说“结构决定功能”,以蛋白质为靶点药物研发离不开对蛋白质结构的解析,对于蛋白质靶点而言,可以通过X射线衍射、冷冻电镜等实验方法解析结构,如今又可以借助AI的力量实现批量结构预测。
而对于 RNA 靶点而言,目前缺乏对其三维结构的准确解析,这极大地限制了靶向 RNA 药物的研发。那么,我们可否像 AlphaFold2 一样,借助 AI 的力量,实现对 RNA 三维结构的预测呢?
2022年8月26日,斯坦福大学计算科学系 Ron O. Dror 教授和生物化学系 Rhiju Das 教授等人在 Science 期刊发表了题为:Geometric deep learning of RNA structure 的研究论文,该论文还被选为当期封面论文。
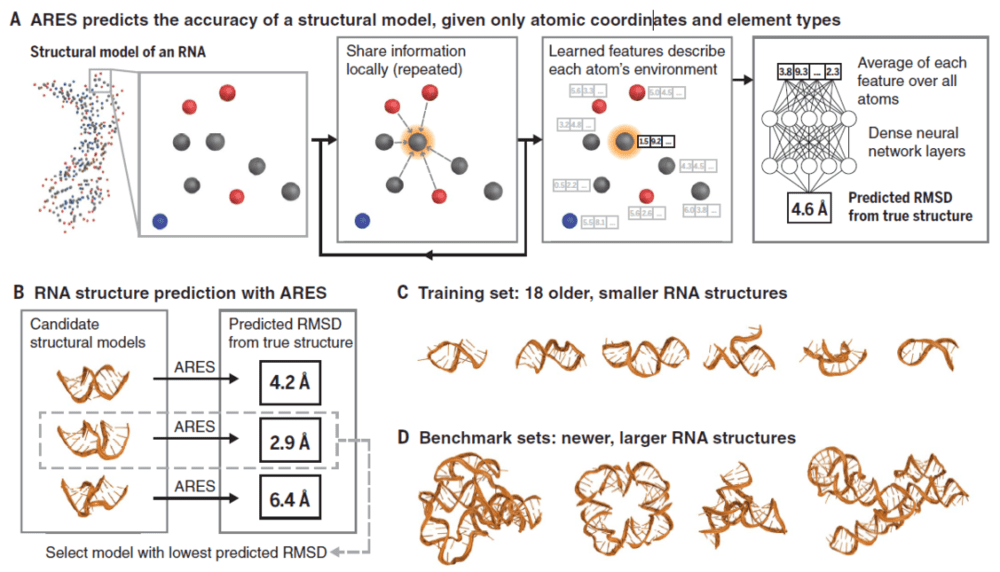
该研究利用机器学习技术开发了一种新型 RNA 三维结构预测模型——ARES,能够以前所未有的准确度预测 RNA 的三维结构,为以 RNA 为靶点的药物研发奠定了基础。更重要的是,该模型只需要极少量已知结构进行学习和训练,即可准确预侧结构,这使得该模型可用于预测那些最难通过实验确定结构的分子类型。


当期Science封面文章
确定生物大分子的三维结构,是现代生物学和医学发现中的最大难题之一。科研就够和科技公司经常需要花费数百万美元来确定分子结构,而这些努力却并不容易获得成功。
蛋白质是执行各种生命活动的分子机器,为了执行它们的功能,蛋白质通常会与其他蛋白质结合,如果我们知道这一对蛋白质与某种疾病相关,并且知道它们相互作用的三维结构,就可以尝试开发药物靶向它们之间的相互作用。
RNA 分子像蛋白质一样,也会折叠成明确的三维结构,以执行广泛的细胞功能。了解这些结构对于理解 RNA 的功能机制、设计合成 RNA 以及开发 RNA 靶向药物具有极其重要的意义。
然而,我们对 RNA 结构的了解远远落后于对蛋白质结构的了解,转录为 RNA 的人类基因组是编码蛋白质的人类基因组的30倍,但解析的 RNA 机构数量不足蛋白质的1%,这还没计入 AlphaFold2 预测的蛋白质结构。
因此,预测 RNA 的三维结构具有重要意义。
在这项研究中,研究团队利用机器学习技术,开发了一种新型 RNA 三维结构预测模型——ARES(Atomic Rotationally Equivariant Scorer)。该模型通过从少量数据中进行的有效学习,克服了标准深度神经网络的主要限制,只需输入 RNA 分子的原子坐标,无需其特定的空间信息,通过调整参数,ARES 能够了解每个原子的功能和空间排列、识别碱基配对规则、RNA 螺旋最佳几何形状,从而预测 RNA 三维空间结构。
更重要的是,基于深度学习的方法通常都需要大量数据进行训练,而 ARES 模型可以在训练数据很少的情况下就能实现成功预测,在该研究中就仅仅使用了18种已知的 RNA 结构进行训练,产生了远超传统方法的最佳预测结果。
ARES 模型的出现,为靶向 RNA 的药物研发带来了一个强大且便利的工具,研究团队创立了一家名为 Atomic AI 的公司,由该论文的第一作者 Raphael Townshend 博士出任 CEO。
成立之初,Atomic AI 获得了由 8VC 领投的700万美元的种子轮融资,近日,该公司完成了3500万美元的A轮融资,此轮融资由 Playground Global 领投,此轮投资人还有加州大学伯克利分校教授、Arc Institute 联合创始人 Patrick Hsu(他曾是张锋的第一届研究生)。
Atomic AI 开发了改进版的 AI 驱动的 RNA 三维结构预测平台——PARSE,将机器学习基础模型与大规模湿实验相结合,以前所未有的速度和准确性预测 RNA 结构,从而设计出靶向 RNA 的小分子药物和基于 RNA 的药物,以治疗当前无法治愈的疾病。
加州大学圣地亚哥分校的 Gene Yeo 教授是著名 RNA 生物学家、Atomic AI 公司顾问,他表示,RNA 在疾病驱动中发挥关键作用,但目前的技术缺乏 RNA 结构建模能力,而这是开发 RNA 靶向药物的所必须的。Atomic AI 创造了一个复杂的集成 AI 引擎,这将改变 RNA 药物的发现和开发。
Atomic AI 公司 CEO Raphael Townshend 博士表示,人类基因组中2%的序列会编码蛋白质,而80%以上的序列会转录为 RNA,但我们对 RNA 的研究和了解远远不及 DNA 和蛋白质。团队之前在 Science 发表的论文代表了在 RNA 结构预测领域的新突破,而现在 Atomic AI 已经生成了大量 RNA 结构数据,预测的速度和准确性已经得到显著提高。Atomic AI 已经将关注方向缩小到了某些因蛋白质病理性过度产生导致的癌症,以及神经退行性疾病。
在蛋白质领域,人们已经摘走了所有“低垂的果实”,而现在,一个全新的领域出现了,Raphael Townshend 博士如是说。
参考资料
https://www.nature.com/articles/s41586-021-03819-2
https://www.science.org/doi/10.1126/science.abe5650
https://www.businesswire.com/news/home/20230125005256/en/Atomic-AI-Launches-with-35-Million-Series-A-Financing-to-Advance-AI-driven-RNA-Structure-Platform-for-Treating-Undruggable-Diseases
本文来自微信公众号:生物世界 (ID:ibioworld),作者:王聪,编辑:王多鱼

