本文来自微信公众号:西湖大学WestlakeUniversity(ID:westlakeuni),原文标题:《找到遗忘的“机关”!西湖大学施一公研究组发现阿尔兹海默症最强风险因子APOE4受体》,题图来自:《漫长的告别》
今天出家门的时候,门关上了吗?迎面和我打招呼的这个人,叫什么名字?锅里滋啦作响的这盘菜,放过盐了吗?……在日常生活中,我们经常碰到“想不起来”的事情,此刻我们的第一反应往往有:糟糕,我是不是得阿尔兹海默症了?
这种担忧并不是空穴来风。目前,全球约有5000万人罹患阿尔兹海默症,它像是盘旋在人类头顶上的鹫鹰,随时等待蚕食人的记忆。然而,这类疾病的机理尚未明晰,“我们为什么会忘记”,依然是未解之谜。
近日,西湖大学施一公团队在该领域取得颠覆性的原创发现。2023年1月2日,团队于《细胞研究》(Cell Research)在线发表题为《LilrB3是APOE4表面受体》(LilrB3 is a putative cell surface receptor of APOE4)的研究论文(已被选为当期封面文章),首次报道发现了一个能够特异性结合APOE4蛋白,而几乎不和APOE2蛋白结合的免疫检查点受体蛋白LilrB3;换句话说,他们找到了阿尔兹海默症导致遗忘的“机关”。
这一发现为我们理解阿尔兹海默症的发病机制,以及展开针对性的药物设计,迈出了突破性的一步。

论文链接:https://www.nature.com/articles/s41422-022-00759-y
机理未明的阿尔兹海默症
阿尔兹海默症(Alzheimer’sDisease, AD),俗称“老年痴呆”,是痴呆症(Dementia)中最常见的类型,超过了其他常见的神经退行性疾病如帕金森式综合征、“渐冻人”ALS等疾病患病人数的总和。正如其俗名所示,阿尔兹海默症多发于老龄人群;随着我国人口老龄化日益显著,中国现今约有1000万名的阿尔兹海默症患者,排名世界第一。
“我感觉我的叶子要掉光了,风雨裹挟着我的树叶,我已经搞不清楚所发生的一切。”电影《困在时间里的父亲》中,由曾摘得奥斯卡最佳男主角的演员安东尼·霍普金斯扮演的阿尔兹海默症患者,无助地道出了这类疾病的苦痛。数据显示,从确诊到离世,阿尔兹海默症患者平均拥有4-8年的寿命,在此期间会经历失忆、语言障碍、认知障碍直至全身衰竭,无论是对患者还是对亲属,都会造成巨大的伤痛和折磨。
然而时至今日,阿尔兹海默症的原理仍尚未明确,我们对它的发生机制知之甚少。学界存在着几种假说,Aβ假说是其中较为主流的说法之一,即β-淀粉样蛋白(Aβ)过度表达聚集成了淀粉样斑块,这些在大脑里“意外”聚集的蛋白质,诱发了阿尔兹海默症。基于此假说的药物研发,尽管产生了一些富有争议的结果,但遗憾的是目前没有任何药物能够完全逆转AD的疾病发展。
全球最大制药公司之一的辉瑞,尽管对AD药物的市场评估价值超过了一万亿美元,但受制于尚未明确的AD致病机理,也难以研发出真正有效果的药物;2017年,辉瑞在经历了一系列失败后退出了AD制药尝试。
最强风险基因:APOE4
“Genes never lie”,基因从不撒谎。亨廷顿疾病、唐氏综合症、乳腺癌……这些疾病曾经困扰人类,从致病基因出发找到相应的生化通路,进而阐释致病机理并开展药物研发,被一次又一次地证明是破解这些疾病最有效的方法。近30年来,伴随着基因测序技术的发展及AD病人基因库信息的完善,全基因组关联研究(GWAS)确定了APOE4是AD最强的风险基因。这引起了施一公研究组的重点关注。
APOE基因位于人类的第19号染色体上。正如我们所知道的,基因要行使功能,需要翻译成蛋白质;APOE,主要负责编码载脂蛋白E(即APOE蛋白)。
APOE蛋白,是人体载脂蛋白之一,主要参与人体脂蛋白的转化和代谢。比如,我们人体肝脏所产生的胆固醇,可以“搭载”APOE蛋白,通过血液运输到身体的各个部位。APOE蛋白全长有299个氨基酸,在人群中有APOE2、APOE3和APOE4三种亚型。这种差异是由一个微小变量引起的:在299个氨基酸中,当两个位点的氨基酸(第112个和158个)不同时,就会产生不同类型的APOE蛋白。
决定这一关键性氨基酸差异的,便是“生产”APOE蛋白的APOE基因。在基因中,每三个碱基编码一个氨基酸。与APOE2、APOE3和APOE4蛋白相对应的基因也存在三种形式,对应这些蛋白亚型的差异仅仅存在于2个碱基上。然而这样微小的差异,却能蝴蝶效应般引发人体巨大的生理差异。
从传统意义上说,APOE基因主要与体内的脂肪代谢功能相关,但相关研究发现,它也指向了阿尔兹海默症的不同风险等级。人类基因组是含有两组染色体的二倍体,也就是说任何基因都有两个拷贝、两个“待填选项”,在第19号染色体上亦然。科学家发现,APOE2的携带者,不容易患AD。
对于APOE4的携带者:当基因中有一个拷贝的APOE4,AD患病几率将增加3倍;当两个拷贝都是APOE4时,AD的患病风险则会提高8至12倍,高出接近一个数量级。这意味着,APOE4的致病风险呈现明显的剂量效应;此外,APOE4携带者的平均患病年龄也提早了4-6年以上。
正因如此,APOE4被视作是阿尔兹海默症的最大风险基因。但事实上,APOE4和APOE2基因所相差的仅仅是两个碱基,它们的产物蛋白差的不过是两个氨基酸。为何如此细小的差异能够引发差之千里的效应?施一公研究团队推测,这背后或许正潜藏着破解AD之谜的关键信息。
他们有了一个朴素的疑问,是否存在“掌管”记忆的蛋白,与APOE4蛋白发生了相关关系呢?
“掌管”记忆的蛋白,它可能是谁?
与此同时,施一公团队也密切关注着另一领域的研究进展:记忆。正如我们所熟知的,记忆衰退是AD最显著的临床表现之一。记忆是怎么形成的,众说纷纭,但它一直都是神经生物学领域的圣杯。由此,施一公研究团队的目光逐渐聚焦到了另一号关键角色上:LilrB3蛋白。
2000年,犹太裔神经科学家Eric Kandel获得诺贝尔生理和医学奖。他对于海兔神经突触可塑性的研究为大家提供了一个关于记忆的共识:神经突触的连接和记忆的形成有很大的关系。
小胶质细胞,正与神经突触密切相关。它是神经胶质细胞的一种,为中枢神经系统的免疫细胞,能够对大脑中的“垃圾”(比如死亡的神经元)进行清理,也能对神经突触进行修剪(即“吃掉”,吞噬)。通常来讲,人的神经突触数目在两三岁左右达到峰值,也就是我们所说的婴儿“拥有无限可能”;此后,小胶质细胞就会发挥作用,进行剪切,除掉那些没有被“训练”过的突触;随后,这类免疫细胞一般会进入休眠期。
过去十年间,对大脑中的这一类免疫细胞的研究,产生了突破性的进展。2011年,《科学》杂志首次报道了小胶质细胞对神经突触的吞噬作用是神经发育重要的机制。2016年和2021年,《科学》两度报道小胶质细胞对于神经突触的“剪切”功能会在AD患者中被异常激活,从而导致AD最大的症状“失忆”。也就是说,原本理应在“沉睡”的小胶质细胞,又“活跃”了,甚至开始乱“剪”神经突触了。
LilrB3蛋白,是一类主要在小胶质细胞中表达的蛋白。与著名的免疫“检查点”蛋白PD-1、SIRPα一样,LilrB3也是一个免疫“检查点”(可理解为免疫功能“开关”)蛋白;它的下游是ITIM结构域,控制着小胶质细胞的激活——换句话说,小胶质细胞是否“醒着”、能够执行功能,正与LilrB3有关。同时,研究团队也注意到,早在2008年,美国科学院院士Carla Shatz就在《科学》发文报道人源蛋白LilrB3的鼠源同源蛋白PirB在神经突触“剪切”中扮演了重要的角色。所谓同源蛋白,意味着这两种蛋白具有较高的相似性,而且功能也相近;这似乎在暗示LilrB3,可能与人体神经突触的剪切也有密切联系……
然而,LilrB3蛋白长期被归类为“orphan receptor”(孤儿受体),它的受体一直未知。LilrB家族存在与APOE4发生结合的蛋白吗?它会是LilrB3吗?
从猜想到验证:最强基因和神秘蛋白的关系
综合大量的研究成果以及实验探索,施一公研究团队逐渐建立起了一个关系到阿尔兹海默症机理“另起山头”的大胆猜测:LilrB家族蛋白和APOE蛋白有相互作用,并且只和APOE4结合而不与APOE2结合。如果这种猜想成立,那么这种相互作用,有可能解释了AD的生物化学原理:APOE4与LilrB蛋白的结合,“激活”小胶质细胞,导致了神经突触的剪切,进而致使失忆并引发AD。这样的结合,是否正如游戏中的精巧“机关”,控制着记忆的消失?
这是一个原创性的猜想。下一步,便是验证这样的猜想是否“道破天机”。
通过一系列生物化学实验,研究团队系统性地研究了LilrB人源家族的五个同源蛋白LilrB1/2/3/4/5和APOE三个亚型APOE2/3/4的相互作用。令人惊喜的是,最终,他们发现虽然LilrB1/2/3/4/5高度保守,但是LilrB3和APOE有特异性的结合。并且,正如预想的一样,APOE4和LilrB3有结合,APOE3结合较弱,而APOE2几乎完全不结合(图2)。
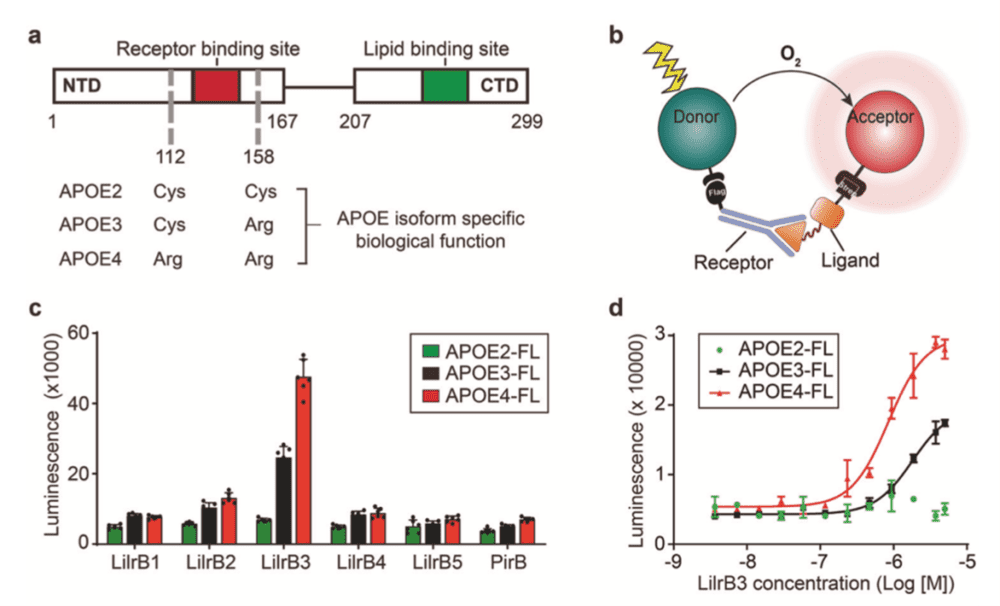
进一步,他们也证实了小胶质细胞因为这种结合而“苏醒”的事实,即APOE4在结合LilrB3之后,导致小胶质细胞进入激活状态(图3)。在敲除了LilrB3受体后,APOE4并不能引发小胶质细胞的激活,证明了APOE4-LilrB3的结合对小胶质细胞的激活特异性。
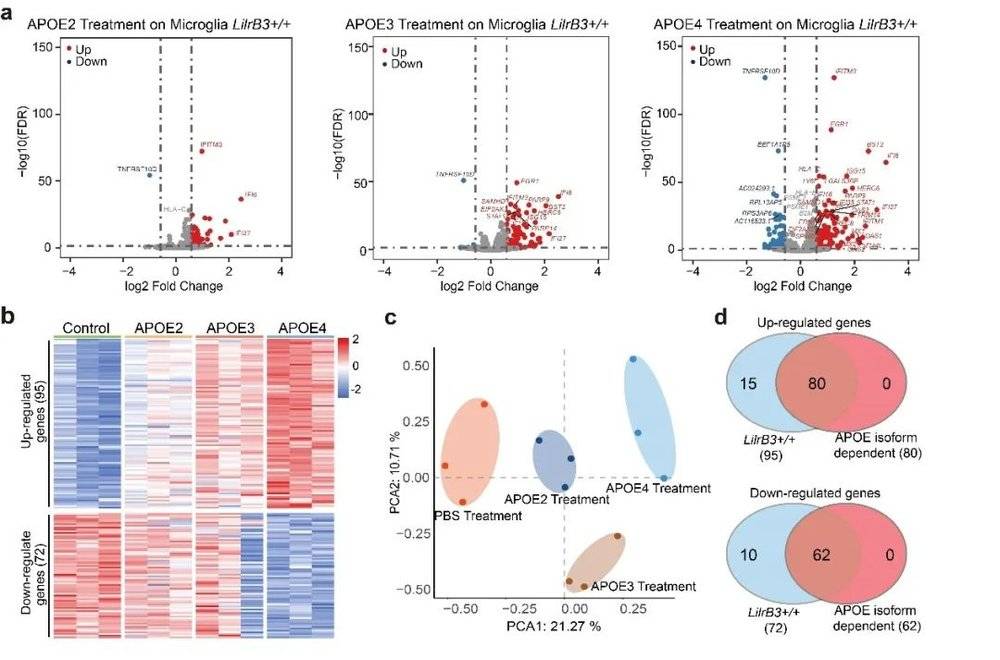
同时,本研究还通过生化实验证实了LilrB3的D2和D4结构域,是APOE4的结合位点,并通过生化实验结果提出了APOE2的NTD和CTD结合阻挡了结合位点这一模型,解释了APOE4结合LilrB3而APOE2不结合的原因。此外,本研究还用冷冻电镜解析了APOE4和LilrB3的结合结构(图4),揭示了结合细节,进一步证实了生化实验的猜测——这也是世界上第一个被解析的APOE蛋白和受体结合的结构信息,可能为进一步的药物设计提供重要信息。
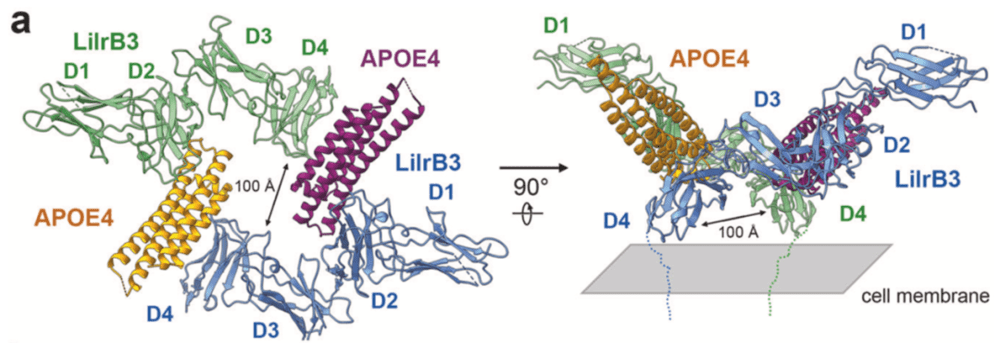
综上所述,本研究报道了APOE4在结合小胶质细胞免疫检查点蛋白LilrB3之后,可以导致小胶质细胞进入激活状态;该激活状态最近也被其他文献报道和阿兹海默症的发病存在关联。由此,本文找到的遗忘的“机关”,可能为APOE4导致AD提供了一个全新的分子机理解释,为人类征服AD带来了一线曙光。
阿尔兹海默症领域对人类来说,一直是棘手的重大疾病;探寻其背后的机理,正犹如大海捞针,需要科研工作者天赋性的探索直觉,和沉住气做基础研究的毅力。本项研究始于2014年,从最初的猜想,到生化实验验证提出模型,再到解出结构并在细胞模型中得到实验结果,完成对猜想的证明,历经八年,终铸一剑。
本文的共同通讯作者、共同第一作者,西湖大学生命科学学院博士后周家耀经历和见证了本项研究的全程,他介绍说除了科学假说,本项研究中最难的,是做重大的、原创的基础科学问题的“坚持”和“勇气”。在别人做一些相对简单但能发“大文章”的课题的时候,静下心,沉住气,“坚持”做能改变世界的研究的初心。在博士5年级没有任何成果无法毕业的情况下,仍不放弃继续探索的“勇气”,相信直觉,把路“走通”。
接下来,施一公研究团队将延续本研究的成果,向阿尔兹海默症的药物研发发起新的征程。同时,由于APOE基因、LilrB蛋白也与癌症相关,他们也将把视线同步投向抗癌领域。
西湖大学生命科学学院施一公教授和西湖大学生命科学学院博士后周家耀为本文的共同通讯作者。西湖大学生命科学学院博士后周家耀、清华大学生命科学学院博士生王雨蒙为本文的共同第一作者。西湖大学生命科学学院博士后黄高兴宇为结构解析提供了帮助,安徽医科大学朱昱敏副教授为RNA-seq数据分析提供了帮助。清华大学生命科学学院博士后金辰、原科研助理杨敏,西湖大学生命科学学院博士生敬丹、汲凯,参与了本研究的部分工作。本研究获得了科技部、国家自然科学基金委、西湖大学和北京生物结构前沿研究中心(清华)的相关经费支持。
本文来自微信公众号:西湖大学WestlakeUniversity(ID:westlakeuni)

