本文来自微信公众号:西湖大学WestlakeUniversity(ID:westlakeuni),原文标题:《重大突破!西湖大学蔡尚团队首次证实细菌是乳腺癌转移的重要帮凶》,题图来自:视觉中国
世界卫生组织数据显示,在2020年全球新发癌症中,乳腺癌成为全球第一大癌,我国乳腺癌发病率也在逐年攀升。作为女性最常见的恶性肿瘤之一,影响乳腺癌进展的因素十分复杂且尚未明晰,科学家们一直致力于寻找导致乳腺癌恶化的驱动力,希望能找到对应的解决办法。
近日,西湖大学生命科学学院蔡尚团队取得重大突破。北京时间4月7日,他们在《细胞》(Cell) 在线发表了题为“Tumor Resident Intracellular Microbiota Promotes Metastatic Colonization in Breast Cancer”的最新研究论文,首次证实乳腺癌组织中存在多种独特的“胞内菌”,并揭示它们在肿瘤转移定植过程中所起的关键作用。这一理念是对传统肿瘤转移理论的重大突破,为深入理解肿瘤转移及临床治疗乳腺癌提供了全新的思路。

传统观念认为,因为免疫系统的存在,人体绝大多数组织器官(除肠道、口腔、皮肤外)内部处于无菌状态,肿瘤组织亦然。
但在2020年左右,以色列及美国的部分科学家研究发现,细菌也是癌症本身的组成部分,它存在于结直肠癌以外更广泛的癌症类型中,例如胰腺癌、肺癌、乳腺癌等。这类细菌绝大多数存在于细胞质内,称之为“胞内菌”。
科学家们猜测,正是因为胞内菌位于肿瘤细胞内,所以才躲过人体免疫系统的攻击,存活下来。
那么,胞内菌在肿瘤发生、发展的过程中扮演着什么样的角色?是可有可无的旁观者,还是推动肿瘤进展的参与者?
之前研究认为,肠道菌群可以通过调节免疫系统,或通过产生的代谢物间接调控癌症的进展,但是至今没有证据表明肿瘤细菌能直接参与癌症的发生发展。尤其是在肿瘤中检测到的细菌很少,让人更加怀疑,这么低生物量的肿瘤微生物,能否对肿瘤进展产生重大影响。
2017年,刚刚回国加入西湖大学的蔡尚,对这一问题启动了专项研究。
蔡尚本科毕业于北大,博士毕业于印第安纳大学,曾在斯坦福大学干细胞与再生医学研究所工作7年,一直专注于乳腺癌的研究。
基于经典的小鼠自发乳腺癌模型,蔡尚带领研究团队构建了严格的肿瘤菌群研究体系,探索肿瘤微生物在肿瘤进展中的作用。
彼时,“胞内菌”还是一个未被证实的猜想,他们的首要任务是找到“对手”。
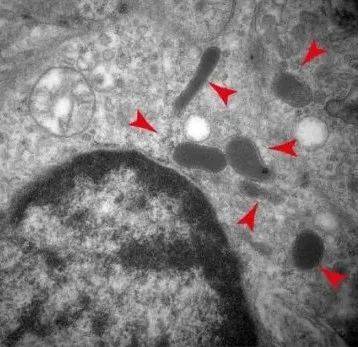
“胞内菌”在肿瘤细胞内的含量很低,研究团队不断改良检测和染色方法,提高了灵敏度、信噪比和准确性,终于观察到小鼠肿瘤里的细菌定位,并通过高分辨率的电镜清晰地看到了细菌存在于细胞质内。
然后,探索这些细菌的功能成为他们的工作重点。
一个简单的思路是:清除这些细菌,看看肿瘤会发生什么变化。
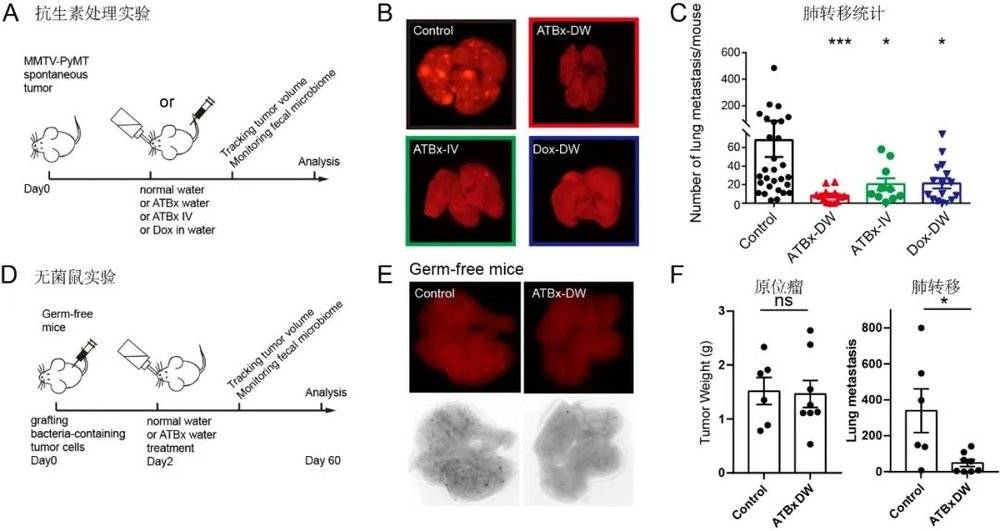
常规的清除方法是使用抗生素。但如何确保抗生素只定向清除肿瘤细菌?
鲜有可以遵循的实验方案。研究团队一切从零开始,不断优化抗生素的处理方法,调节抗生素组合种类和注射方式的搭配,最终实现“定向”清除肿瘤菌群的目的。
结果显示,清除肿瘤菌群之后,肿瘤重量并没有受到影响,但肺转移显著下降。这表明,肿瘤菌群很可能影响的不是肿瘤的生长,而是转移过程。
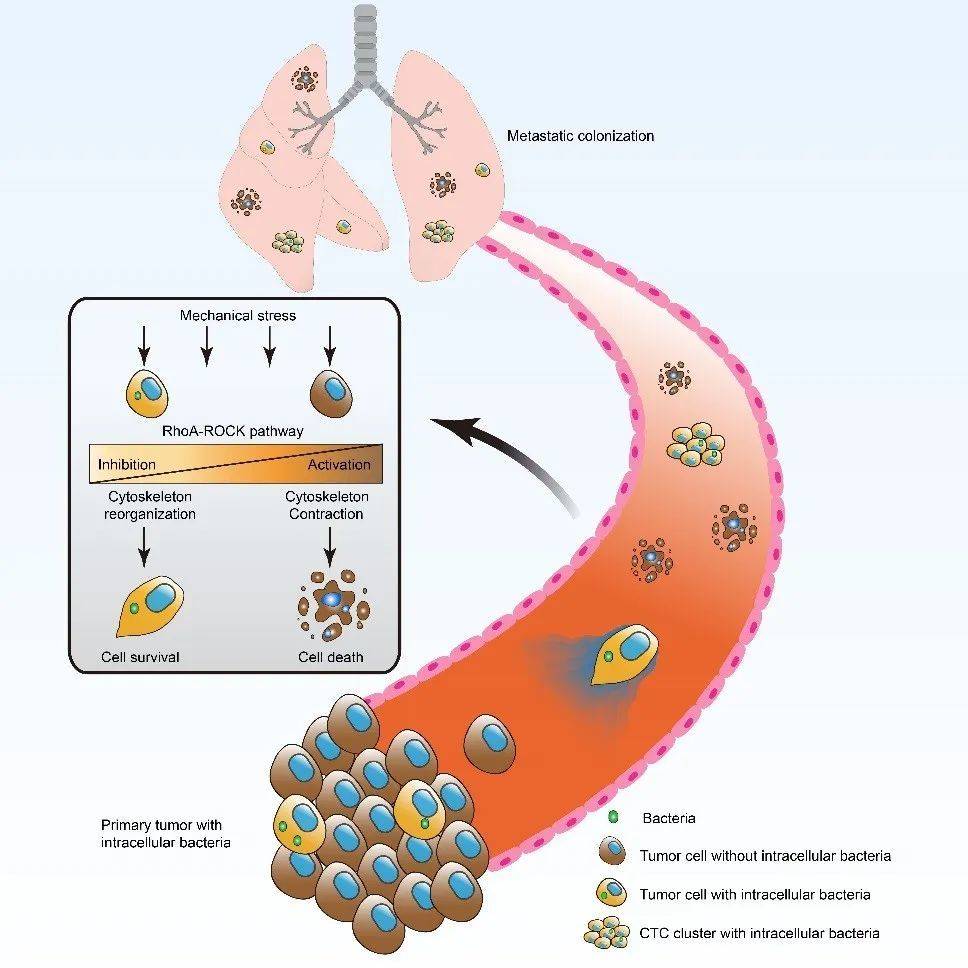
基于此发现,研究团队提出假设:肿瘤组织中的胞内菌会和肿瘤细胞一起迁移到达远端器官并影响转移。也就是说,肿瘤里的细菌会跟着肿瘤细胞一起跑到身体的其他部分。
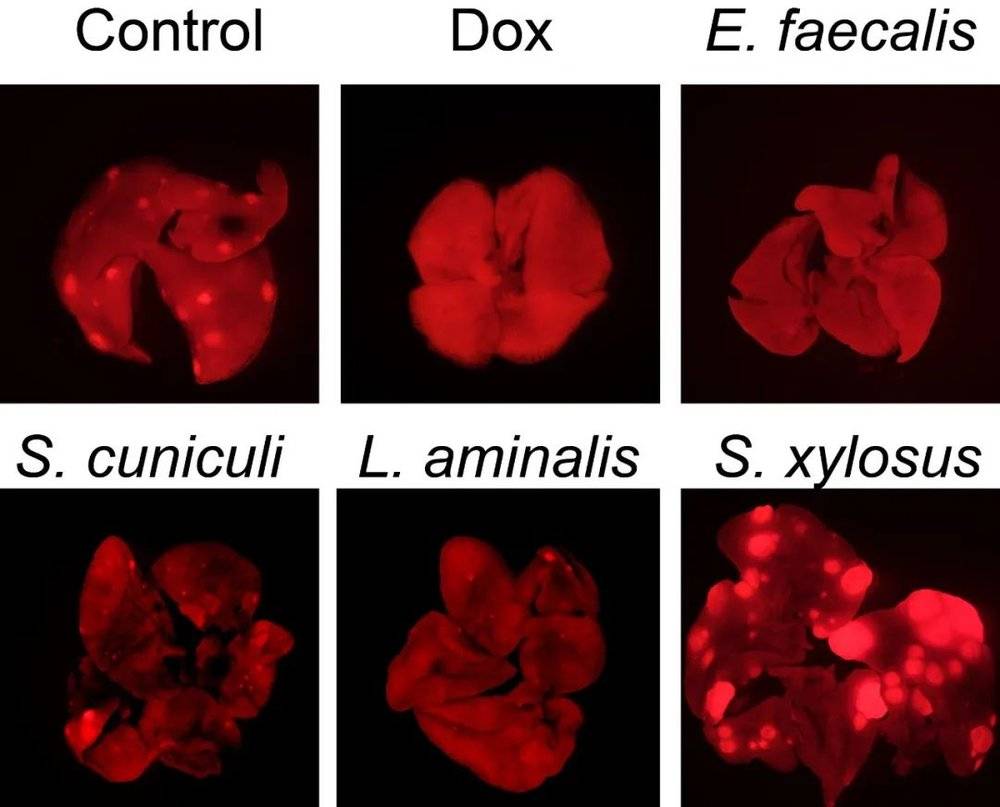
为了验证这个假设,他们对原位肿瘤、肉眼可见的肺转移灶、含有微小转移灶的肺组织、以及正常的肺和乳腺组织进行细菌16S测序。分析结果显示,早期肺转移的细菌可能仍带有原位肿瘤的菌群特征,而随着肿瘤的生长、扩散,渐渐开始受肺部微环境的影响。
再通过分离并染色循环肿瘤细胞,研究团队看到循环肿瘤细胞能够带着胞内菌“跑到”远端器官;而回输这些胞内菌到肿瘤细胞内,可以看到肿瘤细胞在人体内“跑动过程中的生存能力更强”,甚至那些不容易转移的乳腺癌,在输入胞内菌以后,也开始转移。
这就有力地证明了胞内菌可以促进肿瘤细胞的转移。
知其然,知其所以然。为什么胞内菌可以促进肿瘤细胞转移?
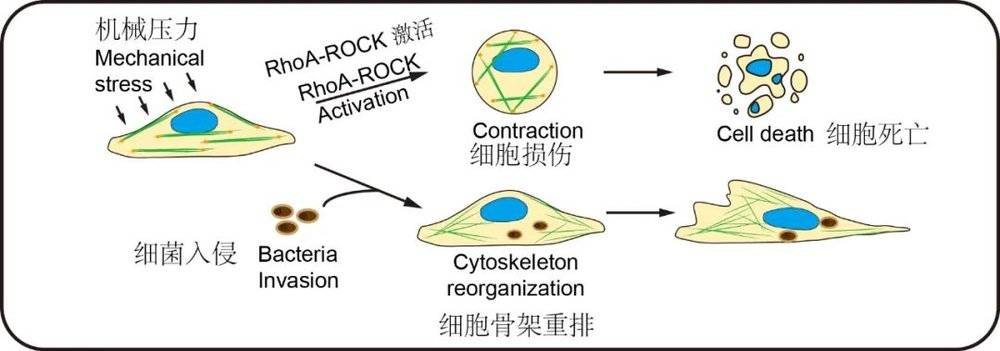
蔡尚解释说,事实上,在转移过程中,癌症细胞没有我们想象中那么“威力无边”,血管里的血压(液流压力)会对它造成损伤。但他们发现,胞内菌入侵肿瘤细胞后,会通过特定的信号通路(RhoA-ROCK)来重塑细胞骨架,帮助肿瘤细胞抵抗血管里的压力,避免转移过程中受到损伤。
这就完美解释了为什么拥有胞内菌的肿瘤细胞拥有更强的能力跑到远端器官。
最后,研究团队从小鼠回归到人体,收集了配对的乳腺癌病人的肿瘤组织、癌旁组织和淋巴结组织,用qPCR结合16S测序定量和定性地分析各自菌群的组成。结果显示,小鼠乳腺癌组织和人乳腺癌组织具有相同的微生物谱和动态变化,这表明,人乳腺癌菌群可能在人癌症发生和进展中起着相似的作用。
历时近5年,从猜想、假设到一步步证实,蔡尚团队的研究鉴定了肿瘤微环境中长期被忽视的新成分,揭示了影响肿瘤转移的新因素,开拓了肿瘤研究的新方向,为临床控制肿瘤转移提供了全新的视角。
西湖大学生命科学学院蔡尚研究员为论文的通讯作者;西湖大学生命科学学院博士后付爱坤,西湖大学博士生尧冰清和董婷婷为本文的共同第一作者。此外,西湖大学高性能计算中心李南老师、黎航老师对本课题做出了重要贡献。本课题受到国家自然科学基金委的资助;课题实施过程中得到了西湖实验室、西湖大学实验动物中心、生物医学实验技术中心、高性能计算中心的大力支持。
一场历时5年的探险
看到研究结果的那一刻,蔡尚很兴奋。
“这个课题风险很大,充满未知,当我决定启动研究的时候,连肿瘤菌群是否真的存在都极具争议。”蔡尚说。
最初的idea来自蔡尚在斯坦福做博士后时的一次探讨:什么基因在影响乳腺癌肿瘤的发展。“构建诱导敲除基因的小鼠模型时,我意外地发现不需要敲除这个基因,只需要加入诱导剂(一种抗生素),肿瘤的转移就会受到影响。我觉得很不可理解。”
2016年,在实验过程中,抗生素又一次引起了蔡尚的关注。此前有文章报道说,抗生素会影响肿瘤的进展,但原因众说纷纭。蔡尚敏锐地意识到,肿瘤的转移可能与抗生素杀伤细菌的能力有关。
他大胆假设:肿瘤里很可能存在细菌!
而那时候的普遍认知是,除了肠道肿瘤,大多数器官里的肿瘤是无菌的。因为人体有很强大的免疫系统,一旦有细菌,免疫系统会迅速把它清除。
现在回忆起来,蔡尚依然觉得当时的想法有点crazy。但科学家的工作,本身就是在“探险”,“我被这个有趣的现象强烈吸引,觉得应该搞清楚其中的奥秘”。
无前车之鉴,无经验可循,他带领着西湖大学年轻的团队成员,从研究体系到实验方法,从老鼠模型的培育传代、更新换代到抗生素使用方法的改良,一切从零起步,从头构建。过去5年来,他几乎50%以上的精力都投入到了这项研究中。
直到2020年Science的一篇论文中,科学家们才较为全面清晰地证实了肿瘤内存在细菌,证实了蔡尚最初的假设是正确的,这个时候,蔡尚团队已经对肿瘤菌群的生理功能收集了大量数据,有了更深入的认识。他们想更进一步,搞清楚细菌在肿瘤转移过程中究竟起了什么作用。
“感谢学校给了我足够的时间和空间, 并且营造了敢于探索未知,不畏艰难失败的科研氛围。”蔡尚说。
作为最早一批加入西湖大学的PI之一,过去5年他在科研成果方面算不上高产,甚至有点“默默无闻”。
“所幸学校并没有这方面的考核指标,只是强调要做最前沿的研究。”充足的科研经费和优厚的薪酬,也让他能够排除杂念,沉心静气,坚持做一项“开创而不跟随的研究”。
High risk,high reward,在团队成员辛勤浇灌下,最初那粒“灵光一闪”的种子,最终在鼓励自由探索的学术土壤中生根发芽。
但蔡尚强调说:“这一领域刚刚兴起,还存在众多未解之谜,抗生素的临床使用也充满了复杂性,如何利用这一发现指导临床治疗仍是一个复杂而迫切的科学问题,需要更多科研工作者去做大量基础而扎实的工作。”
在他看来,这项成果只是在乳腺癌研究领域打开了一扇小窗,至于窗外的风景如何,希望有更多后来者一起眺望。
本文来自微信公众号:西湖大学WestlakeUniversity(ID:westlakeuni)

