本文来自微信公众号:观网财经 (ID:tiequanhe),作者:韩宜珈,题图来自:视觉中国
1月8日晚,国家医保局公布了新冠治疗药品参与2022年医保药品目录谈判有关情况,新冠治疗药物中,阿兹夫定片、清肺排毒颗粒谈判成功,辉瑞新冠药(Paxlovid)未能谈判成功。
那么Paxlovid,是否真的无可替代呢?
紧急获批的Paxlovid与正常推进的国产小分子药
在市场的紧迫诉求下,国内外多家药企都加快了自身新冠抗病毒药物的研发进度。截至目前,国内已有两款进口新冠小分子口服药获批上市。
除了辉瑞以外,另一款药物为去年12月29日获批的默沙东公司新冠病毒治疗药物莫诺拉韦胶囊(商品名称利卓瑞/LAGEVRIO)。根据最新消息,莫诺拉韦首批已经抵达上海,定价为1500元每瓶。
国内厂商则只有真实生物的阿兹夫定已获批。
除此之外,进度最快的是日本平安盐野义新冠药Ensitrelvir,已向中国国家药品监督管理局药品审评中心提交新药上市申请相关准备资料。
对国内新药上市来说,药物从研发到审批上市主要经历临床前研究、临床试验审批、临床试验以及新药上市审批几个阶段,药企提交上市申请资料后,通过一系列审查,最终核发药品注册证书。
以日本盐野义新冠药为例,进口药物提交新药上市材料之后,通过审批便可以上市使用。上市申请的常规程序约为半年时间,加急审批则能缩短至一到两个月。
而由于国内外药物审核程序不同,如今市面上进入中国的两大进口新冠药:辉瑞Paxlovid与默沙东的莫诺拉韦其实都没有完整通过临床Ⅲ期试验,而是获得了紧急许可。
去年6月,辉瑞公布,旗下新冠口服药Paxlovid又一项II/III期临床失败,未达到症状持续缓解的主要终点。Paxlovid至今已经做了三个三期临床试验,目前的结果是:一个成功,两个失败。
然而,由于其中一次Ⅲ试验结果可使COVID-19相关的住院或因任何原因死亡的风险降低89%,依托这一数据,辉瑞向美国申请了紧急授权许可申请。
2021年12月,Paxlovid被FDA授权紧急用于治疗轻度至中度COVID-19的成人和儿科患者,2022年12月,辉瑞宣布FDA延长了其新冠口服治疗药物PAXLOVID的新药上市的审查期,预计2023年5月会重新开始考虑批准Paxlovid的上市。也就是目前为止,Paxlovid虽然获得了FDA的紧急授权许可,但是其并未在美国被正式批准上市。
在中国的情况是,2022年2月11日,Paxlovid获中国药监局附条件进口批准,用于治疗成人伴有进展为重症高风险因素的至中度COVID-19患者。
默沙东的莫诺拉韦则是作为全球首款获批的口服抗新冠病毒药物,率先于2021年11月在英国获批上市,同年12月先后获美国食药监局(FDA)紧急授权及日本紧急特例批准,但是也未在美国正式上市,此后在今年获得了国内的紧急获批上市。
与美国紧急授权相比,国内的药物研发及上市仍在按正常节奏推进。
由于此前《新英格兰医学杂志》发表临床数据,显示君实生物VV116治疗新冠效果不输Paxlovid,让君实生物VV116的研发进度格外受到业内瞩目。
根据公告,君实生物VV116片已完成一项对比奈玛特韦片/利托那韦片组合药物(PAXLOVID)用于伴有进展为重度包括死亡高风险因素的轻至中度新型冠状病毒感染患者早期治疗的III期临床研究,同时还在不同的人群中开展了多项VV116的国际多中心III期临床研究。
该药已于2021年底在乌兹别克斯坦获批用于新冠治疗,并且已完成国内III期临床试验且相关研究发表于国际顶刊《新英格兰医学杂志》。
同样处于新冠药III期临床研发阶段的,还包括众生药业、先声药业以及前沿生物、广生堂、开拓药业。
先声药业发与中国科学院上海药物研究所、武汉病毒研究所合作的抗新冠病毒(SARS-CoV-2)候选创新药先诺欣,评估治疗轻中度COVID-19(新型冠状病毒肺炎)成年感染者的有效性和安全性多中心、随机、双盲、安慰剂对照的II/III期临床研究,已完成全部1208例患者入组。
在进度上处于国内3CL靶点药物第一位,预计最快于2023年2月上市。
其他企业中,科兴制药的新冠小分子口服药SHEN26胶囊处于II期临床研究成功阶段,完成全部受试者入组;信立泰则刚获得国家药监局核准签发《临床试验批准通知书》,同意SAL0133片开展治疗成人轻型/普通型新型冠状病毒肺炎(COVID-19)适应症Ⅰ期临床试验。
病毒学专家常荣山向观察者网表示,君实生物VV116是基于瑞德西韦改造而来,有较好的临床数据。按照目前进度,君实生物VV116可能率先实现国内上市,先声药业的先诺欣紧随其后。
两种路径的作用机制
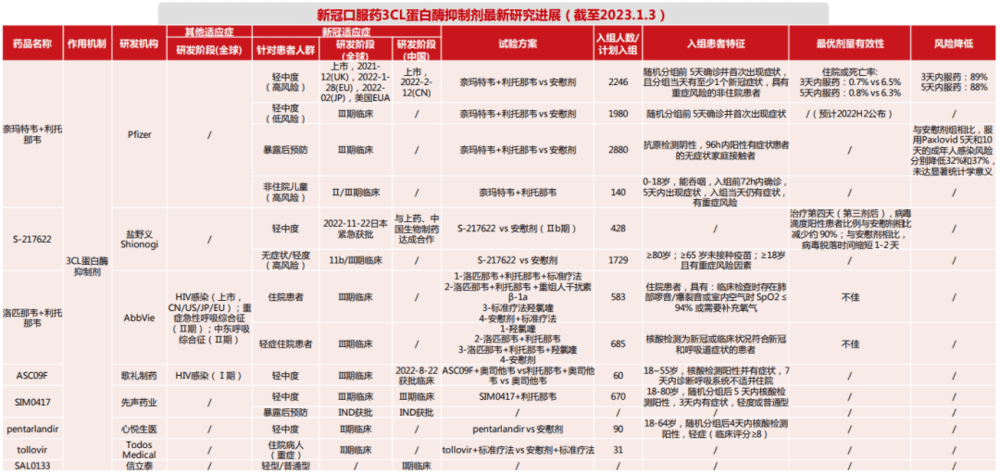
而从作用机制上来区分,如今市面上的新冠口服药物主要分为3CL抑制剂和RdRp抑制剂两大种类,以及开拓药业研发的AR拮抗剂。
主流的两种药物其实采用的都是常规的抗病毒路径。主要通过靶点药物,作用于相应位点。
新冠病毒的RNA依赖性RNA聚合酶、PLpro、3CL蛋白酶及解旋酶等病毒蛋白酶是主要的抗病毒的靶点。
RdRp抑制剂和3CL蛋白酶抑制剂是针对病毒生命周期的不同关键靶点而开发的药物或候选药物。
在这其中,由于辉瑞Paxlovid的成功,让3CL抑制剂成为了如今新冠口服药的主流路径,大部分药企也主要选择这一研发方向。
作为另一主要路径,RdRp抑制剂也具备自身的特性,那便是广谱性与保守性。
医学界认为,RdRp是对抗新冠病毒的前途靶点。从作用机制方面来看,RdRp是RNA病毒遗传物质复制和转录的关键酶,可以让病毒难以“繁殖”。因此,RdRp被认为是抗RNA病毒最有希望的靶点之一,新冠病毒也不例外。
与此同时,RdRp更加具备病毒的适用性。不仅针对新冠病毒不同毒株,即便是不同类型的RNA病毒,均能够应用。因此,RdRp抑制剂能够更广泛的应用于抗病毒路径,就比如RdRp在新冠病毒和“非典”病毒中的结构,相似度为96%。
RdRp抑制剂生产厂家科兴表示,RdRp靶点具有高保守性,可以应对新冠病毒变异,阻止病毒复制,并对其他多种冠状病毒具有广谱性。3CL抑制剂的生产厂家则表示,3CL抑制剂的疗效和安全性均优于RdRp抑制剂。
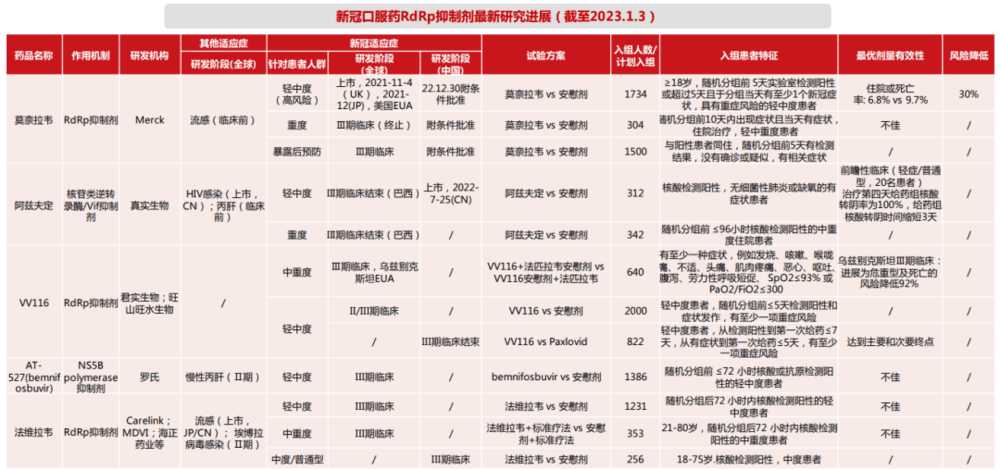
根据目前的临床数据,3CL抑制剂的临床效果也要优于RdRp抑制剂,因此大部分生产厂家选择了3CL抑制剂的研究路径。
从本质上来看,3CL与RdRp抑制剂都是医学界抗病毒的主要路径。不仅如此,两种药物都具有一定的研发基础。比如Paxlovid中的利托那韦片曾经应用于艾滋病治疗,这也是如今新冠口服药研发能够加速的原因。
救命药与商业化
随着新冠口服药的加速上市,药企的商业化进程也逐步加快。
国药控股日前发布消息,2022年9月,默沙东与国药集团签署合作框架协议,将莫诺拉韦在中国境内的经销权和独家进口权授予国药集团。2022年11月,默沙东与国药控股分销中心有限公司就莫诺拉韦在中国的进口和经销事宜签署经销协议。
盐野义新冠药还未在国内获批上市,但是国内的商业化已经开始推进。中国生物制药2022年12月29日晚公告称,旗下子公司正大天晴药业集团有限公司与平安盐野义有限公司签订新型冠状病毒感染治疗药物Ensitrelvir中国大陆地区的推广协议,合作期限为5年。
临床试验结果显示,Ensitrelvir针对奥密克戎毒株典型的COVID-19五大症状具有明显改善效果,抗病毒疗效显着,且安全性良好。
2022年6月8日,先声药业抗新冠药物生产基地建设项目于南京江北新区新材料产业园正式开工。该项目计划总投资16亿元,年产值预计超过20亿元,从立项到正式开工仅用时一个月。首期规划中可生产抗新冠口服药物原料药年产100吨,供应至少2000万人份抗新冠口服药物。
2022年6月5日晚,科兴制药公告称,全资子公司深圳科兴与信立泰及惠州信立泰签署CDMO技术服务及委托生产协议,深圳科兴委托信立泰及惠州信立泰开展SHEN26项目药品CDMO技术服务(包括但不限于药品注册阶段的技术转移、临床样品生产等)及原料药、制剂的委托加工。
虽然药物研发还在“进行时”,但新冠药物的商业化进程已经同步推进。这无疑也加剧了现在的竞争局面。
对于如今新冠口服药市场的竞争态势,CIC灼识咨询经理刘昕表示,未来新冠口服药市场仍存在剩余的竞争空间。从短期来说,对于大部分国内企业来说,能否在短时间内推出新的药品并保证产量至关重要。从长期来说,随着越来越多的企业加入到新冠药物的研发工作,企业能否够在价格上面取得优势会成为未来发展的关键。总的来说,从技术转化和产研结合两个方面来加强企业核心竞争力。
本文来自微信公众号:观网财经 (ID:tiequanhe),作者:韩宜珈

