9月21日是“世界阿尔茨海默病日”。今天,全世界60多个国家和地区将组织一系列活动对阿尔茨海默病进行科普和宣传,引起人们的重视。阿尔茨海默病,又被称为老年痴呆,主要表现为认知功能损害和精神行为障碍,其中最主要的症状之一就是随着疾病的进程患者的记忆力开始不断衰退——就像是枯萎的大树叶子一片片凋零一般,阿尔茨海默病患者的记忆也会慢慢消失。记忆为何会凋零?我们能否找回消失的记忆?就让我们一起探索记忆的奥秘。
本文来自微信公众号:nextquestion (ID:gh_2414d982daee),作者:阿莫東森、山鸡,编辑:Jiahui、EY,头图来自:《困在时间里的父亲》
上个世纪初,德国演化生物学家里夏德·西蒙(Richard Semon)提出了记忆印记(engram)的概念。他认为人们的特定经历能够激活特定群体的大脑细胞,使它们产生持续性的化学/物理改变。
在里夏德默默无闻的一生中,记忆印记的概念在科学界不为人知。而即使记忆印记在他去世后成为了心理学界的热门话题之一,在随后的一个世纪里,无数科学家也只是在找寻记忆印记的道路上迷失了方向。
近年来,随着新技术的出现,我们终于能“看见”记忆的足迹。通过操纵记忆印记,神经科学家们还初步实现了记忆的植入与擦除。
记忆印记
早在古希腊时期,亚里士多德便在《论灵魂》(De Anima)中写道,人们的经历能留下痕迹,就像“人们用图章戒指(在蜡油中)盖印一样[1]。” 是否真如亚里士多德所说,人们的感受所形成的记忆会在大脑中留下物理痕迹呢?
首个提出记忆印记的是德国演化生物学家里夏德·西蒙。在他的《记忆》(Mneme)一书中[2],西蒙将记忆印记定义为“一种由刺激带来的持续的、不可逆的潜在改变。”他认为,外界刺激能对神经系统造成持续性的改变,因此,系统才能保持记忆,对某个在久远过去经历的刺激做出同样的反应。西蒙的洞见远超前于他的时代,这或许也是他一生默默无闻的原因。尽管他的理论成功预测了一个世纪后的发现,西蒙明智地放弃了寻找记忆印记的任务。他认为:“以我们目前所掌握的知识而言,将这样一个问题推至分子领域,成功的希望十分渺茫,因此,我放弃这项任务[3]。”

许多年后,神经心理学家卡尔·拉什利(Karl Lashley)通过系统性实验探索了哺乳动物大脑中的记忆印记细胞。在他的经典实验中,拉什利训练小鼠在迷宫中进行数日的学习,记住能找到奖赏的路线。随后,他移除小鼠的部分大脑皮层,再次测试小鼠是否还能记住此前学到的路线。通过数次实验,拉什利发现,尽管移除皮层的大小与小鼠再次测试的成绩具有一定的相关性,他还是无法精确找到对小鼠记忆造成决定性影响的皮层位置[4]。在寻找记忆印记的道路上,命运没有垂怜这位神经学家。经过长达 30 年无果的寻找后,拉什利放弃了这个研究方向。
与拉什利相比,他的学生或许更加靠近记忆印记的本质。唐纳德·赫布(Donald Hebb)于1949年提出了赫布定律,认为经常同时放电的神经元会互相联合,形成细胞群。这种称为可塑性(plasticity)的现象兼顾了记忆所需的稳固性(stability,即记忆不能在形成后随意变动)和灵活性(flexibility,即在特殊情况下,记忆也需要允许改变)。但这种“经常同时放电,其间连结增强”的神经模式在后来的30年间都未能被验证,其潜在机制也因此不为人知。
1973年,蒂莫西·布利斯(Timothy Bliss)和泰耶·洛莫(Terje Lømo)发表了历史上第一篇有关长时程增强作用(LTP)的论文。布利斯与洛莫将电极插入至兔子的海马体中,利用高频刺激,试图模拟赫布提出的神经模式。在对突触前神经元进行高频刺激后,他们惊喜地发现,突触后神经元对突触前神经元发送的信号有了更大的回应,也就是说,它们之间的“沟通”变得更有效了。LTP的发现表明,神经元之间的连接受它们的活动规律调控。这样的细胞机制既满足了稳固性,也满足了灵活性,因此至今仍受到记忆领域的广泛关注。而记忆印记的相关研究,也将在几十年后从中脱壳而出。
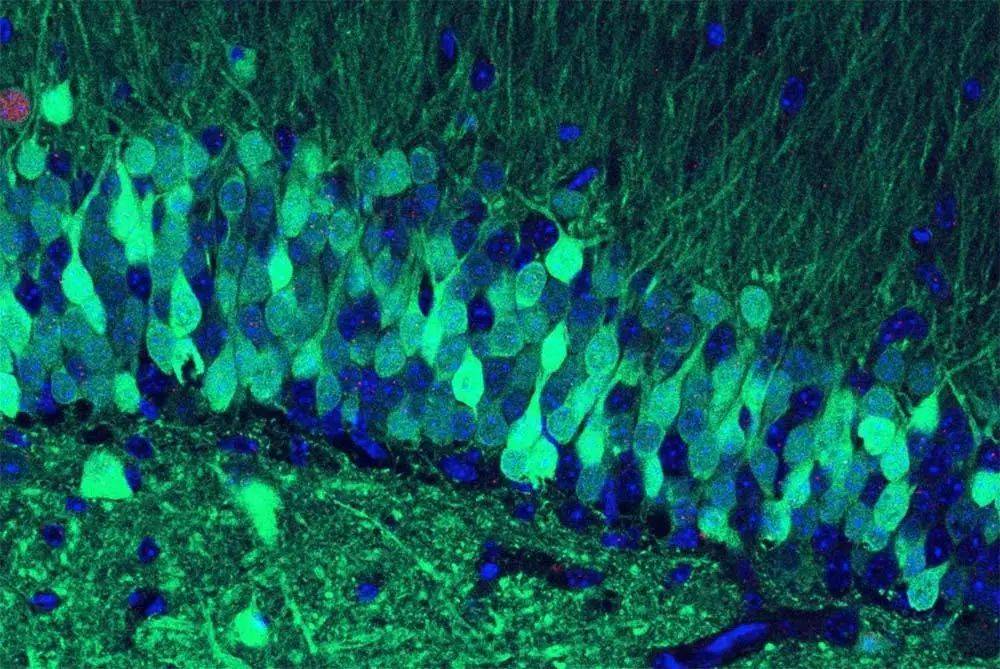
寻找记忆印记细胞
在一个世纪以前,西蒙将找寻记忆印记细胞的任务评价为“成功希望渺茫的重任”。但在近几年,新技术的出现却为我们带来了新的可能性。
2007年,梅福德实验室(Mayford Laboratory)率先在转基因小鼠的大脑中找到了证据[5]。这些转基因小鼠的神经元激活时,能产生一种荧光蛋白。通过检测这些荧光蛋白,研究者能够定位这些激活过的神经元。实验中,研究者在播放无害的声音刺激(条件刺激)同时对小鼠足部施加轻微电击(非条件刺激),经过数次重复训练后,小鼠习得条件反射,在听到无害声音刺激后也会因恐惧而产生僵硬反应。该团队经过对比发现,训练中的小鼠与三天后再次听见声音刺激时的小鼠,大脑中激活的神经元具有重复性。随后的一系列研究也支持了这个结论。
但是,要想证明记忆印记细胞确实是大脑中对过往经验表征留下的物理痕迹,我们还需要更加切实的证据。尽管由于缺乏精确的细胞定位技术,拉什利在长达三十年的研究中没能找到实证,但他的思路为后人带来了启发——如果记忆印记细胞中确实编码了记忆,那么抑制记忆印记细胞的活动,个体的记忆表现也应当受到影响。
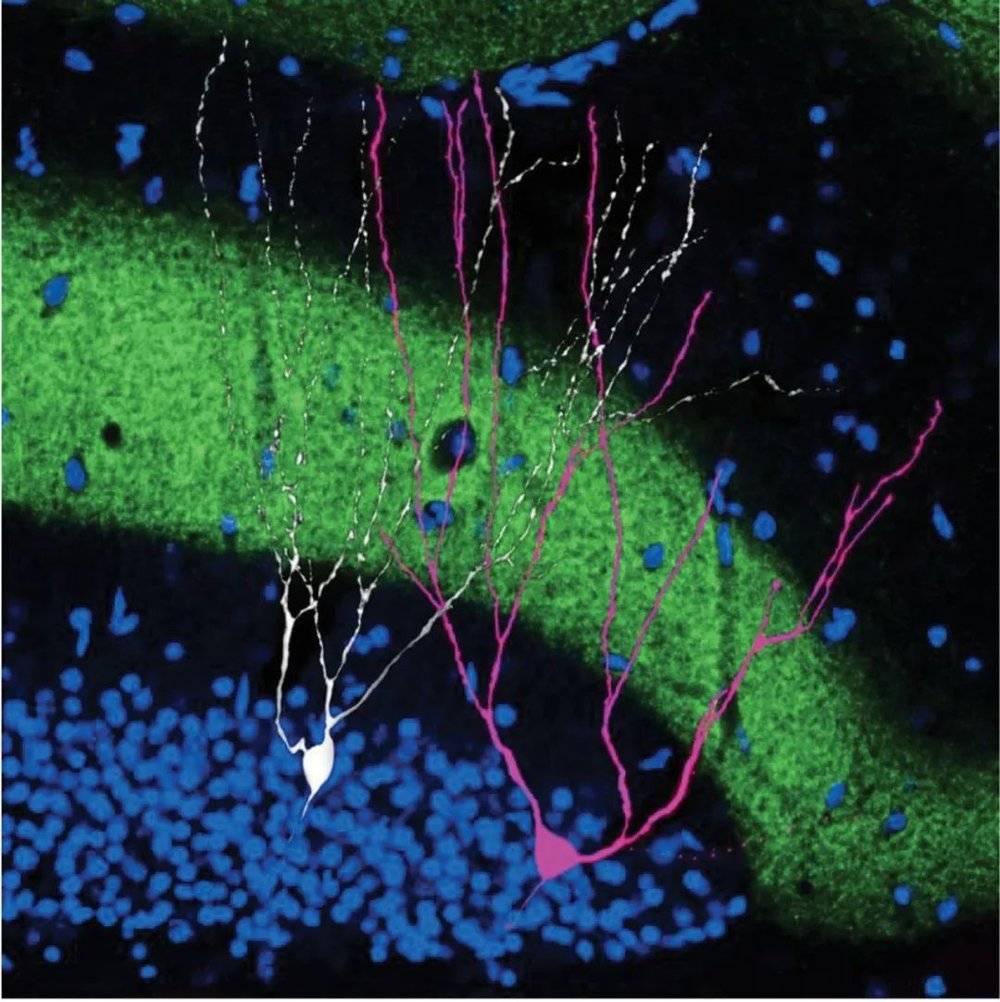
在博士后研究期间,希娜·A. 乔斯林(Sheena A. Josselyn)曾通过调节小鼠大脑神经元显著改变了小鼠长时记忆的表现。她认为自己可能无意间完成了拉什利的任务,而其后经过近十年的努力,她终于得出了记忆印记细胞存在的证明。2009 年,乔斯林的研究团队首次在细胞集合的水平找到了记忆印记的因果证据:通过杀死杏仁核内一组特定的细胞,他们成功抹去了小鼠脑海中特定的记忆[6]。
此前研究中,乔斯林证明了,在小鼠外侧杏仁核(lateral amygdala)中CREB蛋白水平过高的神经元可能与惊恐记忆有关。而在新实验中,他们训练小鼠对声音刺激习得惊恐反应,随后,他们使用一种能够精确定位过度表达CREB蛋白神经元(即记忆印记细胞)的病毒,将小鼠杏仁核中这部分神经元杀死。乔斯林发现,失去了记忆印记细胞的小鼠也随之失去了对惊恐经历的记忆。
乔斯林的成功掀起了一阵记忆研究的热潮,研究者们纷纷应用起这些能够精确操控记忆印记细胞的工具。如果说人工抹去特定的记忆为记忆印记的存在给出了更加切实的证据,随后的一系列研究为我们展示了,记忆印记细胞的发现为科学打开了无限的可能性。
通过调节记忆印记细胞改变记忆?
在2012年,来自麻省理工学院利根川进(Susumu Tonegawa)实验室的研究者们通过光遗传学技术首次证明了,照射特定神经元能够激活相应的记忆活动。通过这种方式,研究者们还篡改了小鼠的记忆联结,给它们植入了新的记忆。
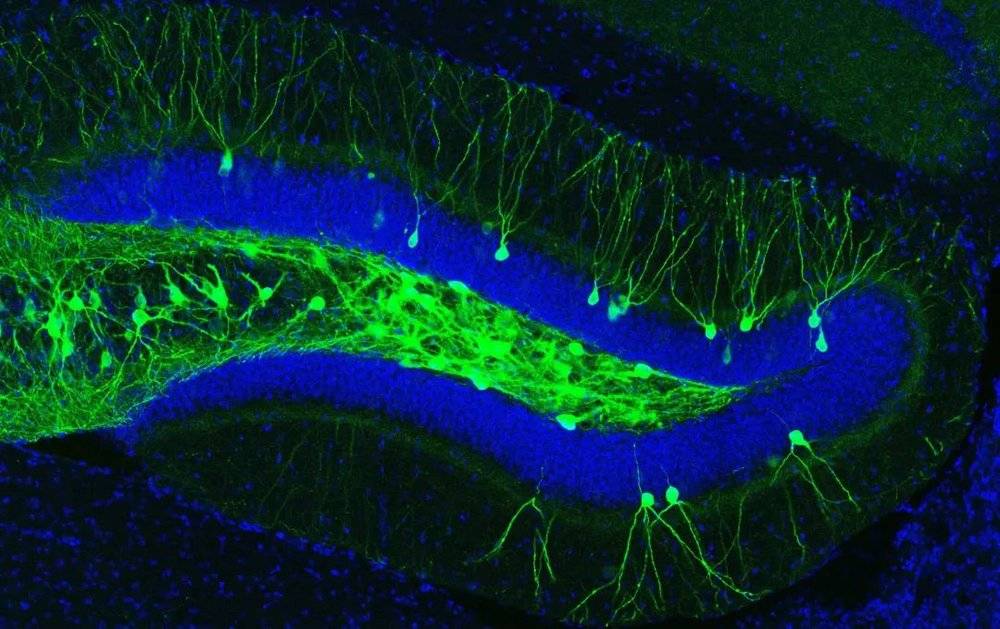
在这项研究中[7],研究者们针对的是小鼠大脑中另一与记忆相关的脑区:海马体。通过光遗传学技术,研究者们培养出了能够转录光敏感通道蛋白的转基因小鼠,其后对转基因小鼠施加轻微电击,小鼠因电击产生惊恐情绪,作出僵直反应。这种刺激使转基因小鼠大脑内与恐惧相关的神经元表达光敏离子通道。随后,研究者只需通过蓝光照射小鼠的海马,就能激活这些编码光敏蛋白的神经元,使它们回忆起惊恐的记忆。即便在没有经历过电击的新环境中,照射蓝光也能使小鼠感到恐惧,产生僵直反应。
在随后的另一项发表于《科学》的研究中[8],研究者们通过刺激小鼠的记忆印记细胞,为它们“植入”了人工记忆。研究小鼠首先被放置于A笼中。在小鼠探寻笼子时,研究者们记录下了小鼠大脑中激活的神经元。随后,研究者将小鼠转移至B笼并给其施与电刺激,小鼠因此表现出了恐惧反应。与此同时,研究者还激活小鼠在探索A笼时激活的神经元。激活这些记忆印记细胞,让小鼠误以为自己在笼A中遭受了点击,因此在回到安全的A笼后,小鼠仍旧表现出了恐惧反应,即便此时并没有遭到电击。
自西蒙提出记忆印迹的概念以来,技术的革新持续推动着研究者们对记忆的探索。近年来,科学家们逐渐将目光从啮齿动物转向了人类。通过精密的大脑成像以及数据分析技术,研究者们在人类大脑中找到了与记忆相关的神经表征[9]。
未来,通过调节记忆印记,科学家们或许能够帮助饱受阿尔茨海默病(AD)困扰的患者。就如乔斯林所说:“我们正处于技术发展的黄金时代,有了新技术,我们有望为过去的问题提供新的答案[10]。”
参考资料:
[1] 苗力田(译) (1992). 亚里士多德(第三卷) (p. 135). 北京: 中国人民大学出版社.
[2] Semon, R. W. (1921). The mneme. G. Allen & Unwin Limited.
[3] Semon, R. W., Duffy, B., & Lee, V. (2018). Revival: Mnemic Psychology (1923). Routledge.
[4] Lashley, K. S. (1950). In search of the engram. In Society for Experimental Biology, Physiological mechanisms in animal behavior. (Society's Symposium IV.) (p. 454–482). Academic Press.
[5] Reijmers, L. G., Perkins, B. L., Matsuo, N., & Mayford, M. (2007). Localization of a Stable Neural Correlate of Associative Memory. Science, 317(5842), 1230–1233. doi:10.1126/science.1143839
[6] Han, J. H., Kushner, S. A., Yiu, A. P., Hsiang, H. L. L., Buch, T., Waisman, A., ... & Josselyn, S. A. (2009). Selective erasure of a fear memory. Science, 323(5920), 1492-1496.
[7] Liu, X., Ramirez, S., Pang, P. T., Puryear, C. B., Govindarajan, A., Deisseroth, K., & Tonegawa, S. (2012). Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature. doi:10.1038/nature11028
[8] Ramirez, S., Liu, X., Lin, P. A., Suh, J., Pignatelli, M., Redondo, R. L., ... & Tonegawa, S. (2013). Creating a false memory in the hippocampus. Science, 341(6144), 387-391.
[9] Chen, J., Leong, Y. C., Honey, C. J., Yong, C. H., Norman, K. A., & Hasson, U. (2017). Shared memories reveal shared structure in neural activity across individuals. Nature neuroscience, 20(1), 115-125.
[10] https://www.nature.com/articles/d41586-018-00107-4#ref-CR1
[11] Josselyn, S. A., Köhler, S., & Frankland, P. W. (2017). Heroes of the engram. Journal of Neuroscience, 37(18), 4647-4657.
[12] Marco, A., Meharena, H. S., Dileep, V., Raju, R. M., Davila-Velderrain, J., Zhang, A. L., ... & Tsai, L. H. (2020). Mapping the epigenomic and transcriptomic interplay during memory formation and recall in the hippocampal engram ensemble. Nature Neuroscience, 23(12), 1606-1617.
[13] McCormick, D. A., & Thompson, R. F. (1984). Cerebellum: essential involvement in the classically conditioned eyelid response. Science, 223(4633), 296-299.
[14] Suzuki, A., Josselyn, S. A., Frankland, P. W., Masushige, S., Silva, A. J., & Kida, S. (2004). Memory reconsolidation and extinction have distinct temporal and biochemical signatures. Journal of Neuroscience, 24(20), 4787-4795.
[15] Josselyn, S. A., Köhler, S., & Frankland, P. W. (2015). Finding the engram. Nature Reviews Neuroscience, 16(9), 521–534. doi:10.1038/nrn4000
本文来自微信公众号:nextquestion (ID:gh_2414d982daee),作者:阿莫東森、山鸡,编辑:Jiahui、EY

