2020年7月,“70万一针罕见病药”话题冲上热搜。这款“天价药”,是SMA(脊髓性肌萎缩症)领域革命性产品诺西那生钠。舆论热潮背后,其研发厂商渤健(Biogen),也因此在中国被广为人知。
SMA是脊髓型肌萎缩症的简称,被称为“婴幼儿遗传病头号杀手”。SMA患儿出生不久,便逐渐丧失各种运动功能,包括呼吸和吞咽等功能。如果没有特效药,患儿大多活不过2岁。
诺西那生钠是全球首款针对SMA的精准靶向药物。全国登记在册的1600多名患儿需终生用药,第一年140万,以后平均每年花费105万。罕见病的民生问题,牵动着总理的心,他力推罕见病进医保,以降低民众负担。
2021年底的国家医保谈判上,诺西那生钠被成功纳入国家医保目录,每针3.3万元。时隔几个月,渤健再次被公众所关注,却充斥着“裁员”“出售股权”“药物被FDA裁决”等负面关键词。“领头羊”渤健何去何从,对中国罕见病创新药企业具有重要启示。
本文来自微信公众号:财健道 (ID:ArtofWealthandHealth),作者:张羽岐、吴妮,编辑:尹莉娜,制图:李紫雅,原文标题:《美国药企渤健:曾经一针卖70万,如今裁员止损》,题图来自视觉中国
2022年3月28日,渤健(BIIB.NASDAQ)公布治疗肌萎缩侧索硬化(ALS)的反义核酸药物BIIB078临床一期试验的一线结果,结果显示药物并无临床益处,渤健和Lonis决定终止其临床试验,及时止损。
在此之前的2016年,渤健也曾因脊髓性肌萎缩症(下称“SMA”)治疗药物迎来高光时刻。但新药研发是“九死一生”,渤健亦不能幸免,过去几年曾多次在临床阶段折戟。
据媒体报道,渤健发言人表示:“公司正在实施成本削减的措施,通过裁员,预计每年节省5亿美元”。
阿尔茨海默症研发失败率高达99.6%,可谓千帆折戟。21世纪以来,全球创新药企已有超320项临床研究宣告失败。作为神经医学领域的头部生物技术公司,渤健正在经历它的“生死场”,也许4月11日前能够尘埃落定,Aduhelm还有希望成为下一个诺西那生钠吗?
壮志难酬
将诺贝尔化学奖得主、诺贝尔医学奖得主以及乙肝疫苗的研发者凑在一起,他们能做什么? 创办渤健公司。
渤健(Biogen)诞生于1978年,专注于神经科学领域。它的创始人团队可谓是豪华阵容,1980年创始人之一Walter Gilbert博士获得诺贝尔化学奖;1993年另一位创始人Phillip Sharp博士诺贝尔生理学或医学奖;Kenneth Murray博士也因研发出乙肝疫苗而被封为爵士。
强大的创新基因,加上40多年的沉淀与发展,让渤健逐渐成为神经系统疾病领域的一哥,且在多发性硬化症(MS)领域和脊髓性肌萎缩症(SMA)领域独领风骚。
2013年,渤健研发的富马酸二(Tecfidera)获美国FDA批准,成为全球MS治疗领域使用最为广泛的口服药物之一。2019年,Tecfidera的销售额达到44.33亿美元的巅峰值。同年,富马酸二甲酯的升级版本富马酸地洛西美(Vumerity)成功接力,获FDA批准上市,凭借更好的胃肠道耐受性和安全性在市场上占有一席之地。
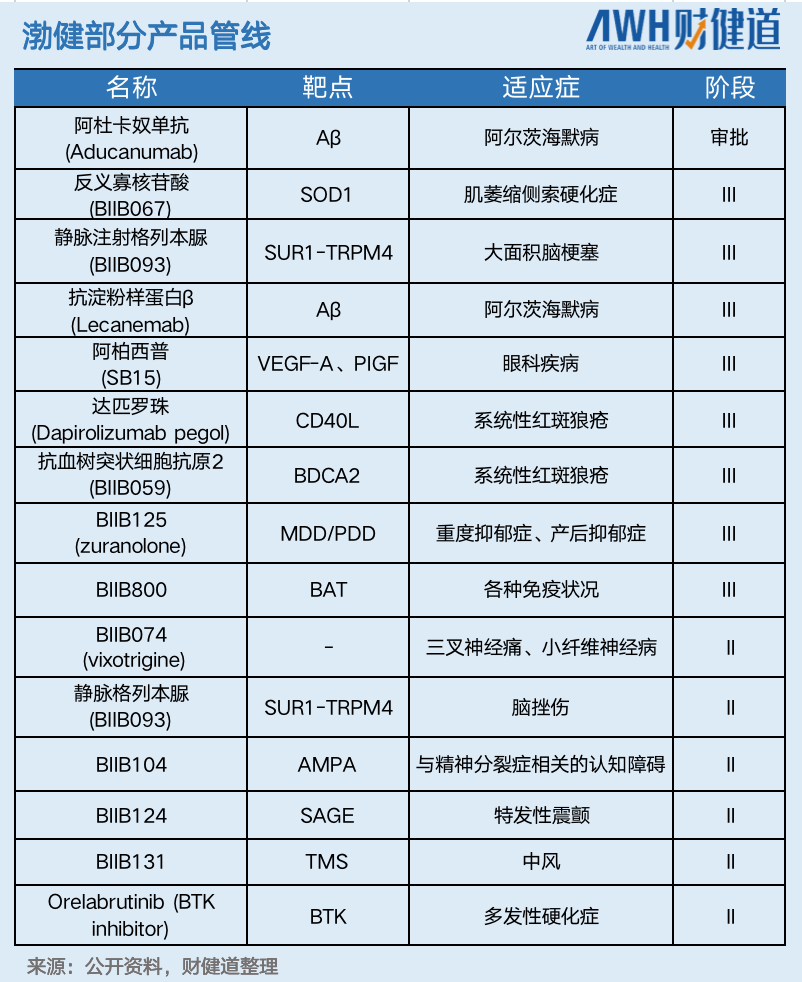
2016年渤健研发出全球第一款用于SMA的治疗药物——诺西那生钠(Spinraza),为罕见病领域带来了重大突破。凭借先发优势,截至2021年底,诺西那生钠已累计为渤健带来了近90亿美元的销售额。
诺西那生钠和富马酸二甲酯(富马酸地洛西美)成为两驾马车,拉着渤健越跑越快。
然而好景不长。2020年,巨大的隐患浮出水面。
首先是富马酸二甲酯的专利问题。渤健曾对富马酸二甲酯进行了一系列的专利布局,将市场垄断时间争取到2028年。
但这只是渤健的一厢情愿。2019年2月,迈兰向渤健发起了对富马酸二甲的专利挑战,并获得胜诉,提前结束了富马酸二甲市场独占期。
随后,仿制药蜂拥而至。国内经CFDA批临床的就有江苏豪森、济南百诺、杭州和泽等8家企业。在仿制药的冲击下,富马酸二甲酯2020年业绩为39.05亿美元,同比下跌12%;2021年这一数字降为23.62亿美元,再跌39.5%。
SMA领域也不甚乐观,虽然诺西那生钠的专利2023年才到期,但竞品早已逼近。诺华的Zolgensma和罗氏/基因泰克的Evrysdi分别于2019年和2020年上市,蚕食着诺西那生钠的市场。诺西那生钠的销售额从2020年的20亿美元降至2021年的19亿美元,而Zolgensma的2021年销售收入达到13.51亿美元,同比增长47%。
其次是研发上“青黄不接”。为了在SMA和MS领域保持优势,渤健从未停止创新。可惜,却未能如愿获得突破性进展。
2021年8月,多发性硬化症药物opicinumab研发止步于II期临床试验,因为该药在II期AFFINITY研究中未到达主要和次要终点。2022年1月,渤健从Ionis Pharmaceuticals引进一种治疗SMA的药物——BIIB115/ION306的全球独家许可,然而距离上市任重道远。
直到现在,无论是在SMA和MS领域,还是新业务领域,渤健都没有等来下一个增长点。

被寄予厚望的阿尔茨海默病药物Aduhelm安全性争议不断,据渤健2月3日公布的2021年财报,Aduhelm自6月上市以来销售额仅300万美元,远低于预期。
基因疗法BIIB111和BIIB112、非阿片类镇痛药物vixotrigine(BIIB074)、反义寡核苷酸药物tofersen、肌萎缩侧索硬化症(ALS)候选药物BIIB078先后宣告临床失败。
危机四伏
研发的连番失利,让以创新药为立身之本的渤健危机四伏。
最直观的感受是业绩下降明显。2020年渤健的营收在14家跨国药企中垫底,2021年渤健再刷新低,营收继续同比下滑18.3%。股价也创下历史新低,距离其2021年8月高点,下跌超过36%。

开源不成,渤健开始考虑节流。
2021年12月,已有100多名员工被解雇,包括三分之二的阿尔茨海默症药物Aduhelm商业化团队。另据媒体3月初报道,渤健可能继续裁掉多达1000名的员工,以期节省高达7.5亿美元的资金。
令人唏嘘的是,与本次裁员计划同步离开渤健的高管还有——渤健首席研发官AlfredSandrock,渤健负责全球制造的元老AlphonseGaldes。
今年2月,渤健以高达23亿美元的价格,将其在三星Bioepis公司的股权(49.9%的股份)出售给三星生物。收购完成后,两家公司将继续执行之前签署的独家协议,包括将目前的投资组合(依那西普、阿达木单抗、英夫利西单抗)商业化。此外,渤健还拥有雷珠单抗和在研阿柏西普生物类似药的独家商业化权利。
裁员与出售股权,或是没有办法的无奈之举,也开启了一个向下的螺旋周期。
一路走来,渤健的红与黑同样鲜明,皆由产品决定。神经性疾病药物历来被称为医药研发领域的“丧钟”,在阿尔茨海默症领域更是浪花滚滚,但收效甚微,超过99%的药物最后流落尘土,能够留下的是“精品中的精品”。可想而知,渤健走的这条路有多么的艰难。
去年10月,渤健坦然宣布肌萎缩侧索硬化症(ASL)的在研药物Tofersen的III期试验Valor研究进入“终点”,通俗解释就是这款药物最终可能研发失败。对于原研药物来说,这并不是什么新鲜事,失败是经验的积累,成功才是偶然的胜利。
渤健的Aduhelm(aducanumab,阿杜卡奴单抗)大抵如此。
据美国药品研究与制造商协会(PhRMA)的报告数据显示,从1998-2017年,全球有146款阿尔茨海默病药物进入临床试验“终点”,仅4款药物成功走向市场。也就是说,每37种药物中只有1种药物能获得“成功”。

然而研发的“成功”只是第一步,能否推向市场还需“过五关斩六将”。
2021年6月7日,FDA宣布,渤健阿尔茨海默病新药Aduhelm(aducanumab,阿杜卡奴单抗)获批使用。消息传出后,渤健股价大涨,毕竟AD的药物研发难度甚高,而Aduhelm是FDA近30年来审批的第七款AD药物,也是该领域药物时隔7年的再次获批。

尽管渤健的Aduhelm获得FDA的“认可”,但争议也接连不断,领域内专家会议席上的争吵,领域外各国市场的不认同……销售断崖,甚至于受到美国医疗保险和医疗补助服务中心(CMS)的限制。
FDA中各个专家小组在长达七小时的咨询会议中争论不休,“脑部的淀粉样蛋白与阿尔茨海默病的致病机制之间的关联具有不确定性”。神经学家和生物统计学家认为,渤健的实验数据不具备有效性和完整性。
一面,专家小组认为FDA有包庇渤健的嫌疑,甚至有3位FDA咨询委员会专家接连辞职,直指FDA。他们认为FDA虽然指出了生物统计学的数据漏洞,但在神经学审查中仍然批准了渤健的研发药物—Aduhelm。
另一面,阿尔茨海默病协会、美国神经病学学会、国际阿尔茨海默病协会等纷纷表示支持渤健的AD新药,最终FDA也批准了它。
行而不辍
正在经历裁员风波、营收断崖的渤健,看起来十分狼狈,但实际上,这却是新药研发的必经之路。相比于渤健,那些临床试验造假、“伪创新”的biotech企业才是产业沉浮中真正的“泡沫”。
行业人士指出,“药物临床试验中数据不规范、不完整的现象依旧严重”。早在2015年原国家食药监总局的“7·22核查风暴”中就探寻一些端倪。在1622个药物临床试验项目中,有超过八成的新药申请被药企撤回或是被原国家食药监总局“不予通过”。
就连跨国药企默沙东(MRK.NYSE)、百时美施贵宝(BMY.NYSE)也曾被FDA撤销适应症。
2021年7月2日,一纸文件映入眼前。国家药监局药品审评审批中心(CDE)下发《化学药品创新药上市申请前会议药学共性问题相关技术要求(征求意见稿)》和《以临床价值为导向的抗肿瘤药物临床研发指导原则(征求意见稿)》,特别针对肿瘤药物提出与最新治疗方案的头对头临床试验,并阐明产品商业化差异性。业内称之为“打击伪创新”,一时间,创新药研发的道路看起来正在缩窄。
尽管新药研发九死一生,有人夭折,有人幸运,但是不得不说,生物研发无论是现在或是将来都是一个烧钱的“事业”,就看谁能坚挺到最后。
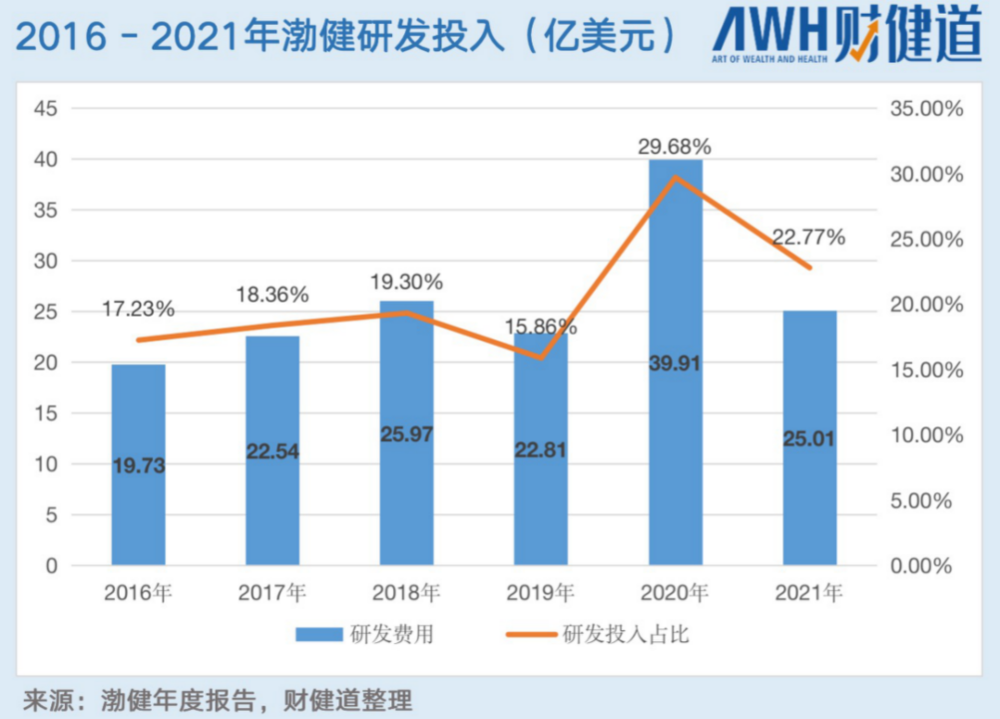
从2016年-2021年,渤健的研发投入稳步上升,2020年达到近几年峰值,研发费用达39.91亿美元,研发投入比占29.58%,但2021年受到疫情、AD新药研发等多重因素影响,研发投入有所下降,投入金额25.01亿美元,研发投入同比下降6.91%。
在这场旷日持久的“争议”中,尽管Aduhelm备受阻挠,渤健始终没有放弃。2021年12月中旬,渤健宣布与其开发合作伙伴卫材一起,开展临床IV试验,预计在研究开始后的四年内完成。做为IV期试验的一部分,渤健和卫材计划招募18%来自非裔美国人和拉丁裔人群的美国患者,渤健表示此举也是不断致力于增加Aduhelm临床试验多样性的一部分。
同时,渤健仍旧在神经科学的各个领域内探索。渤健用于治疗肌萎缩侧索硬化(ALS)的在研反义寡核苷酸药物BIIB078已经终止了临床试验。3月30日晚,FDA正在召开PCNSDAC会议,讨论另一款ALS的新药-Amylys的AMX0035,FDA仍然质疑它的有效性,至于结果如何,还在等待中。
对渤健来说,美国医疗保险和医疗补助服务中心(CMS)的“最后裁决”还未到来(时间为2022年4月11日前),Aduhelm能走到哪一步也不可知,渤健还能出来下一个SMA吗?或许它还在路上。
原国家食药监总局局长毕井泉说,创新药的高风险,应该对应高回报。
面对九死一生的高风险,放弃的人居多,但是临床、市场,需要更多的人加入,就需要高回报的机会。如果高风险而没有相应的回报,那么对于这种高失败率的生物医药产业,谁还愿意尽一份力呢?
参考资料:
【1】大规模裁员?首席研发官被踢!渤健阿尔茨海默药Aduhelm业绩惨败后何去何从.新浪医药. haon. 2021.12.09
【2】美国CMS限制渤健Aduhelm医疗保险覆盖范围.新浪医药新闻.李汤姆.2022.01.13【3】21大深度|狙击医药“伪创新”.21深度.2021.07.20
【4】八成新药临床数据涉假 背后监管环节层层失守.经济参考报.凌军辉、肖思思、张丽娜.2016.09.09
【5】在中国,122万人正在“中年痴呆”.财健道.张羽岐、汉雨棣.2021.09.23
【6】医保拒付,负面频现:药物经FDA批准上市后,还有多少道难关要过. 深蓝观. 方澍晨。2022.02.28
【7】BIOGEN REPORTS FOURTH QUARTER AND FULL YEAR 2021 RESULTS
【8】Biogen - 2020 Annual Report .2021. 04.09.【9】数据失真、PD-1扎堆,FDA反内卷,中国创新药企怎么办.财健道.严瑞.2022.01.05
【10】李勇(2022-01-17).药企巨头全力应对“专利悬崖”.医药经济报,F04.
【11】解一章.(2021).阿兹海默病新药研发漫途. 看世界(03),78-81.
【12】韩璐.(2019).阿尔茨海默病的战役. 21世纪商业评论(12),28-37.
【13】美版“971”|FDA力排众议,批准Biogen阿尔兹海默单抗Aducanumab.药融圈.2021.06.08
本文来自微信公众号:财健道 (ID:ArtofWealthandHealth),作者:张羽岐、吴妮,编辑:尹莉娜,制图:李紫雅

