注:除文中提到的前序研究,2018年,中国科学院动物研究所团队曾通过相关技术得到了世界上首只双父亲来源的小鼠,以及性状正常的双母亲小鼠;此次则是首个来自单个未受精卵的存活的哺乳动物后代。
本文来自微信公众号:生物世界(ID:ibioworld),作者:王聪,编辑:王多鱼,原文标题:《无需精子,上海交大魏延昌团队实现哺乳动物真正孤雌生殖》,头图非本次实验照片,来自:视觉中国
自然界中存在着多种生殖方式,例如许多较为原始的动物(例如一些蚜虫、蜜蜂、鱼类、爬行动物等等)可以进行孤雌生殖,卵在不经过受精的情况下也能发育为正常的个体,也就是不需要雄性个体参与,单独的雌性就可以实现繁殖。
但是对于高等的哺乳动物来说,只能进行有性生殖,需要雄性的精子和雌性的卵子结合,才能产生后代,而后代具有来自父母双亲的遗传物质。
然而,有些基因只有来自父亲的等位基因表达,有些则只有来自母亲的等位基因表达,也就是所谓的基因组印记,这种基因组印记是通过表观遗传学的甲基化实现的,基因组印记的存在,阻碍了孤雌生殖的实现。
2022年3月7日,上海交通大学医学院附属仁济医院生殖医学中心魏延昌等人在《美国国家科学院院刊》(PNAS)上发表了题为:Viable offspring derived from single unfertilized mammalian oocytes 的研究论文。
该研究利用基因编辑技术,对小鼠卵母细胞的7个甲基化印记控制区域进行DNA甲基化重写,成功创造了通过孤雌生殖诞生,且可存活至成年的小鼠。
这是首个来自单个未受精卵的存活的哺乳动物后代,这项研究为农业、科研和医学研究开辟了新的道路。

由于基因组印记的存在, 哺乳动物无法进行孤雌生殖。
早在2015年12月,中科院动物研究所胡宝洋研究员、周琪院士、李伟研究员合作,在 Cell Research 期刊发表论文【2】,通过对印记基因的修饰,成功得到了活的具有两个母系基因组的小鼠,这是实现哺乳动物孤雌生殖的重要一步。

为了实现哺乳动物的真正孤雌生殖,魏延昌等人从雌性小鼠体内取出未受精的卵母细胞,然后通过CRSIPR基因编技术进行修饰,模仿雄性和雌性生殖细胞在正常受精过程中贡献的基因组印记。
具体来说,研究团队使用CRISPR-dCas9通过Dnmt3a甲基化酶增加两个父系基因组印记控制区域H19和Gtl2的甲基化,并使用CRISPR-dCpf1通过Tet1去甲基化酶实现母系基因组印记控制区域Igf2r、Snrpn、Kcnq1ot1、Nespas和Peg10的去甲基化。
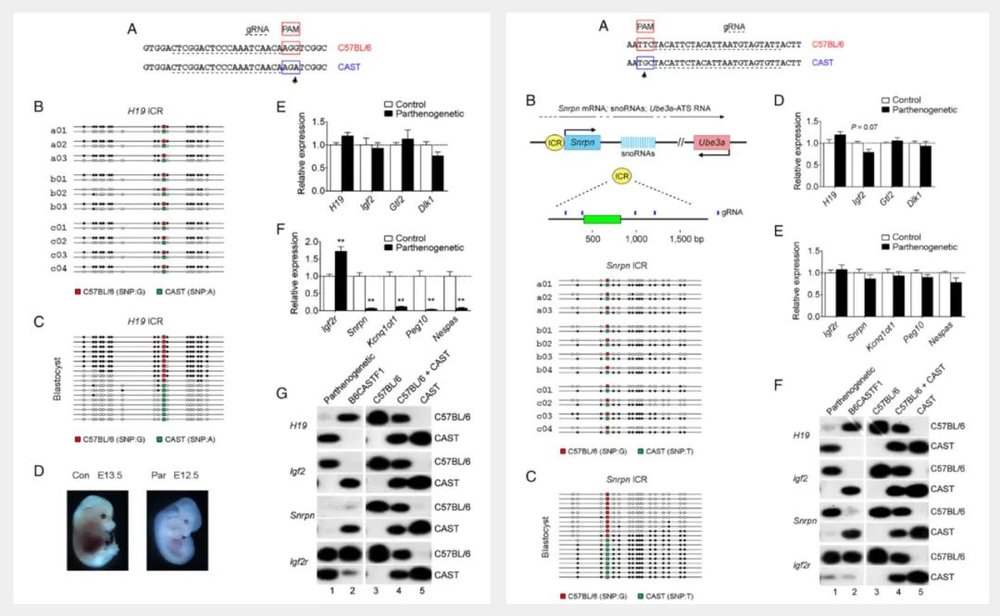
对这7个基因组印记控制区域的修饰,使得单一来源的未受精卵细胞具有类似于已受精卵细胞的基因组印记。
然后,研究团队将多个经过基因编辑修饰的卵母细胞植入到雌性小鼠子宫中,所有小鼠幼崽都在出生后幸存下来了并活过了幼年时期,其中有一只小鼠活到了成年,且可以正常生殖并产生后代。

研究团队认为,这项研究结果表明,可以通过对多个关键基因组印记控制区域的表观遗传重写来实现动物的孤雌生殖。这项研究也为农业、科研和医学研究开辟了新的道路。
论文链接
https://www.pnas.org/doi/full/10.1073/pnas.2115248119
https://www.nature.com/articles/cr2015151
本文来自微信公众号:生物世界 (ID:ibioworld),作者:王聪,编辑:王多鱼

