本文来自微信公众号:财健道(ID:ArtofWealthandHealth),作者:严瑞,编辑:杨中旭,原文标题:《数据失真、PD-1扎堆,FDA反内卷,中国创新药企怎么办?》,题图来自:视觉中国
2021年12月24日,平安夜。信达生物(HK.01801)宣布国家药品监督管理局(NMPA)正式受理信迪利单抗一新适应症联合用药的上市申请。这大概是信达长达10天以来,第一次松了口气。
此前,中国医药市场遭受重创,以致信达不得不发布公开声明,以平息负面情绪——12月15日,英国《金融时报》称美商务部将几家中国生物技术公司列入实体名单,挫伤医药板块股价;12月16日,FDA肿瘤学卓越中心(OCE)主任Richard Pazdur的几句话,再次重创A/H股创新药板块。
中国创新药国内“白菜价”、争取“出海”盈利,是近阶段最受推崇的发展逻辑。自1982年开放新药快速通道后,美国FDA成为创新药上市首要选项之一。不过,2014年以来,PD-1/PD-L1靶点的7种抗体,已经获取超过85种肿瘤适应症的审批,有评论称:“7种抗体的单抗/双抗,与各种联合治疗方案、各类肿瘤适应症之间不断‘排列组合’,已经脱离了创新的初衷——也许之后,药企自己的PD-1/PD-L1+xxx双抗,就会先‘卷’起来。”
对此,相关专业人士评论:“排列组合的说法当然有些片面,但(药企们)确实为了满足各类替代终点而上市,投入了巨量的资源。”
从2016年开始,Pazdur就对企业对新适应症“瓜分潮”表示不满。作为FDA肿瘤学卓越中心主任、血液学和肿瘤学产品办公室 (OHOP) 主任,直接负责领导开发、执行癌症药物及治疗性生物制剂的综合监管方法。
自2019年底,FDA开始出台更明确的临床试验指南、重新审核以替代终点加速审批的肿瘤治疗药物。以“替代终点”上市,却无法通过确证性审查的“空头支票”被撤市——因为医疗领域承受不了一场泡沫化严重的“次贷危机”。
Pazdur一讲话,市场震三震
12月16日,FDA肿瘤学卓越中心(OCE)主任Richard Pazdur接受Prevision Policy采访时的发言,给创新药的伤口“撒了把盐”:

“新药获批仅靠一个国家的临床数据,比如中国,显然是有问题的——这和美国在临床试验中努力增加患者多样性的原则背道而驰。”
Pazdur不仅是FDA创新药审批制度的“一把手”,还与中国创新药市场关系匪浅。
2018年,Pazdur曾“敦促”中国将合格的低价PD-1/PD-L1抑制剂引入美国市场。那年4月访问上海浦东张江高科技园区时,他在采访中表示:只要质量好,FDA一定会接受仅依靠中国产生临床数据产生的申请;虽然不会以价格作为标准,但欢迎价格低廉的产品。
在美国癌症研究协会(American Association for Cancer Research)一次名为“东方与西方相遇:中国制药探索西方市场”的会议上,Pazdur在问答环节讲话时也表示:“中国公司赴美竞争PD-1价格,可能对所有人都是件好事——目前为止,我们没有看到西方主要制药公司在价格上做出改变”。
“我可以看到一个非常简单的开发战略,”他说,“例如在肺癌方面,你可以简单地做一些大型制药公司已做过的研究。已经知道效应值(effect size),甚至都不必做非劣效研究就能上手,统计计划写起来也容易——你甚至都不需要成为一名统计学家。”
他还认为,中国对FDA已批准药物的模仿,也将顺利获批:“很明显,它们会产生非常相似的结果,所以我们在批准这类药物方面,几乎没有什么可说的。”
此前这些表述,与其接受Prevision采访的发言,似乎背道而驰。近日报道中Pazdur的观点有三:
1.不能只做单一国家单一人种临床;
2.“me-too”靶点泛滥,应开展国际化管理;
3.PD-1/PD-L1同质化竞争严重(针对国际头部创新药企)。
前两点,无疑会引发中国创新药市场巨震。因为中国肿瘤免疫治疗基本维持在“me-too”水平,且多项临床试验都依靠中国患者数据进行验证。此前,百济神州(688235)泽布替尼成功出海、近日CDE宣布拟将其纳入突破性疗法,无疑又助长了这一逻辑。
作为主要依靠中国临床数据进行申请的种子选手之一,信达的信迪利单抗首当其冲。在随后发布的会议纪要中,信达详细解释了亚组患者入组率问题:尽管中国患者的入组比例在四种药物中最高,但仍在临床指南合理范围内,与FDA要求临床试验多中心的规则不冲突;同时,晚期患者的入组率在四种药物中排名第二高,也更符合真实世界情况。
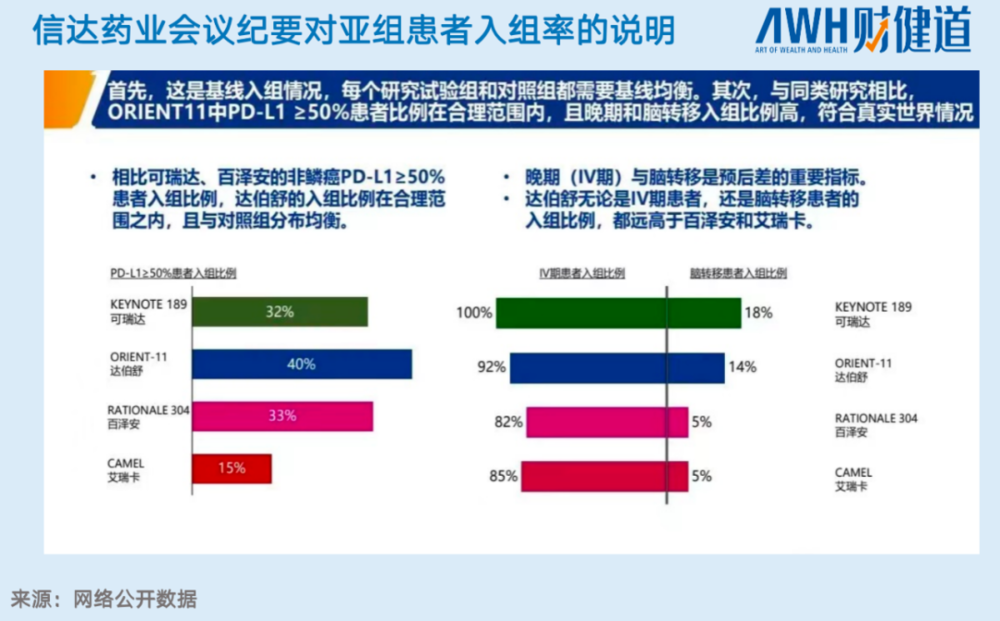
不过,针对这一药物是否称得上“the best”的争论没有停止。有医学相关人士表示:信迪利没有在各替代终点风险指标上超过默沙东K药(Keynote189)。
因为普遍缺乏头对头试验,所以肿瘤药物临床试验,多对患者入组后总生存期(OS)、肿瘤得到控制的无进展生存期(PFS)等数据建立分析模型,来预测治疗方案的有效性。
模型所得出的风险比(HR)数据越小,代表患者从中获益可能性就越大。比如,PFS试验HR=0.76,就代表患者入组无进展期死亡率下降24%。普遍来说,患者PD-L1表达越高,免疫治疗效果就越好。在临床试验中,低表达率比如PD-L1<1%的患者的临床HR数据,便可以作为“the best”的证据之一。

会议纪要中,信达生物使用的K药非鳞癌PD-L1<1%PFS HR数据为0.68,信迪利(即达伯舒)的这项数据为0.598,显示信迪利获益率更佳。

接着,在OS HR数据方面,信迪利单抗似乎也排名第一,为0.60,好于默沙东K药的0.608。然而,美国临床肿瘤学会(ASCO)年会2020年5月公布的K药数据中,其OS HR为0.51,远超信达生物会议纪要中取用的数据。仅就这一数据,信迪利就很难论证所谓的“best”。
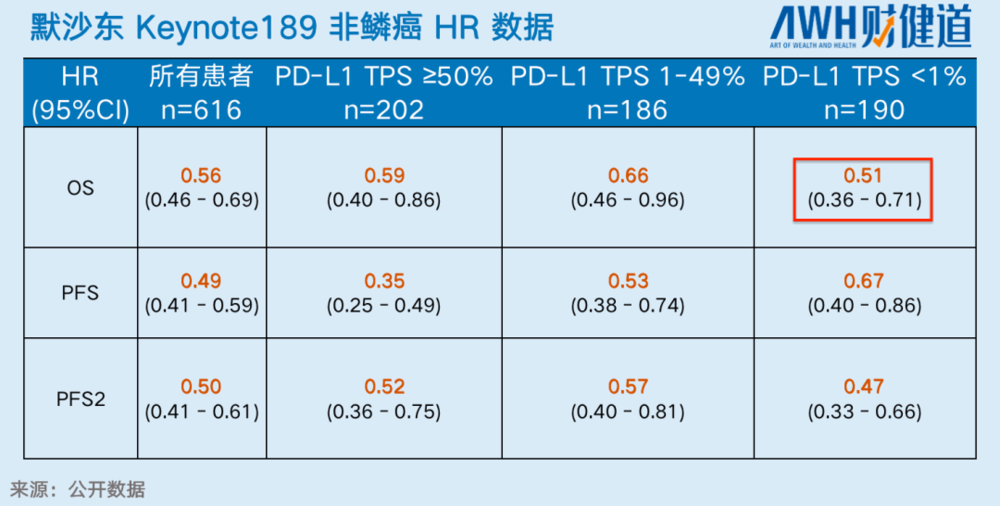
中国创新药出海逻辑,于是陷入一场争论不休的“罗生门”。
FDA只针对中国药企吗?
当然不是针对中国。FDA针对的是任何钻临床试验替代终点的空子、“以次充好”以谋取利益的企业。若“以次充好”的泡沫泛滥,医疗领域绝难承受一场“次贷危机”式的灾难。
而药企们之所以敢于自称“me-better”或“the best”,和FDA审批制度有关。上世纪80年代开始,FDA开始使用替代终点和加速审批,来帮助肿瘤治疗药物上市,打开了各种风险分析路径的可能性。
尽管普遍来说,PD-L1表达率越高的患者,使用免疫治疗的有效性应当越大。但免疫起效机制并不仅由一项表达率标准就能确定,表达率90%但免疫治疗无效的案例、表达率1%但单药治疗疗效就不错的案例都不少。据业内相关人士介绍,某种程度上,PD-L1表达率并完全是临床判断的科学标准,还是药企借以上市所使用的预测模型维度之一。
替代终点不可能真的替代临床终点,就好像当年的信贷危机,泡沫永远不能代替真正的收益。比如说,肿瘤缩小当然可以作为替代终点,支持药品上市,但它是否能提高病人的总生存率,仍需确证性实验来验证。好比狼人杀里有“金水”“银水”之别,何况“金水”也并非永远正确。
因此,作为以“可能性”上市的药物,只要达到一定水平,在没有真实数据和确证性试验,各药总能找出一款分析模型来自证有效。
既然效果不确定,那为什么还要支持药物加速审批上市呢?因为肿瘤治疗药物研发太难了。若以临床试验终点的“金标准”、即患者的总生存率为唯一标准,那么,肿瘤治疗药物通过审批就会极为困难。
上世纪末FDA就认识到,在严重或罕见疾病方面,药少、试验少、审批少很可能造成恶性循环。因此,让患者尽可能有药可用,成为创新药使用替代终点、加速审批上市的起点。
加速和替代,配合肿瘤治疗药物的巨大市场,必然带来药物扎堆现象。于是,Pazdur自2016年也就是第一款PD-1/PD-L1药物上市两年开始,就开始对以美国为首的肿瘤创新药企表达不满。
那时Pazdur所谓PD-1/PD-L1同质化竞争,直指头部药企比如默沙东、罗氏、百时美施贵宝等,在单一靶点免疫治疗耗费了太多资源。2019年以前,他不仅没有针对中国药企,反倒在“敦促”中国药企仿制创新药来平衡创新药市场价格。
然而,Pazdur理想中的低廉价格、创新导向并未实现。中国创新药企不仅没有降价,还都指望着药物能“出海”捞回国内医保谈判里被打下去的利润。
2021年12月15日,也即接受Prevision采访前一天,他和同事Julia Beaver在《新英格兰医学》杂志上发表《检查点抑制剂开发的狂野西部》一文,继续表达了这种失望情绪。

“过去7年中,FDA已经批准7种针对PD-1/PD-L1通路的抗体,及这类药物超过85种的适应症。”[1]文章开篇剑指的7年前,即是2014年默沙东K药、百时美施贵宝O药获批的那个时间点。
截至2021年8月,据相关媒体统计。出去这已经获批的适应症,在ClinicalTrials.gov官网搜索“PD-1”,仍有2903项开展中的相关临床试验,以及1343项仍在招募中的临床试验。
几千个研究中,新适应症或突破性疗法很少,大部分都是7种已有抗体成分药物的联合治疗方案,可以理解为已有抗体药物与不同适应症的“排列组合”。
Pazdur认为,这大大降低了癌症免疫治疗研究投入的边际效应。一来,没有研究来对比不同疗法的可及性与经济性;二来,尽管这种药物的设计、治疗方案确定已然“流水化”,但新“排列组合”方案的研发、审批支出仍居高不下。相当于做着“仿制药”的工作,却投入“原研药”所需的资源、挣着“原研药”的钱。
在2016年第52届美国临床肿瘤学会(ASCO)年会上,Pazdur就表示,“人们应该问一下他们自己……我们是不是应该更好地使用那些资源,用来开发更多创新药物?”。
基于此,才有“东方与西方相遇”大会上,Pazdur的发言。他直接表示,非常欢迎中国公司“仿制”PD-1/PD-L1打破美国“狂野西部”同质化竞争、不愿降价的僵局。
然而,同质化竞争并非某一个国家的特殊缺陷。“狂野西部”文章中所抨击的现象——比如赞助商一拥而上,基于非随机、单臂试验制定批准策略、招募医疗需求未得到满足的患者以获得加速批准等等——在世界范围内(当然包括中国),都已经并也许仍将频繁出现。
至此,就算完全抛开对药物研究的数据分析不谈,我们也能明白Pazdur几句反同质化、注重临床数据有效性的话,为何能动摇市场对中国创新药企的信心:
对于中国创新药市场来说,“me-too”仍是大多数企业的天花板,大多数竞争者都是已知“内卷”进入白热化阶段、却还不撤退的人。他们明白,想在“次贷危机”中牟利,当然要迎接一场豪赌。
FDA审批收紧,确证性审查“秋后算账”
也许,前几年确实是PD-1/PD-L1的红利期,但快速审批机制从来不是为投机者准备的捷径。
2012年2月,当时的FDA局长Echenbach在《华尔街日报》刊登《FDA的药品审批应基于安全性,有效性应留给上市后研究》一文,主张改革药品监管,从而达到鼓励创新、降低药价、造福患者的目的。这意味着,当时的FDA对肿瘤治疗药物市场,持鼓励、观望态度。
毕竟,想要创新,就要一定程度上允许“泡沫”的存在,好比邓小平“开窗通风、苍蝇也会进来”的比喻。所以,Pazdur2016年开始对创新药的批评,完全不被药企高管们认同。
浸淫创新研发工作动辄几十年的药企们,深知创新之难,它不仅需要资源的堆砌,更需要机运的青睐。他们中的大多数人认为,已有靶点下不同抗体药物之间的联合治疗、即“排列组合”,才是真实世界的癌症免疫治疗趋势。从2014年至今,现实映证了他们的说法。
前文中针对PD-1/PD-L1的7种抗体药物,能够取得超过85项适应症审批,依靠的是替代终点和加速审批。这是所谓红利期的来源——自1982年以来,快速审批通道大多为肿瘤治疗药物“占领”;反之,肿瘤治疗药物也鲜少不在快速审批行列内。
但是,FDA 在2018年《美国医学会杂志》肿瘤学分册发表的一项研究中公布,对93 个获得加速批准的药物,仅有55%上市后证实了其获益;获得加速批准的适应症,仅有40%完成了确证性临床试验。
2019 年发表在《美国医学会杂志·内科学》的一项研究[3]发现,FDA 通过使用替代终点加速审批的癌症药中,只有20%在确证性试验中提高了总生存率。该研究的作者在2017年的一项研究中还说明道[4],通过快速审评批准的药物,使药品标签上的安全性警示变更率增加38%。
一段时间的试验后,FDA开始以监管的“有形之手”,去修整肿瘤免疫药物市场的“无形之手”。2019年12月开始,FDA开始出台针对性指南方案,开展对替代终点上市的肿瘤治疗药进行数据复核,以“慢撒气”的方式,缓慢展开“秋后算账”攻势。而宏观也好,产业也罢,慢撒气,不急转弯,是监管水准高低的标志。
2019年12月20日,FDA发布名为《证明人用药物和生物制品具有有效性的实质证据》(DemonstratingSubstantial Evidence of Effectiveness for Human Drug and Biological Products)的行业指南。
2020年11月,FDA高级官员在预防政策/癌症研究之友生物制药大会上证实,将对加速审批药物开展审查。
2021年1月25日, FDA 药品审评与研究中心(CDER)发布药品方面的指南制定计划,其中《满足基于一个充分且良好对照的临床研究以及确证性证据的实质性证据标准》指南,脱胎于2019年12月指南草案 IV.B 小节的标题。
3个月后,FDA正式宣布,在4月27日至29日举行肿瘤药专家咨询委员会(ODAC)会议,讨论三个癌症免疫疗法PD-1/PD-L1药物获得加速批准的 6个未确证临床获益的适应症的未来。《联邦公报》通告表示,此次会议是由肿瘤卓越中心(OCE)要求召开的,是其“对整个行业范围肿瘤产品方面确证性试验未证实临床获益的加速审批的评估”的一部分。
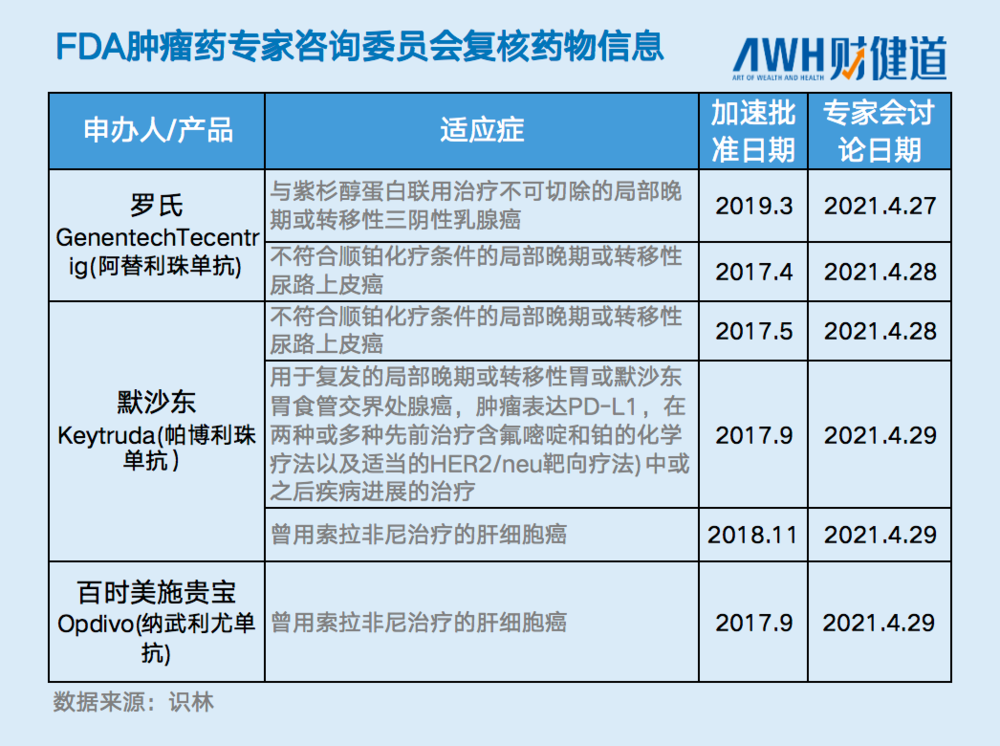
面临审查和撤销风险的药品包括Genentech阿替利珠单抗的两个适应症,默沙东的帕博利珠单抗的三个适应症,以及百时美施贵宝的纳武利尤单抗的一个适应症。
此前,3月早些时候,百时美施贵宝、阿斯利康、默沙东和罗氏四家公司其实已经与FDA达成协议、宣布撤销了另外四个新适应症的加速审批,撤销原因是确证性试验不符合上市后要求(PMR)。
6月18日,FDA 发布首份患者体验数据在监管决策中使用的评价报告。作为 2016 年《21 世纪医药法案》的一部分,第 3004 节要求FDA 需要在 2021 年、2026 年和 2031 年分别发布患者数据评价报告。
报告指出,患者体验数据应该成为患者报告结局(PRO)和临床结局评价(COA)的核心作用。这代表着,根据替代终点加速审批上市的肿瘤治疗药物们,将被要求进行上市后的确证性实验,并随时面临撤市风险。
2021年12月8日,FDA发布了《使用真实世界数据和真实世界证据支持药品和生物制品监管决策的考量因素》指南草案。当然,都是为了在药品上市后能继续观察、研究,且最重要也最关键地——进行监管。
“秋后算账”,但有分寸
中国药企能否真的如Pazdur所说,以大量低价打入美国市场?只要免疫治疗还处在技术前沿,就很难。
FDA“有形的手”再收紧,也不能干预市场价格,尤其是对创新药市场。从K药、O药上市至今,肿瘤免疫治疗药物价格之昂贵,未有变动。
FDA心脏病、血液、内分泌和肾脏病学办公室主任Ellis Unger认为,假设一个药具有临床获益的可能性为 70%,那么该路径中获批的药物中有30% 就应该退出市场。但想要求药物撤市,实际上很难,因为FDA无法主导市场决策。
某种程度上,确证性审查大会、撤市和新指南的出台,都是FDA应对市场“内卷”问题作出的专业性努力。围绕专业性做文章,基本是其能做出的最大努力。
对FDA来说,只有在保证专业性的情况下,新药才可申请加速批准。从1982年开始设立新药加速审批途径至今,FDA药物审评时间从20世纪80年代审评时间接近3年,下降到现在的1年左右,效果显著。不过,创新药研发从临床试验到正式批准上市的总平均时间,并无显著变化,也就是说开发难度不降反增。[5]
越快速的审批通道,对药物临床数据的要求也越高。比如突破性疗法认证(即BTD),要求药物在一开始临床试验阶段就证明,药物能在一个或多个有临床意义的指标上,较现有疗法有显著改善。如果一个药物申请突破性药物失败,FDA不会将取消其快速通道认定程序,研发单位需要重新申请。
迄今为止,百时美施贵宝的Opdivo获得10项BTD认证,默沙东的Keytruda则获得9项BTD认证,领跑群雄。但FDA对上述药物的确证性审查并未“仁慈”。上文审查大会中审核的6个适应症中,有2个已经被撤销。
所以,尽管工商业界对FDA的监管有不同看法,但对其专业能力却一致认同。许多FDA审查员是硕士或博士学位,拥有“医生、律师、分析师、科学家”等多重身份,或在大学或科研机构兼任教授。
默克公司的一位负责人曾表示:“我们虽然不一定认同FDA的决定,但我们一定尊重FDA的决定。”
当然,就算没有确证性审查趋严,药企名正言顺的“排列组合”戏法,也已经要玩到极限了。
以信达生物此次颇受争议的信迪利单抗为例,其申请的是信迪利单抗联合培美曲塞和铂类用于非鳞状非小细胞肺癌(NSCLC)的一线治疗。
这个适应症简直是大中之大——首先,肺癌是全球死亡率最高的恶性肿瘤,发病率也是世界第二;其次,非小细胞肺癌患者大约占全部肺癌患者的80%至85%;最后,美国2021年全年超250亿美元的PD-1销售额中,约有60%来自非小细胞肺癌适应症,且主要是在一线治疗。
以再生元为例。其Libtayo同样申请了在非小细胞癌症一线治疗为例,它们需要对抗的是默沙东、百时美施贵宝和罗氏。据业内人士转载,华尔街著名分析机构SVB Leerink分析师预测,Libtayo即使获批非小细胞肺癌一线,其在所有PD-1/PD-L1市场中的份额永远不会超过5%。
饱和状态下,市场自有其生态模式。越广谱、越早上市的药品(如默沙东K药)占商业保险支付比例越大,与保险支付方的关系也更紧密。广谱免疫治疗药物往往能提供更高比例的回扣,形成“回扣墙”,在产业链中下游均形成某种程度上的垄断。
尽管包括恒瑞在内一众中国创新药企都选择从大适应症入手,但这也许并非好事。想要与占尽先机的广谱免疫治疗药物竞争,除开价格壁垒不谈,在临床头对头试验中证明“me-better”甚至“the best”其实相当困难。
而冷门适应症没有成熟案例可复制,做起来可能更难。这种情况下,除了追求“the best”,“me-too”甚至“me-worse”看不到未来,所谓的价格战便无从谈起。
“中国目前大多处于中度创新的创新药企,还是要拥抱国内市场。”一位医药板块分析师表示,盲目“出海”的下场只能是“赔本赚吆喝”。可中国的药物评审和审批制度也趋于严格。
2021年7月2日,国家药监局药品审评审批中心(CDE)下发《化学药品创新药上市申请前会议药学共性问题相关技术要求(征求意见稿)》和《以临床价值为导向的抗肿瘤药物临床研发指导原则(征求意见稿)》,特别针对肿瘤药物提出与最新治疗方案的头对头临床试验,并阐明产品商业化差异性。
如此看来,中国创新药企好像进退两难起来。但这个“难”,本就是创新的奥义。
中国创新药“me-too”困境,是冰冻三尺、非一日之寒——企业不改把创新扭曲成看似容易的仿制热,因为“次贷危机”的泡沫终会破灭。原国家食品药品监督管理总局局长毕井泉告诉《财健道》:“需要把评审中心(CDE)做大做强,鼓励真正的创新。”
这需要长期耐心的大量投入,其中包含制度、资金和社会理念等多方面涵养。持续多年,才有可能找到一棵真正创新的萌芽。
(作者系《财经》研究员)
参考资料:
[1]Beaver JA, Howie LJ, Pelosof L, et al. A 25-Year Experience of US Food and Drug Administration Accelerated Approval of Malignant Hematology and Oncology Drugs and Biologics: A Review. JAMA Oncol. 2018;4(6):849–856. doi:10.1001/jamaoncol.2017.5618
[2]Julia A. Beaver,M.D.,and Rechard Pazdur,M.D.:The Wild West of Checkpoint Inhibitor Development. (https://www.nejm.org/doi/full/10.1056/NEJMp2116863)
[3]Gyawali B, Hey SP, Kesselheim AS. Assessment of the Clinical Benefit of Cancer Drugs Receiving Accelerated Approval. JAMA Intern Med. 2019;179(7):906–913. doi:10.1001/jamainternmed.2019.0462
[4]Mostaghim S R, Gagne J J, Kesselheim A S. Safety related label changes for new drugs after approval in the US through expedited regulatory pathways: retrospective cohort study BMJ 2017; 358 :j3837 doi:10.1136/bmj.j3837
[5]柏林,范平安,史录文,陈敬.从美国1985—2019年新药批准情况看新药研发和审批趋势[J].中国新药杂志,2021,30(20):1830-1835.
本文来自微信公众号:财健道(ID:ArtofWealthandHealth),作者:严瑞,编辑:杨中旭

