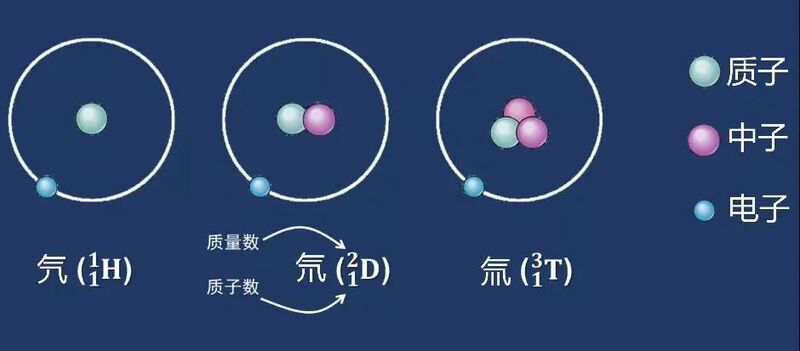
自然界中绝大多数氢都是以氕的形式存在,相对丰度达到99.9844%,而氘的丰度相对较低,约0.0156%,至于氚,由于丰度低于0.001%,一般记为痕量。 最近日本福岛的核废水事件中,氚的含量就是重点讨论的问题。 氚具有放射性,发生β衰变,半衰期为12.43年,衰变产物氦-3太轻会逃逸到宇宙中。氚在自然界中含量极少,一般认为是宇宙辐射与上层大气中的氢相互作用产生,总量大概只有7.3千克,而自核技术诞生以来,人类制造出的氚已经超过了自然存量的5倍。

日本福岛百万吨的核废水
氕氘氚三兄弟虽然在原子组成上有所不同,但是它们的化学性质差距却微乎其微,三者与氧反应都能生成水,称为H2O、D2O(Deuterium oxide)和T2O(Tritium oxide),D2O和T2O俗称重水和超重水。
也正因为三者的很多性质都一样,氚也是核废水中最难分离去除的物质。含有氚的超重水有什么危害自然不必过多解释,放射性三个字已经概括了很多。 不过,没有放射性的重水要比超重水有意思得多。

由于重水密度比水大10%,重水冰块能在水中沉底
重水几乎是伴随着氘的发现而被人所知的,1931年美国科学家哈罗德·克莱顿·尤里(Harold Clayton Urey)发现了氢的同位素氘,之后他也因此获得了1934年的诺贝尔化学奖。 1933年,尤里的导师吉尔伯特·牛顿·路易斯(Gilbert Newton Lewis)通过电解水的方式制得了0.5毫升重水,纯度为65.7%。

哈罗德·克莱顿·尤里
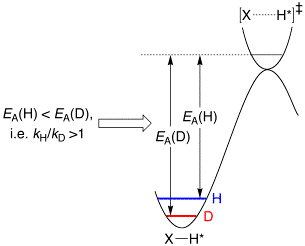
早年间制取重水的方法就是简单粗暴的电解水,从现象上来看,电解水时阴极产生的氢气中所含轻同位素的比例更高一些,留在电解池内的水中氘的含量就变高了。 电解法制重水的原理涉及动力学同位素效应,同位素之间虽然化学性质极为相近,但在反应速率上有差异,平衡常数也不同。 反应速率的变化与核量子效应有关,简单来说是由于较重的同质异形体拥有更低的震动频率,在大多数情况下需要更多的能量才能使化学键断裂。
不过,天然水中的氘并不一定都以D2O的形式存在,更大概率是以HDO(半重水)的形式存在。在电解法制重水的过程中,当HDO分子达到一定比例后,水分子间还会发生交换氢离子的现象,D2O的比例变得更高。 当电解制取重水的方法出现后,很快就被应用到实际中。就在路易斯制得高纯度重水的次年,1934年,挪威建起了Venmork水力发电厂,利用丰富的水力资源来电解水制氢,用于生产硝酸盐化肥。

挪威Venmork水力发电厂
商机就藏在其中,生产化肥需要的是电解水产生的氢气,而留在电解池里的不就是重水吗?虽然实际的情况没有那么简单粗暴,但方向是正确的。 果不其然,制氢厂对电解的残留物进行分析,发现当中氘与氢(氕)的比例为1:48,远远高于天然的1:6400,虽然大多数是以HDO半重水的形式存在,但也极具价值。 于是挪威水电公司接受了制氢厂负责人提出的建议,从电解液的副产物中制取重水,虽然过程需要大量联级电解室和消耗大量电力,但这并不妨碍挪威水电公司成为最早向科学界供应重水的厂商。

挪威产安瓿装重水
然而,重水的故事才刚刚开始。德国人在1938年末发现了中子轰击铀能引发核裂变,苏联人在1939年末得出结论,重水和石墨是铀反应堆的仅有的可行缓和剂,反应堆需要大约15吨重水。 重水因为能够使链式核反应产生的中子减速而成为了战略级的物质,各国都极其重视。1940年到二战期间,挪威的重水工厂一直处于纳粹德国的控制之下,并大量采购几乎所有的重水。 为了阻止纳粹的核研究,盟军发动了一系列针对重水工厂的突袭破坏行动,为世界做出了一定的贡献,当然从马后炮的角度来看,当时挪威重水工厂即便马力全开也很难产出足够反应堆运行的重水。

盟军穿越山地高原摧毁纳粹控制下的重水工厂
总之,重水刚刚出现在人们的视野中就与核反应关联上了,以至于很多人对它的第一印象就是极度危险,实际上并非如此。 那个年代科学家的好奇心的是无穷的,早在氘被发现后不久就已经有人把重水喝下了肚。 乔治·赫维西(GeorgeCharles de Hevesy)和氘的发现者尤里是好朋友,1934年赫维西找尤里搞来了几升重水,当然纯度不是特别高,只有0.6%。 赫维西把这些重水喝掉了,目的是将氘作为示踪剂来研究人体对水的代谢,最终得出结论,水分子在人体内平均停留时间为13±1.5天。

咋?不信吗?
这不是传说,赫维西是示踪剂研究的先驱,因为这方面的研究获得了1943年的诺贝尔化学奖,后来在纳粹占领丹麦时,他用王水把诺奖金牌溶了,大家感兴趣的话可以单独讲讲老哥的故事。 总之,大家一直都对喝重水这件事非常好奇,首先是它是的毒性。 可以明确的一点是,现在我们通过合法途径购买到的高纯度重水(氧化氘),在容器的标签上大概率会写有安全性警告,或者是仅用于实验等提醒,这里不建议任何人尝试饮用重水。

首先,对于大多数天然同位素而言,它们的差异太小,以至于几乎无法产生生物学效应。氢算是比较特殊的,氘虽然之比氕多了一个中子,但原子量已经翻倍,更何况水是地球生物非常重要的溶剂,一些细微的化学性质差异就可能会对生物体产生影响。 目前已知的一些影响,包括对昼夜节律周期变长,现象可以在单细胞生物、绿色植物、昆虫、鸟类、小鼠等生物中观察到。 更重要的是对生物体内重要化学反应的影响,由于重水的氢键更强,很多依靠氢键的生化反应会被影响。植物在高浓度重水的环境下会死亡,动物如小鼠、大鼠和狗,在体内D2O达到25%以上会不育,鱼类在90%以上的重水中会迅速死亡。

哺乳动物被投喂重水后约一周后会死亡,此时它们体内的水有50%左右已经被替换为D2O,原因为氘抑制细胞分裂。 听起来喝重水还是一件挺可怕的事,不过除了那些为了研究而被饲养的动物外,人类几乎不可能会接触到如此大量的重水。 而且,氘作为天然的氢同位素,人体中也含有一定量的氘,以50千克体重算,一个人体内约含有32千克的水,其中约有1.1克的氘,换算过来相当于5.5克的纯重水。

而一般认为人体内的水要有一般有25%~50%被替换为D2O才有可能产生毒性,显然这种情况几乎不可能出现,也不用脑洞大开构思一个“重水杀人案”,以今天重水与纯银相当的价格来看,不说了,你们自己算。 尽管理论上不建议任何人饮用重水,实际上还是有无数人或公开或非公开地喝过重水,原因说起来很离奇,因为大家都好奇重水究竟是不是甜的。 虽然早期,比如氘的发现者尤里本人,以及挪威克劳斯 汉森教授在尝试重水后得出了不太统一的答案,前者认为重水和普通水无异,后者认为重水有点辣嘴。

这些有可能是当时制备重水技术不成熟,纯度不足以及含有杂质等因素造成的。但到了今天,我们可以在购买到纯度达到99.98%的重水,有很多偷尝禁水的人都表示“有点甜”。 说起来非常奇怪,水怎么会有甜味呢?根据YouTube Thunderf00t频道的实验,他设计了简单的盲测实验,被试者将会品尝不同的水,每次仅有三滴。 为了排除可能因分子量带来的差异,他还花重金搞来了重氧水,即氢与氧-18生成的水,分子量为20,与重水相当。 结果几乎所有被试者都能在三种水(普通水、重水、重氧水)中区分出重水,只靠三滴并且非常迅速,可以说比较明显。

Thunderf00t的频道主是Phil Mason,他也是下文研究中的作者之一,主要贡献是提供蒸馏提纯的高纯度重水,你可以在文末参考中找到他的名字
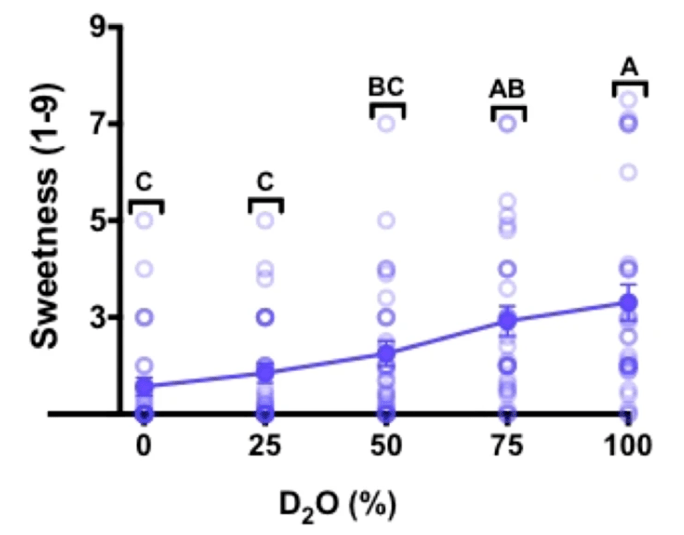
在另一项由娜塔莉·本·阿布主导的实验中,28名参与者在开鼻式味觉测试中有22名准确区分出了重水,根据他们的主观反馈,纯重水的甜味显著,但比较轻微,平均甜度为3.3±0.4(1无感,3轻微,5中等,7非常,9齁甜)。
为了进一步研究重水产生甜味的原因,他们团队还做了小鼠实验,但是实验的结果有些出人意料。已知小鼠对蔗糖水有较强的偏好,但却对重水没有偏好,其他的长期喂养实验甚至观察到小鼠表现出对重水的厌恶。
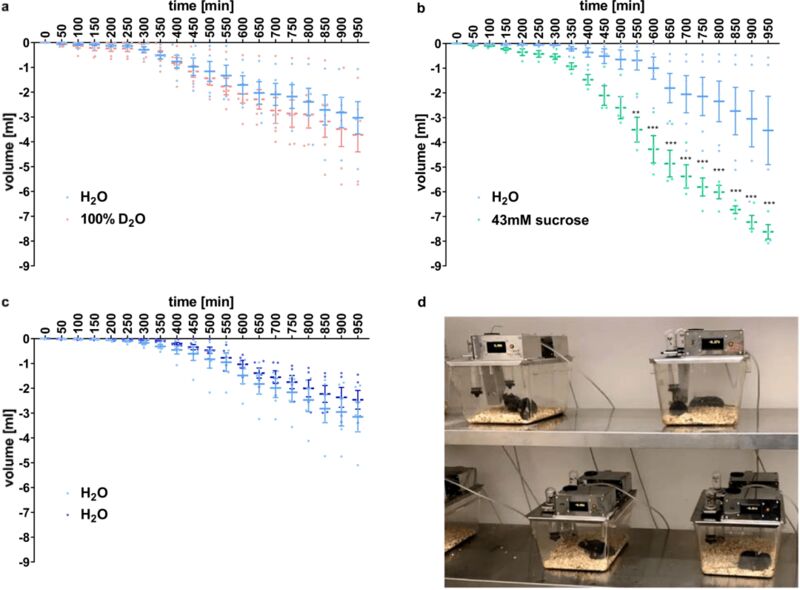
也就是说,小鼠可能尝不出重水的甜味,但也可能通过其他特征分辨出重水,一种猜测是喝下重水后小鼠的身体出现了不适,毕竟它们体型小,重水带来的影响更为显著。 不过,这也给研究带来了方向,重水产生甜味的原因来自于人类特有而啮齿类没有的甜味受体,后确定为TAS1R2 / TAS1R3受体。
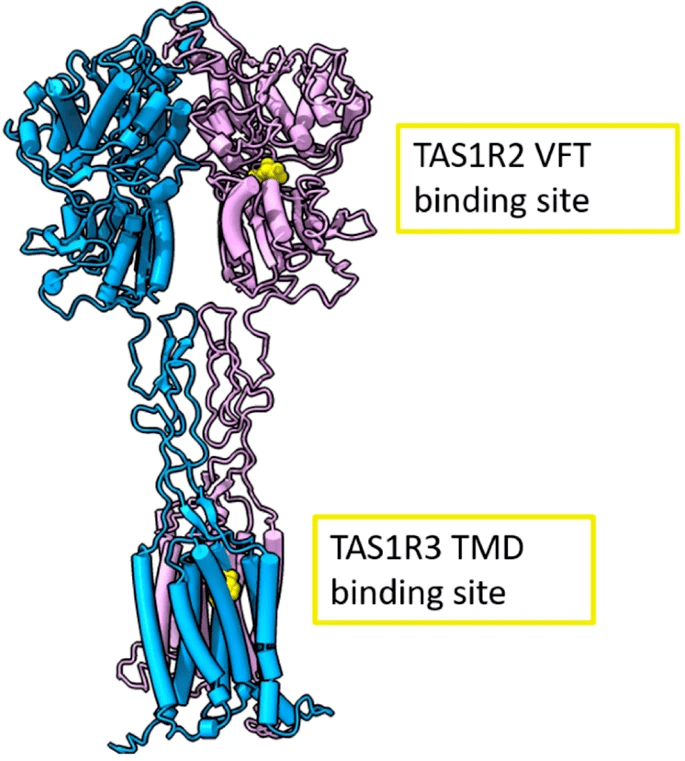
进一步的实验通过作用于TAS1R2/ TAS1R3受体的甜味抑制剂也证明了重水甜味的来源。不过实验仍没有找到确切的点位和作用机理,但可以确定是由于核量子效应,D2O的氢键更强,因此蛋白质在D2O中刚性和致密性也更强,这或许是我们感受到甜味的原因。 正所谓“遇事不决,量子力学“,其实真正的含义是让你举棋不定的时候喝一口水冷静冷静,用你的TAS1R2 / TAS1R3受体感受那3200分之一的回甘。
最后,恭喜你看完本文,收获了一条无用知识:当你面前的两杯水中有一杯是重水,辨别它们的最快方法就是——喝一口(误)。

