
文/一节生姜 特邀撰稿人
核心提要
1、与中国附条件批准的两款灭活疫苗不同,美国目前批准的是mRNA疫苗。虽然拥有P3实验室是生产灭活疫苗的必要条件,但由于美国目前未生产灭活疫苗而推断其没有P3实验室,在逻辑上行不通。2、国药和科兴的新冠灭活疫苗是由Vero细胞培养的,该细胞已经使用了四十多年并且已用于生产脊髓灰质炎和狂犬病毒疫苗。不可否认的是,Vero细胞有一定安全风险,监管部门对培养过程进行了严格的规范,只要按照规定进行生产,就是安全的。3、有专业人士因一次动物实验中SARS疫苗产生了ADE(抗体依赖性病症加剧)效应,并且因SARS病毒与新冠病毒同源,而怀疑疫苗药效,但动物实验结果与目前的临床数据表明中国的新冠疫苗不会产生ADE效应。4、因为各个试验中对症状的规定不一样,很难通过数字就准确地比较出不同疫苗的差距,mRNA疫苗到底比灭活疫苗好多少还没有明确的答案。5、美国的大公司预测新冠病毒会像SARS一样消失而没有抓住机会研发灭活疫苗,而中国在一开始就提出了包括传统与新兴技术在内的五条技术路线,并积极参与国际合作,因此才能研发成功。目前全世界已经接种了2亿剂新冠疫苗,但是如果比较美国和中国目前批准的疫苗,有一个巨大的反差:中国目前附条件批准的两款疫苗,都是灭活疫苗,而美国目前紧急批准的,是两款mRNA疫苗。不仅如此,美国未来一个月内可能获得批准的疫苗中,也只有重组蛋白疫苗和腺病毒载体疫苗。美国为什么不做灭活疫苗?不仅如此,法国有着著名的巴斯德研究所,法国微生物学家路易·巴斯德最先发明了狂犬病疫苗和炭疽病疫苗,法国曾经占有传染病预防领域的顶级席位,但是为什么法国也没有搞出灭活疫苗?
这个问题让很多人疑惑不解,就像不明白为什么欧美人不愿意戴口罩一样。欧美为什么不做灭活疫苗,中国却做出来了?真的是因为生产灭活疫苗的Vero细胞不安全?还是因为这是一个落后技术?真相究竟是什么?本文在此梳理一下网上流传的几个错误说法与认识。


缪误一:“美国没有P3实验室,所以造不出灭活疫苗”!网上曾经有个视频,一位国内顶尖的防疫学家,说美国做不出灭活疫苗的原因,是没有P3实验室。
因为视频可能不完整,如果被掐头去尾了,即便是一个名人的言论,很可能就被曲解了。但是,如果说美国是因为没有P3实验室,才做不出灭活疫苗,那显然是很荒谬的。P3实验室,指的的是生物安全级别为3级的实验室。对于微生物病原体,只要是吸入后能引起严重且可能致命疾病的,研究都需要在P3实验室里进行,这是国际上通行的惯例。说美国没有P3实验室,就等于是说美国没有任何这些致病微生物的研究!有人毫不犹豫地选择相信美国的实验室造出了新冠病毒,但又同时相信美国人没有可以进行这些研究的实验室,这在逻辑上是自相矛盾的。2007年,在美国疾病控制与预防中心(CDC)和美国农业部动植物健康检验局(APHIS-USDA)注册的P3实验室,就有1356个[1]。美国不仅有P3实验室,还有级别更高的P4实验室,目前正常运转的P4实验室有4个,而中国目前在内地仅有武汉病毒所一个P4实验室。做灭活疫苗,需要先将病毒培养放大,所以P3实验室是必要条件。但是必要条件并不是充分条件,不是说只要有P3实验室就能做出灭活疫苗。同样,也不能因为美国没有做出灭活疫苗,就反过来推断出美国没有P3实验室!这是一个逻辑上常犯的错误,但很多人意识不到。

图/位于马里兰州的德特里克堡美国陆军传染病医学研究所。美国拥有全世界最多的P3实验室。

缪误二:用来生产灭活疫苗的Vero细胞不安全?!这个细胞用于生产脊髓灰质炎和狂犬病毒疫苗,不安全为什么可以用40年?
并不是所有的灭活疫苗都需要Vero细胞来生产,但是国药和科兴的新冠灭活疫苗,确实是用Vero细胞来生产的,在疫苗的包装盒上,两款疫苗都在疫苗的名字后特别注明了。

Vero细胞是非洲绿猴的肾细胞,为什么需要用到这样一个细胞呢?前面说了,要做灭活疫苗,先要将病毒养起来。怎么养起来呢?总不能说吹口仙气,病毒就繁殖起来了!病毒需要感染宿主的细胞之后,才能繁殖扩增,所以就需要用细胞来培养。以前使用原代细胞培养病毒,但是因为原料有限,而且均一性也不好控制,所以就逐渐改为使用可以连续培养的细胞。Vero细胞就是这样一个可以连续培养的细胞,已经使用了四十多年,用于生产脊髓灰质炎和狂犬病毒疫苗 [2]。所以,如果说Vero细胞不安全,那是错误的!如果不安全,怎么会已经批准用于生产疫苗呢?当然,Vero细胞确实有安全风险,这是不可否认的,也正是因为如此,监管部门才对细胞的筛选技术、细胞传代的代数进行了严格的规范。但是,只要按照规定进行生产,就可以认为是安全的。这也应该是可以理解的,正如大米是安全的食物,但是监管部门也会对大米中的重金属含量进行规范,不能说因为有的大米出现了重金属污染,就认为大米是不安全的;也不能因为大米已经吃了几千年,就不对其安全性进行监管。当然,监管大米的力度,肯定与监管药物和疫苗的力度不一样!监管越严厉,疫苗研发的成本就会越高,不可能靠大风吹来一个又好又便宜的疫苗。研发的成本是一个绕不过去的问题,也是研发疫苗的企业在立项时不得不面对的一个问题。

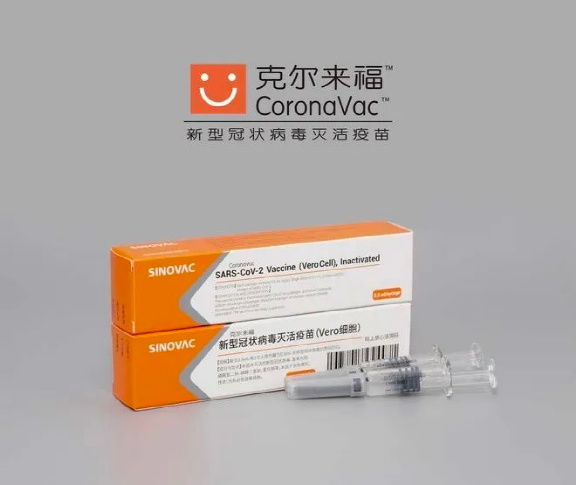
图/科兴与国药疫苗均为灭活疫苗。均标注Vero细胞生产。

缪误三:灭活疫苗会有ADE?中国灭活疫苗的动物试验结果,从数据上并没有看到灭活疫苗有ADE效应!!
什么是ADE呢?这个词是缩写,源自英文Antibody-dependent enhancement, 中文可以翻译成“抗体依赖性病症加剧”。ADE是一个来自登革热的发现,登革热病毒有好几种,有人在感染一种登革热病毒之后,症状比较轻微,很快也就好了,但是在几个月或者几年后,又感染了另一种登革热病毒,结果出现了更严重的病情。目前的研究认为,这是因为第一次感染之后产生了抗体,在第二次感染的时候,之前的抗体帮了倒忙,导致病情更严重。为什么会担心新冠疫苗有ADE问题呢?2003年的“非典”之后,中国医学科学院实验动物研究所和艾伦·戴蒙德艾滋病研究中心合作,在2005年做了一个SARS疫苗,技术路线是使用减毒的痘病毒作为载体,以表达SARS病毒的S蛋白,作为诱导产生抗体的抗原。据香港大学陈志伟教授介绍,在进行恒河猴免疫保护性实验后发现,该疫苗确实能诱导产生中和抗体,可以控制病毒,但对猴子肺部进行病理检查却发现,之前注射过疫苗的猴子,在感染SARS病毒之后,肺部病理损伤会更严重 [3]。疫苗诱导产生抗体,相当于第一次感染所产生的抗体;注射过疫苗的猴子感染病毒,相当于第二次感染了病毒,所以出现的更严重的肺部病理损伤,就认为是ADE所导致。正是因为有这样一个动物试验,而SARS病毒与新冠病毒又同源,感染机制也一样,所以去年有很多专业人士对新冠疫苗的前途比较担心,就怕也会导致ADE。但是,中国新冠灭活疫苗早就发表过动物试验的结果,从数据上并没有看到灭活疫苗有ADE效应[4]。同时,如果灭活疫苗有ADE,那么通过其他方式获得疫苗,因为都会诱导产生抗体,也会导致ADE,不会说因为担心ADE,就选择mRNA疫苗而不是灭活疫苗。不仅动物实验结果表明新冠疫苗没有ADE的问题,目前的临床数据已经更加充分地解除了这个担心!如果疫苗有ADE问题,那接种疫苗后的新冠肺炎的重症率会更高。但是从3期临床试验以及实际接种后的结果来看,不管是mRNA疫苗还是灭活疫苗,都大大降低了重症率。都已经2021年了,现在再用ADE的问题来讨论新冠疫苗,纯粹是炒冷饭。


缪误四:欧美不做灭活疫苗,是因为灭活疫苗效果不好?!真相并不象人们想的那样。网上的这个说法,似乎在临床试验结果出来后得到印证,因为辉瑞/德国BioNTech 和Moderna 公司的两种mRNA疫苗,保护率都达到了94%~95%,而国药和科兴的灭活疫苗,公布的保护率分别为79.34%和50.65%。
从数字上看,mRNA疫苗保护率确实高,但是因为各个试验中对症状的规定不一样,很难通过数字就准确地比较出不同疫苗的差距。比如科兴的疫苗,根据其向国家药监局提供的数据,50.65%是对新冠肺炎所有症状的保护效力,但对于需要就医的症状,保护效力为83.70%,对住院、重症及死亡病例的保护效力,则为100.00%。
在不同地方进行的临床试验,对于轻症的定义差别比较大,比如在Moderna 疫苗的临床试验中,即便受试者出现了发烧、发冷、肌肉疼痛、头痛、咽喉肿痛、味觉或嗅觉改变等症状,需要至少出现两个,才会进行核酸检测,确定是否为感染者。
所以,即便是现在有临床试验结果了,虽然mRNA疫苗的保护率数字看着高很多,但是到底比灭活疫苗好多少?还没有明确的答案。在没有临床试验之前,更不可能有答案。从机制上来说,mRNA疫苗可能确实比较强,因为它不但能诱发产生中和抗体,还能诱发细胞免疫。但是,理论只是理论,是需要数据来证实的。比如腺病毒载体疫苗也可以诱发细胞免疫,但如果仅从保护率数字上看,牛津大学腺病毒载体疫苗的保护率也没有mRNA疫苗好,与灭活疫苗也没有明显的差距。从各国批准疫苗的指导方针看,也都只是要求50%保护率,并没有对mRNA疫苗制定一个更高的标准,这也表明之前专业人士对mRNA疫苗的效果如何,其实也是没底的。


美国、欧州为什么没有灭活疫苗?原因竟是因为许多大公司错失先机网上流传的上述原因都不是导致美国没有研发灭活疫苗的原因,那原因到底是什么呢?美国的小公司是不会投入资金做灭活疫苗的,因为灭活疫苗是比较成熟的技术,甚至很难有专利保护,小公司不可能有什么技术优势。美国的大公司都有这些技术,但却又不做,什么原因呢?是因为一开始犹豫不决!
在中国出现疫情之后,很多人预测病毒会像SARS一样消失!
因为疫苗的研发周期比较长,如果砸钱进去做,很有可能等疫苗做出来了,病毒也就消失了,那砸出去的钱就打水漂了。
这是有先例的!2003年时,科兴就做了非典疫苗,但是在完成1期临床试验之后,非典早已消失了,连后续的临床试验都无法继续,别说是做成产品盈利了。
所以,等到2020年3月时,美国已经出现了比较严重的疫情,感到病毒不太可能自动消失,必须要靠新冠疫苗时,中国的腺病毒载体疫苗、美国的mRNA疫苗都已经进入了临床试验阶段,灭活疫苗在美国已经失去了先机。
做mRNA疫苗的德国BioNTech,美国Moderna,都是小公司。不像大公司“船大难掉头”,小公司立项相对比较灵活,没有那么多约束,如果不靠创新,更没有生存的机会,所以更愿意选择新技术去冒险。采用腺病毒载体、重组技术路线的,也几乎都是小公司或者像牛津大学这样的研究机构。
还有一个重要的原因,不管是mRNA疫苗、腺病毒载体疫苗、还是重组蛋白疫苗,都不需要获得病毒,只需要有病毒的基因序列就可以开展。在2020年1月10日,中国的科学家就已经将新冠病毒的基因序列与全世界分享了,所有使用这些疫苗新技术的公司,可以马上开展正式的研究工作,等于是赢在起跑线上,不需要等真正拿到一个可以感染细胞的病毒。所以,在去年3月之后,美国打算进行新冠疫苗项目的大公司,都选择与已经赢在起跑线上的新技术合作,比如辉瑞与德国的BioNTech合作推进mRNA疫苗,阿斯利康与英国牛津大学合作推进腺病毒载体疫苗,强生虽然是独自做的疫苗项目,但用的也是腺病毒载体,默沙东(Merck)选择与一个使用麻疹病毒载体的公司合作(后因效果不好宣布终止临床试验)。天下武功,唯快不破!对于入局者来说,最重要的就是能够第一时间做出疫苗产品,如果别人都已经赢在起跑线上了,自己再捡起灭活疫苗来做,那前途是不会被看好的。

关键的问题是:中国为什么做出了灭活疫苗?美国没有做成的事,为什么中国做成了?很显然,不是因为只有中国有灭活疫苗的技术,也不是因为只有中国有P3实验室,而是中国一开始就没有犹豫,直接就上了灭活疫苗的项目。为了尽快成功地研发出新冠疫苗,国务院联防联控机制科研攻关组在一开始就提出了5条技术路线,除了灭活疫苗,还有重组蛋白疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗、以及核酸疫苗(包括mRNA疫苗和DNA疫苗)。准备了这么多的技术路线,是因为没人能知道到底哪条路能走通,即便是灭活疫苗这样的“常规”疫苗技术,也不能保证就肯定可以研发出有效的疫苗。在这些技术路线中,腺病毒载体疫苗(陈薇团队)和灭活疫苗首先进入了临床试验,但是由于中国国内的疫情被迅速控制了,这本来是一个好消息,对于疫苗的研究来说,却是一个坏消息。如果当时所有国家都能像中国一样“严防死守”,那没有一款疫苗能够做成功。

整体上来说,新冠疫苗能在1年内就能完成初步的3期试验,得到紧急批准、附条件批准,这跟各国政府的支持是分不开的。但是,因为只能到国外进行3期临床试验,无论是灭活疫苗还是陈薇院士的腺病毒载体疫苗,都没能按前期的速度推进。国药和科兴灭活疫苗,都属于最早进入3期临床试验的疫苗,科兴因为选择的是疫情比较严重的巴西,所以在去年12月拿到了结果,而国药在阿联酋开展的试验,因为规模比较大,也拿到了数据。目前这两款疫苗的3期临床数据都还没有正式发表,在国内也是“附条件”批准使用。说到疫苗,一些人观点比较狭隘,认为就是国与国之间的竞争,但实际是有竞争,更有合作。如果中国没有分享关于病毒基因的信息,美国、德国的mRNA疫苗,俄罗斯的腺病毒载体疫苗,至少要被延迟几个月;如果无法在其他国家开展临床,中国的灭活疫苗目前也无法获得3期临床试验结果。在中国的5条技术路线中,也包括复星医药通过与德国BioNTech合作获得的mRNA疫苗(即目前的辉瑞疫苗)。现在虽然已经有好几款疫苗获得批准使用,但是要让全球达到群体免疫,疫苗产能远远无法满足需要。只有在全球都消除了疫情,人类才会安宁,从这个角度看,其实合作更重要。从疫苗的研发也可以看出,面对着新冠肺炎这样一个大规模传染的疾病,政府的格局非常重要,必须要有统筹安排,既要鼓励新兴的技术,也不能放弃传统的、似乎是不时髦的技术,更不可能抄别的国家、国际疫苗企业的作业。
参考文献:
1. Richards, S.L., V.C. Pompei, and A. Anderson, BSL-3 laboratory practices in the United States: comparison of select agent and non-select agent facilities. Biosecurity and bioterrorism : biodefense strategy, practice, and science, 2014. 12(1): p. 1-7.2. Barrett, P.N., et al., Vero cell platform in vaccine production: moving towards cell culture-based viral vaccines. Expert Review of Vaccines, 2009. 8(5): p. 607-618.3. Liu, L., et al., Anti-spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection. JCI Insight, 2019. 4(4).4. Gao, Q., et al., Rapid development of an inactivated vaccine for SARS-CoV-2. bioRxiv, 2020: p. 2020.04.17.046375.

