一
干细胞来源的自体再生胰岛移植为何可以治愈25年糖尿病病史患者?它的原理是什么?
上海一名接受过肾移植、有25年2型糖尿病病史的59岁的男性,于2021年7月19日,在上海长征医院接受了自体再生胰岛移植治疗。目前,这名患者已彻底脱离胰岛素长达33个月。
这是国际上首次利用干细胞来源的自体再生胰岛移植,成功治愈胰岛功能严重受损糖尿病的病例报道。这项研究日前在线发表在Nature旗下的Cell Discovery《细胞发现》上。
中国是糖尿病第一大国,患者多达1.4亿,其中约4000万需终身依赖胰岛素注射治疗。
这一疗法的出现,是否意味着糖尿病可以治愈?糖尿病患者都可以利用干细胞来源的自体再生胰岛移植吗?凤凰网CC情报局特约专家庄时利和对此进行了解读。
在解读这项研究之前,先简单介绍一下胰岛的一些基本知识。
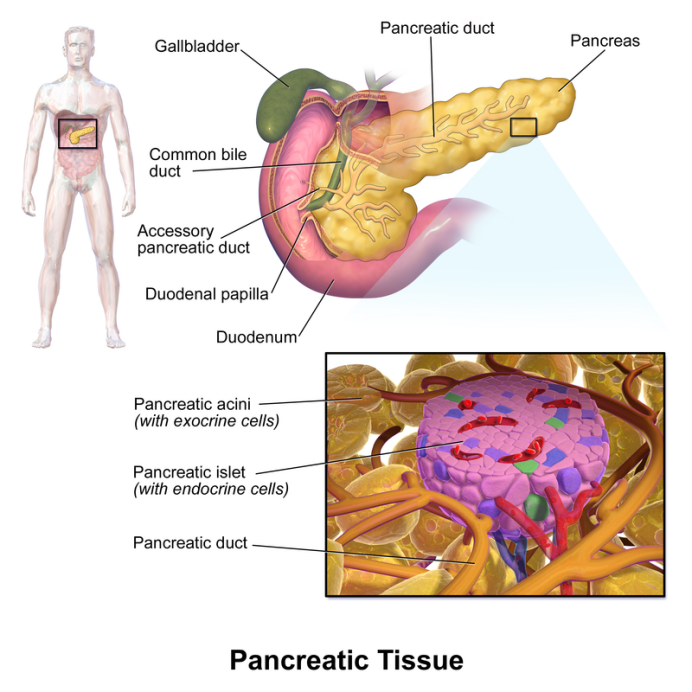
我们先要区分一下胰脏、胰腺和胰岛这三者的关系。胰脏又被称为胰腺,是一个长条形的器官,位于胃部的后下方,兼有内外分泌的功能,胰腺分泌的消化酶在食物消化过程当中起到重要的作用。
而胰岛实际上是胰腺内散在的一些细胞簇,每个细胞簇大概有三四千个细胞,仅占整个胰腺1%~2%的体积。这些细胞簇星罗棋布,有点像大海中的岛屿,因此得名胰岛(pancreatic islets)。而胰岛中还含有四种不同的细胞,其中胰岛β细胞分泌的是胰岛素,这是人体中唯一一种降血糖的激素。
注意,人体内能升血糖的激素有很多种,但是能降血糖的只有这一种。
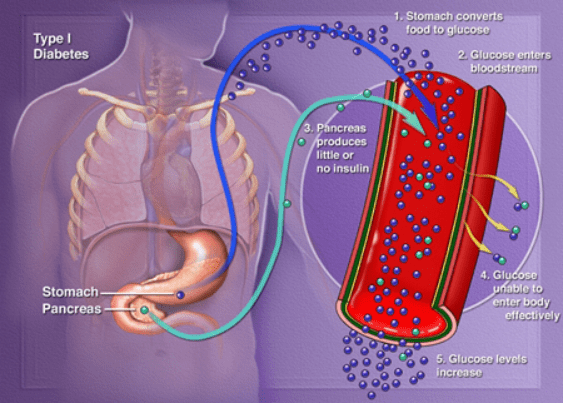
说到胰岛素,大家自然会联想到它和糖尿病的关系。糖尿病分两种类型,简单来说。1型是胰岛素分泌的绝对不足,2型主要是胰岛素抵抗,后者占了所有糖尿病病例的90%以上。
但是,随着2型糖尿病的发展,胰岛功能也会逐渐丧失,有超过30%的2型糖尿病患者最终需要外源胰岛素治疗。
以上这些知识并不复杂,但是它们决定了糖尿病发展和治疗的基本策略。
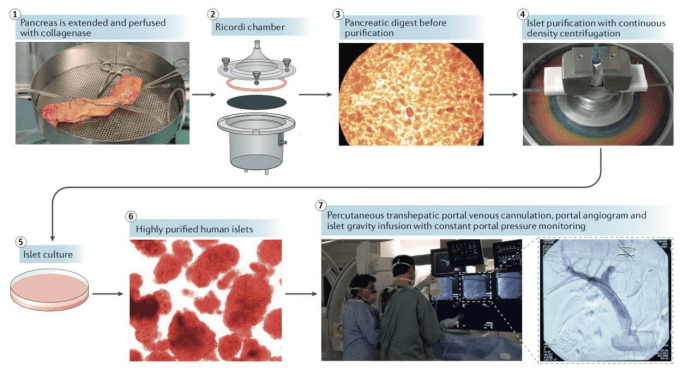
这项研究通过干细胞分化出胰岛组织从而治疗糖尿病,是过去二十年糖尿病治疗领域的一个热门方向,因为它可以有效解决胰岛移植供体不足的问题。
这项研究中的患者是一名59岁的男性,患有2型糖尿病25年,由于糖尿病的微血管并发症,他的肾脏也逐渐衰竭,最终在2017年6月进行了肾移植。

但是从2019年11月开始,他的血糖变得难以控制,波动很大,时高时低,血糖的变化水平介于3.66~14.60 mmol/L,而血糖过高或过低对健康都是有很大危害的。
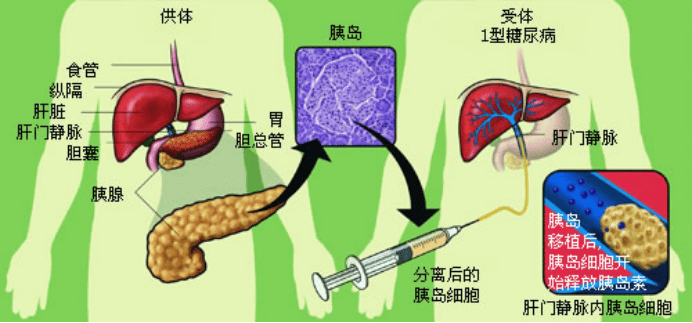
由于担心低血糖以及血糖控制不好导致的移植肾脏无法长期存活,这名患者同意进行E-胰岛(E-islet)移植。
首先解释一下什么是“E-胰岛移植”,全称是自体EnSC分化的胰岛组织移植。EnSC是非致瘤性人内胚层干细胞(non-tumorigenic human endoderm stem cells)的意思。
大家可能听过另外一个词,叫做人类多能干细胞(hPSC)。在动物实验中,由人类多能干细胞产生的胰腺祖细胞或胰岛组织已被证明能在糖尿病动物中存活、起效并逆转高血糖。
但是,hPSC的风险在于分化方向复杂,并且残留的未分化细胞在体内可能有形成畸胎瘤的风险,因此后来的研究重点是通过其他类型的干细胞,比如上面提到的EnSC,这些细胞可能更适合作为胰岛细胞的大规模生产来源。
研究人员采用的移植方式是经皮肝门静脉移植,医生将120万个E-胰岛移植进他的体内,并在手术之后通过混合膳食耐受性试验(MMTT),监测他的内分泌功能以及糖尿病相关指标。
在这名59岁的糖尿病患者移植后长达116周(2年3个月)的随访期间,影像检查(上腹部MRI)和血液肿瘤标记物均未检测到肿瘤形成(这是研究人员重点监测、也是最为担心的不良反应),这名患者出现的主要不良反应有:
移植后4~8周内出现暂时性腹胀和食欲不振;
可恢复的体重减轻(<5%,从80公斤下降至76公斤)。
最重要的是,移植后血糖控制的效果非常明显。
在术后第二周,患者的血糖波动幅度就明显缩小了,血糖控制水平也从56.7%提升至77.8%,严重高血糖和严重低血糖事件完全消失(直至随访结束),糖化血红蛋白A1c水平从最初的6.6%下降至第85周的5.5%,以及第113周的4.6%。
患者术后的平均空腹时C肽水平(反映胰岛功能的指标)比手术前提高了3倍,C肽和胰岛素的分泌水平都有明显的提升。
另外,患者在手术之后对外源胰岛素的需求量逐步减少,到第11周时完全停止注射胰岛素;口服降糖药从第44周开始也逐渐减少,并在第48周(阿卡波糖)和第56周(二甲双胍)时实现了停药。
这项研究表明,在移植后两年多的时间内,患者的血糖得到了非常有效的控制,这证明非致瘤性人内胚层干细胞来源的胰岛组织,有望恢复严重2型糖尿病患者的胰岛功能,并且没有严重的不良反应。
上海长征医院器官移植中心主任殷浩教授,这项研究由他的团队联合中国科学院分子细胞科学卓越创新中心程新教授团队共同进行。联合团队首席科学家程新于2012年在世界上首次建立了内胚层干细胞及其改良类型内胚层干细胞。还成功建立了GMP条件下的规模化定向分化体系,可实现规模化生产。
在此基础上,该团队历经十余年潜心研究,利用患者血液外周血单个核细胞(PBMC)重编程为自体诱导性多能干细胞(iPSC)细胞,并使用国际首创技术使之转变为“种子细胞”即内胚层干细胞,最终实现在体外再造胰岛组织。
二
干细胞来源的胰岛移植,仍面临存活率低与“致癌突变”等问题的困扰。
成功治愈一名有25年病史的糖尿病人,这无疑是一个振奋人心的消息。
单个胰岛β细胞就可以感知细胞外的葡萄糖变化并分泌胰岛素,因此这类移植不需要像心脏/肾脏等整个器官的移植那样,需要非常复杂的手术流程,只要含有β细胞的胰岛被移植到有利于与血流充分交换的部位,就有望实现功能性治愈。
不过,上海长征医院器官移植科学术带头人丁国善对此表示:“从初步的研究结果看,这项研究成果对以后糖尿病的治疗,尤其是重症糖尿病的救治,是一个有相当大影响的发现,科研意义和临床潜在的应用价值相当巨大。但现在研究成果还是初步的,需要积累更多病例以及更深入的临床试验,持之以恒推进研究,开展更进一步的分析,才能够真正让广大长期依赖胰岛素注射的糖尿病患者拥有新的治愈疗法,目前还有很长的路要走”。
目前这类干细胞来源的胰岛移植,仍面临一些重大的问题:
首先是存活率问题。由于胰岛素产生和分泌的高代谢需求,β细胞特别容易受到压力影响,在胰岛移植的早期研究当中,有超过50%的胰岛组织在移植之后死亡,其中重要原因是移植手术的应激反应(缺氧、营养缺乏和炎症相关等)。
再有一个就是干细胞制品的长期安全性问题。我们上面有提到hPSC的畸胎瘤风险,这也是所有干细胞分化所面临的风险,细胞分化的方向仍然不是完全可以人为控制的,而不安全遗传突变(特别是致癌突变)的积累可能会给这类干细胞移植带来重大安全风险(包括干细胞分化的胰岛移植)。
在2015年,日本有一项使用诱导多能干细胞(iPSC)治疗黄斑变性的临床试验,就因遗传变异而暂停。
而最受关注的风险,还是来自移植后的排斥反应。
实际上,在2021年,哈佛大学干细胞研究所也完成了一例糖尿病的临床试验,实现了全球首例使用干细胞疗法治愈1型糖尿病。
据胰岛移植资料,分析1990~1999年间进行的237例人体胰岛移植,第一型糖尿病病人术后一年不需注射胰岛素治疗者仅有11%。近年来胰岛移植的成绩已有大幅进步,如加拿大Alberta大学报告33位糖尿病病人,在采用 Edmonton Protocol的单独胰岛移植术后成功率达85%,但多数接受者需接受2次或以上的移植。且术后5年不需接受胰岛素治疗的比率降至10%。
但使用这个干细胞疗法“治愈”1型糖尿病的美国患者,需要一直服用免疫抑制剂,否则他的免疫系统会对移植来的胰岛细胞产生排斥反应。
这个问题同样是今天提到的这名患者需要面对的,这名患者本身是一名肾移植患者,在2017年手术之后也需要使用抗排斥反应的药物。
异体移植的自不必说,即便是使用iPSC等中间体干细胞,由患者自己体内产生干细胞胰岛,它们仍有可能被患者的免疫系统识别为外来物体并进行攻击。
虽然使用其他器官移植的抗排斥药物(比如一些免疫抑制剂)可以保护这些移植的胰岛组织,但是这些药物的长期使用也可能产生不良作用,比如提高感染风险和癌症风险。
我们不清楚的是,这些不良反应的风险与控制住血糖的获益相比,究竟孰高孰低。
三
当然,各国的研究人员也在想办法解决这些问题,例如用一些免疫调节生物材料和特殊封装方式保护移植的胰岛组织,使得胰岛β细胞可以接触到葡萄糖等小分子并释放胰岛素,但不与宿主的免疫细胞接触。
以上这些问题,是干细胞移植治疗糖尿病面临的诸多挑战,它们并非无解,只不过需要更多更加深入的临床研究。
大家也要知道,这些研究还处于很早期的阶段,其中蕴含着很多风险,也要谨防其他一些打着干细胞名号坑蒙拐骗的不正规治疗方式。
总而言之,中国科研人员的这项研究是全球糖尿病治疗领域的一个进步,给2型糖尿病患者带来了治愈希望。
本文来自微信公众号:CC情报局 (ID:cancer-weekly),作者:庄时利和(凤凰网《CC情报局》特约专家)

