数据显示,中国现有心衰患者约890万名,近半的患者在心衰诊断后5年内死亡,其5年生存率比大部分恶性肿瘤还低。
过去,心衰无法根治,医学手段只能延缓病情发展。近年,随着科技进步,心衰患者迎来了新的治疗手段。
2020年5月,《Nature》杂志报道,两位终末期心衰患者在中国接受了基于重编程干细胞的心衰治疗,并在一年后康复出院。据悉,患者于2019年5月在南京鼓楼医院注射了从iPSC分化得到的心肌细胞,手术由该院心胸外科主任王东进教授完成。这是已知的全球首个用于治疗受损心脏的iPSC技术的临床应用。
iPSC(induced pluripotent stem cells),即诱导性多能干细胞,是指通过人工对体细胞进行重编程,逆分化培养出的一类多能干细胞。iPSC具有多向分化和强大自我复制潜能,在一定条件下可以分化成多种功能细胞,且可以在体外培养获得数百万甚至数十亿的临床相关表型细胞。
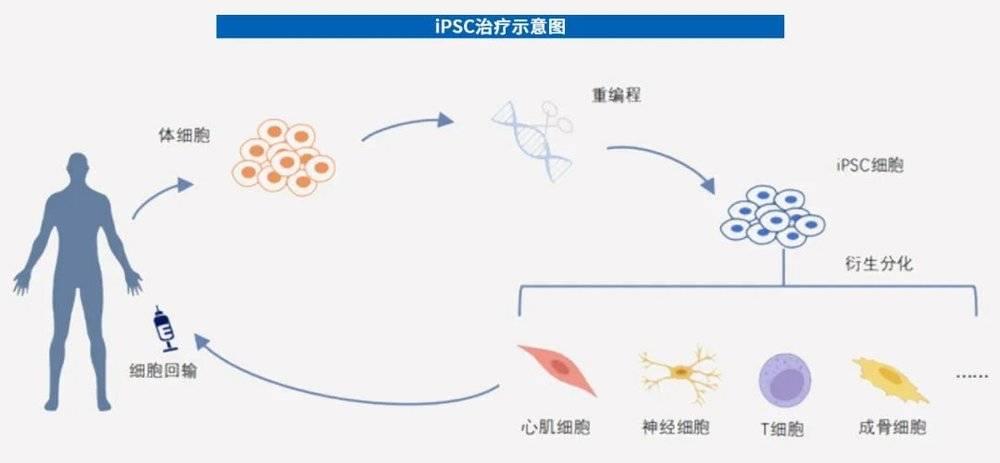
科研人员通过获取体细胞(如成纤维细胞等)进行体外重编程诱导成iPSC,再衍生分化为目标细胞(如心肌细胞等),进而回输到患者体内,达到修复组织和增强免疫的效果。
2006年,日本京都大学山中伸弥教授利用病毒载体将四个转录因子(Oct4、Sox2、Klf4和c-Myc)的组合转入小鼠皮肤细胞中,成功诱导出iPSC。因此,山中伸弥在6年后获得了2012年诺贝尔生理学或医学奖。
而后,大规模关于iPSC的研究在全球范围内全面展开。其中,中国研究团队如裴端卿教授、邓宏魁教授、丁胜教授等课题组,在化学小分子诱导iPSC方面作出了重要贡献。
目前,iPSC在疾病的临床治疗上已有多种应用尝试,适应症包括心衰、脑卒中、膝骨关节炎、帕金森、白血病等。2022年4月,中国首次批准了一项iPSC来源的细胞治疗产品进入临床试验。
此外,iPSC还可用于药企端的药物筛选CRO(研发外包)服务、科研端的建立疾病模型等。
九鼎投资研究认为,iPSC技术与基因编辑技术类似,同属于能够对生命进行工程化改造的底层技术,具备系统性投资机会。
目前,iPSC行业以非医疗级(即面向药企端和科研端)的销售收入为主。随着细胞治疗产品的上市,市场发展潜力巨大。
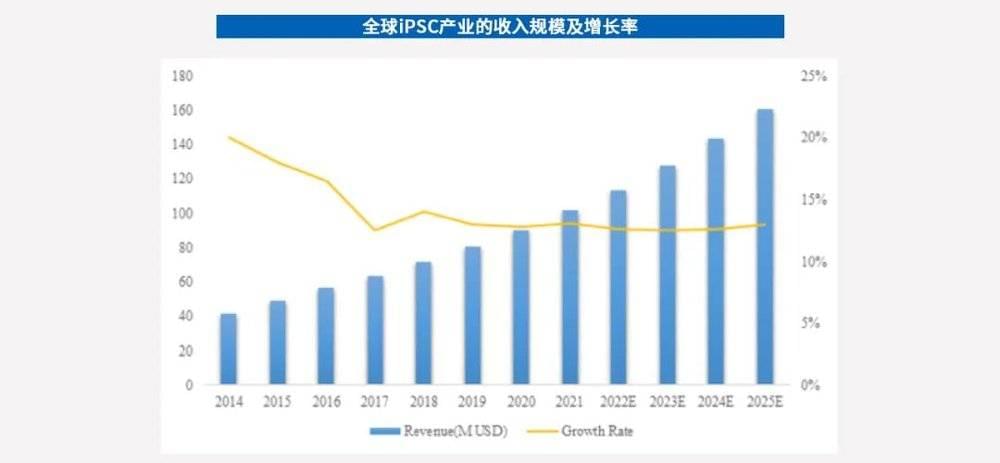
据不完全统计,iPSC的全球收入在2019年约8000万美元,预计到2025年将达到1.6亿美元。未来五年,预计全球收入的复合年增长率为12.26%。
一、细胞治疗时代,iPSC或成最优解
2015年,著名癌症医生、作家悉达多·穆克吉在《忘记药丸吧,细胞疗法即将到来》的演讲中提到,药物治疗曾给人类历史带来一场巨大变革,让肺炎、梅毒、肺结核等疾病得以治愈。
药物治疗的模型是——“疾病,药物,靶点”。例如,感染了肺炎,可以服用青霉素,杀死微生物。
然而,药物治疗疾病的模型并不总是奏效。自然界提供了另一视角去看待疾病:细胞结合成器官,器官聚合成生命,最终构造了丰富的生态系统。
穆克吉认为,对于大量非感染导致的疾病,包括糖尿病、高血压、心脏病等慢性退行性疾病,相比“杀死某些东西”,人们要做的或许是“培养一些东西”,即细胞。细胞治疗的模型是:“细胞、组织、环境”。
在九鼎投资看来,细胞治疗将成为未来疾病治疗的重要方式之一。其具有独特作用机制,主要优势在于:疗效显著持久、个性化治疗、以及可治疗传统药物治疗方式中无药可医的疾病。
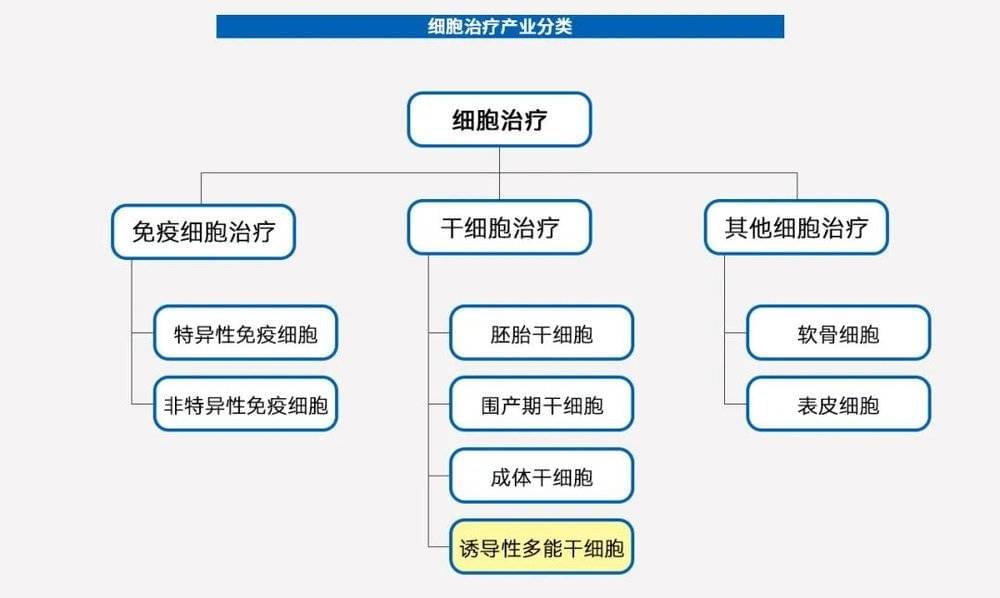
一般认为,细胞治疗包括免疫细胞治疗、干细胞治疗、以及其他细胞治疗。
在细胞家族中,干细胞是建设与修复者,免疫细胞是防卫军,它们为打造出一个健康人体的目标而相互协同。
当人体还在成长时,干细胞通过源源不断的分裂和分化出新的细胞,增加细胞的种类和数量;当成年后身体不再成长,干细胞又能及时替换和更新衰老或受损的细胞;而当有外敌(如细菌和病毒)入侵,或内部出现叛变分子(如正常细胞突变为癌细胞),免疫细胞就会将其快速识别并清除。
就干细胞而言,其按来源可分为胚胎干细胞、围产期干细胞和成体干细胞。
胚胎干细胞是从胚胎中分离的干细胞;
围产期干细胞是从胎儿出生时附属的脐带血、脐带、胎盘等组织中提取的干细胞;
成体干细胞是从成人身体组织中提取的干细胞,如骨髓、脂肪、神经、皮肤等。
用中国科学院广州生物医药与健康研究院研究员裴端卿的话来说,“成体干细胞好比大树的树干,胚胎干细胞相当于大树的树根。胚胎干细胞不但保持无限的自我更新的特性,同时可分化为体内的各种组织细胞类型,被认为是最具临床应用价值的‘万用细胞’”。
不过,由于胚胎干细胞需要从胚胎中提取,在临床应用时有伦理风险。而iPSC具有类似胚胎干细胞的分化潜能,且可用成年人体细胞进行诱导,解决了再生医学长久以来面临的伦理学问题和异体移植所产生的排异反应,来源便捷,兼具通用型和个性化治疗产品能力,具有更广阔的应用前景。
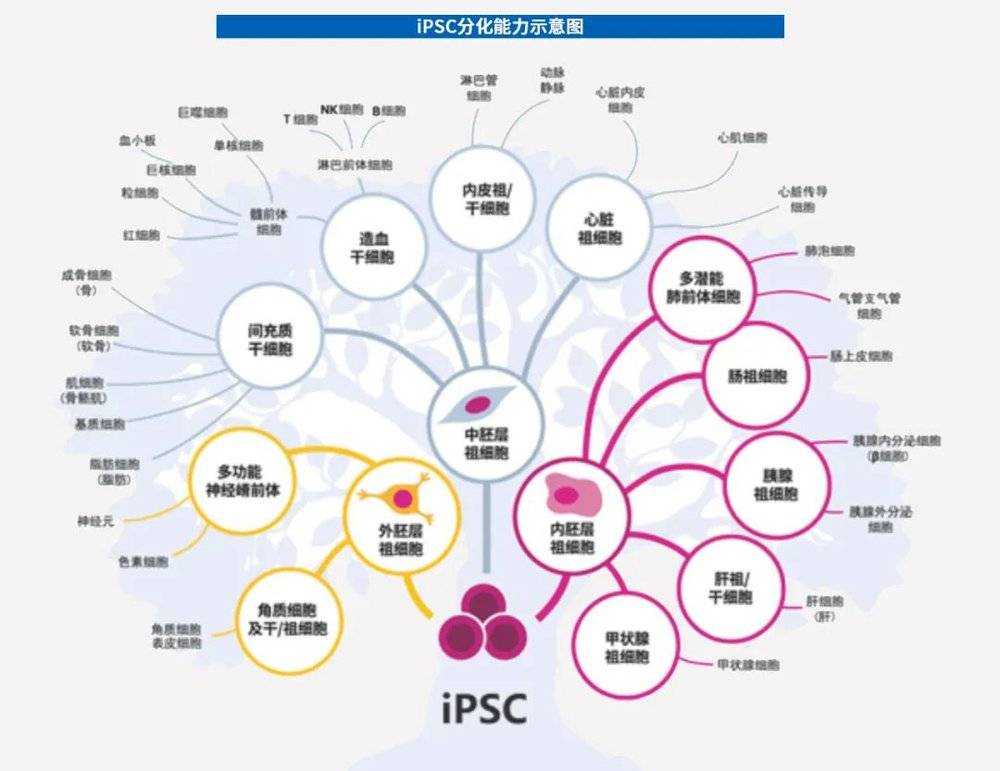
iPSC亦可分化为免疫细胞。目前,人类iPSC来源的CAR(嵌合抗原受体)-T、CAR-NK、CAR-M等细胞疗法已问世,并开始逐渐向临床转化。
一个里程碑事件是,2020年10月,日本千叶大学和理化学研究所的研究团队宣布,已成功地完成了世界首例将基于iPSC分化的NKT细胞移植至癌症患者体内的移植手术。这也是日本首次尝试利用iPSC治疗肿瘤。
目前进入临床上应用的免疫细胞治疗产品,基本以患者自体免疫细胞为原材料。自体来源的免疫细胞治疗产品高度个体化,生产规模有限,质量控制难度较大,制备周期长,病情进展迅速的患者无法从中受益。而通过iPSC技术,可制备异体来源的“现货型”免疫细胞治疗产品,逆转机体损伤或疾病。
iPSC还可用来培养类器官,类器官对于精准医疗、新药研发、感染生物学、毒理学研究,甚至公共卫生安全和军事领域均有应用价值。
此外,iPSC可与CRISPR等基因编辑技术结合,在许多类型细胞中精确、定向地进行基因敲除或敲入,包括单碱基改变,纠正干细胞基因组内的基因差误,为个性化医疗增添新的途径。
在九鼎投资看来,iPSC作为一种新兴技术,把免疫细胞治疗、干细胞治疗、甚至类器官培养和基因编辑等技术都“串”了起来,显示出巨大的应用潜力。就目前来说,iPSC可能是最优的细胞治疗方案。
二、通往应用之路的“大山”:技术、成本
理论上,任何类型的体细胞都容易被重编程,但iPSC基本由易于获取的细胞(如来自皮肤或血液的细胞)制备。
以经典四因子法为例,制备iPSC主要涉及四大步骤:体细胞的分离与培养→介导载体的构建→诱导因子的导入及细胞培养→iPSC的筛选及鉴定。
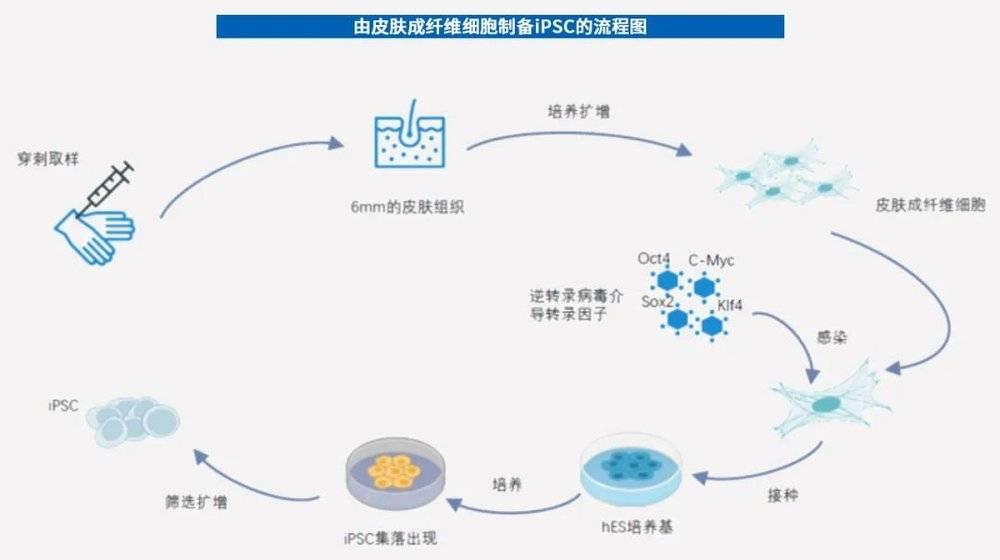
从最开始的经典四因子法,到通过各种手段改进升级或者替换,如今诱导iPSC的技术路线超过30种。
但iPSC的产业应用尚属早期阶段。尤其在安全性方面,山中伸弥教授曾在其学术论文中提到,致瘤性、免疫原性和异质性作为iPSC的固有特性,也是其应用的三大挑战。
致瘤性是指,iPSC的一个重要优势是其无限增殖的潜力,因此能用于制备数种不同类型的人类细胞用于移植。然而,这种特性是一把双刃剑。如果细胞在移植后继续增殖,可能导致肿瘤。
免疫排斥则是任何细胞治疗中都不可避免的问题。虽然自体iPSC(用患者自身的细胞诱导iPSC) 的低免疫原性得到了研究证实,但在目前的iPSC项目中,同种异体(用他人细胞诱导iPSC)的“现货型”iPSC占主流,这也带来了更大的免疫原性问题。
虽然多能干细胞都具有多能性和无限增殖性,但不同细胞系之间的多能干细胞在形态、生长曲线、基因表达和分化成各种细胞谱系的倾向方面不同。这种异质性会给下游应用带来障碍。
据九鼎投资访谈,目前业界对于iPSC的致瘤性和免疫原性的问题,已有比较成熟的技术解决方案,但解决异质性的技术还不成熟。
解决致瘤性的方案包括:建立有效的体外定向分化方法、保持严格的纯化程序、开展后续长期致瘤性实验作为安全性评估等。和普通肿瘤检测方式类似,iPSC致瘤检测方式包括肿瘤标志物和影像学。
目前,应对免疫排斥的主要方式,是建立iPSC超级供体库和利用HLA(人类白细胞抗原)隐藏技术。
异体移植需要用来自具有相似同源的HLA供体并重新编程的iPSC,而寻找全相合匹配者耗时、困难且成本较高。
人群中存在一类“超级供体”,其HLA基因5位点是高频单倍体纯合子。基于这些少数供体制备的细胞,可覆盖高数量的受体人群,在一定程度上可规避大量个体的前瞻性分型,降低iPSC制造过程的成本和时间。
目前,多个国家及地区已建立了iPSC超级供体库,中国也在2018年制备完成首例由“超级供体”诱导的多能干细胞株。和美国类似,中国的人群HLA复杂,其超级供体大约只能覆盖50%的中国人群,因而需要建立个人iPSC库,作为未来可用储备。
超级供体库可以提供半相合匹配者,但不论是全相合还是半相合,都具有一定的GvHD(移植物抗宿主反应)和HvG(宿主抗移植物反应)的风险。
另一方面,由于 HLA 基因型在人群中高度可变,iPSC 库的建立也相对困难,而CRISPR/Cas9等基因编辑技术可对杂合iPSC进行基因编辑,帮助建立HLA纯合细胞,这项技术被称为HLA隐藏技术。
但目前该技术尚不成熟,难以成药。而且,这样处理HLA可能对iPSC的细胞功能治疗效果有影响,也不能100%排除排异反应。
为了克服异质性,一些研究人员试图将多能干细胞的“启动”状态转换为“初始”状态。已有多种方法被报道用来转化iPSC的“初始”或基态多能性,包括结合使用生长因子的化学抑制剂组合。
不过该技术目前也不成熟,其转化得到的初始人类干细胞可能导致过速增殖,少数情况还可以发生染色体异常。
该技术还会造成印记丢失。初始人类干细胞的一个特征是整体低甲基化,在重新分化到启动状态时将被重新甲基化,然而大多数印记基因在重新启动的细胞中会被抹去,这种异常印记可能阻碍其临床应用。
对于自体iPSC来说,存在时间和经济上的巨大成本挑战。
据九鼎投资了解,iPSC通常要用2个月建立细胞系,用3个月放大,再用3个月让iPSC分化到衍生的目的细胞,然后继续用几个月放大,最后用大半年测试细胞不会形成肿瘤。而且这一切必须在GMP条件下进行,这又大大增加了成本。
此外,尽管诱导iPSC的技术路线已经很多,但业界关于iPSC的生产工艺、再加工方式、移植方式还在摸索阶段。
九鼎投资调研得知,iPSC生产工艺的难点在于细胞的高纯度提纯,而再加工方式和移植方式需要摸索的点包括:iPSC来源的细胞不能直接输入人体进行治疗,应以微包囊、细胞团等方式打进去。针对不同的移植部位,哪种再加工方式更有利于细胞的定植。
三、打通应用之前,先做好“基建”
除了临床端,iPSC还有两大应用方向:面向药企端,提供药物筛选CRO服务;面向科研端,建立疾病模型。
1. 药物筛选CRO服务
传统的药物筛选主要基于普通细胞模型或动物模型,但存在模型与病理不符、成本过高、周期过长等局限,而iPSC具备无限增殖、定向分化、高度还原病理状态等优势,应用于药物筛选可提高效率、降低成本。
具体来说,药物研发早期,高淘汰率的药物通常与体内次优筛选检测结果不准确有关。目前,提高新药研发效率的障碍是,使用非人类动物模型评价药物的靶器官毒性,无法准确地预测、评价人体毒性。
例如,啮齿类动物实验经常被用来预测人类的心脏毒性,该实验的明显缺点是:高成本、低通量和有限的人类相关性,且其离子通道与人具有差异性。用来自于动物的心肌细胞进行体外实验,也不能很好地解释人体实验中出现的结果。
iPSC提供了克服这些障碍的可能性,其显示出许多和正常体内细胞相同的特征,如形态结构、基因表达、功能性离子通道、受体表达及电生理特性。这些特征都支持使用iPSC分化的心肌细胞进行药物心脏毒性检测。
更为重要的是,大规模药物筛选通常需要很多细胞。因iPSC可在体外无限增殖,疾病模型的iPSC以及分化的功能细胞可无限提供,并且在产业化制备时可保证细胞批次间的一致性和稳定性。
2. 建立疾病模型
iPSC技术可将患者的体细胞重编程为患者特异性的iPSC,有着明确的疾病相关性和遗传信息,并可进一步诱导分化为疾病相关细胞类型或类器官模型,从而构建体外疾病模型。
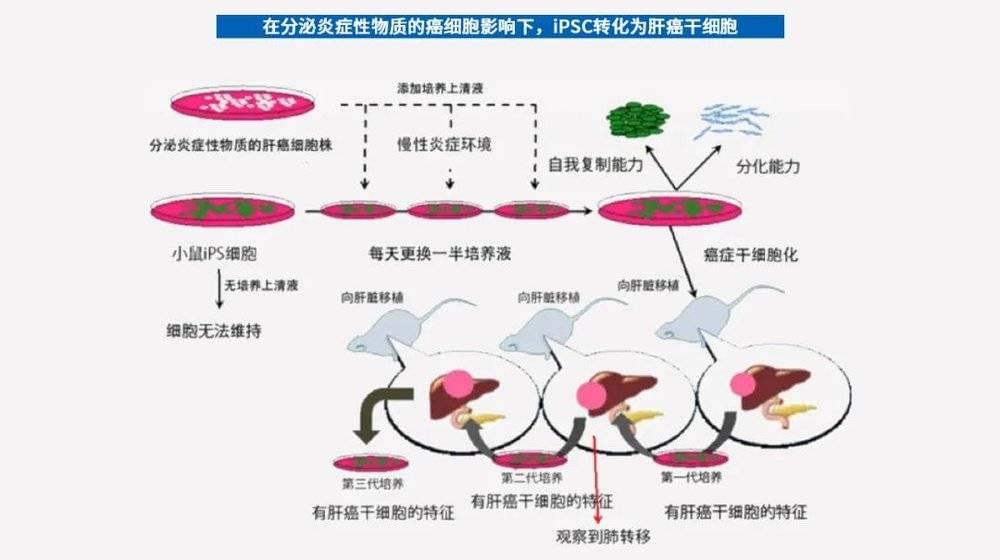
例如,日本冈山大学研究生院的研究团队,利用分泌多种炎症性物质的人肝癌细胞株培养上清液,培养了小鼠的iPSC,并将iPSC诱导为肿瘤干细胞,然后将肿瘤干细胞移植到裸鼠的肝脏中,成功制作了肝癌模型。这是世界首次成功制作出肝癌模型。
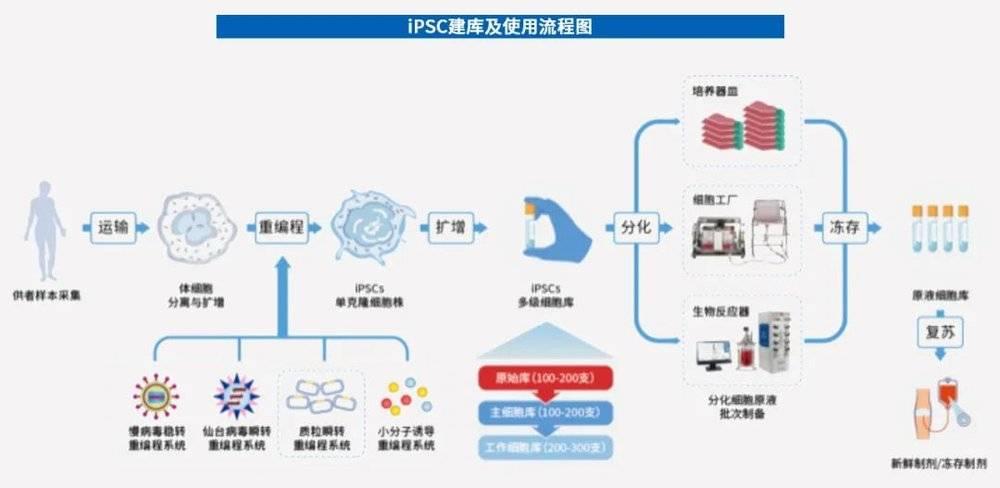
不管iPSC如何应用,都有一个前期工作:细胞建库。
细胞建库,通常是指逐步增加容器数量或扩大容器培养,以获得足够量的细胞,并将其分装到足够量的容器中。
细胞库包括原始细胞库(PCB,又称细胞种子)、主细胞库(MCB)和工作细胞库(WCB)。生产商可制备自己的细胞库,也可从外部获得。
iPSC的建库流程主要包括:样本采集-体细胞分离与扩增-重编程诱导-筛选iPSC单克隆细胞株-扩增-检测等。
iPSC用成体细胞的收集来源,主要包括各类成体干细胞库、医疗机构样本库以及各类机构的遗传资源库等。
现在,全球iPSC建库都在起步阶段,且以公共建库(即超级供体库)业务为主,私人建库在未来将具备一定的发展潜力。
据九鼎投资了解,中国仅有山东、北京、上海、天津、广东、浙江、四川七个省/市级合法脐血库,并且不再发放新的牌照。这些脐血库背后有民营企业的身影,拥有牌照的这些企业在进行iPSC私人建库业务时具有优势。
在短期内,iPSC私人建库可能面向的是偏高端消费群体。
经九鼎投资测算,不算房租、水电、实验人员工资,仅包含细胞培养试剂、实验耗材(如离心管、培养皿等)、细胞冻存耗材(如专用冻存液、冻存管)、iPSC身份检测(如多能性、核型等检测)等费用,企业的单株iPSC的生产成本在3000-5000元。这意味着,私人建库商业化产品的单价将在万元以上。
四、全球竞争格局下,中国公司的机会与挑战
据九鼎投资调研,iPSC相关的商业模式主要有两种:
一是用iPSC进行细胞治疗,进行临床管线的推进。
二是进行iPSC诱导、建系、扩增、分化、建库等技术服务(包括定制化研发生产,即CDMO)以及销售细胞株、细胞培养基等相关产品。
对于iPSC治疗公司,其竞争要素集中于以下几个层面:
1. 成熟稳定的细胞生产和质控工艺
要保证iPSC治疗产品的安全性,需要从控制细胞培养原材料的质量入手,优化iPSC的培养、分化和批次生产的工艺。同时,干细胞制备必须在完全无菌的环境下进行,这对实验室和生产设施的环境要求较高。根据国家规定,细胞治疗产品的生产必须在B+A级洁净度的实验室或生产车间中进行。
2. 中检院质量复核认定
中检院(中国食品药品检定研究院)是国家法定的生物制品药品质量检验机构,也是三甲医院唯一认可的临床级细胞检验机构。如果一家公司获得了中检院的细胞质量复核认定,说明其干细胞质量已达到临床级别。
3. 适应症选择
市面上iPSC公司管线已覆盖多个适应症。其中心衰、脑卒中、帕金森无药可治,实体瘤缺乏有效手段,这些适应症更有市场价值。而I型糖尿病、白血病已有替代疗法可选,膝骨关节炎不严重影响生活质量,患者对此的支付意愿相对较低。
4. 医院合作认可
大多数的干细胞临床研究项目由干细胞公司与医院合作进行。与知名医院有无合作关系,是判断iPSC公司实力的重要依据。
5. 管线进度
目前,全球暂未有iPSC疗法获批上市,已开展临床试验或获得临床试验默示许可(IND)的产品共有19项。管线进度最快的,是澳大利亚上市公司Cynata的CYP-004。其用iPSC衍生的间充质干细胞(MSC)治疗骨关节炎,已进入临床3期。
6. 专利
日本FCDI(富士细胞动力)公司在制备iPSC、扩增iPSC、诱导iPSC分化的技术方面具有大量的专利,尤其是CAR-PSC分化为T细胞或NK细胞的专利现有权利要求保护范围较大,其他公司需注意避开。
今天,从全球竞争格局来看,中美日在iPSC赛道处于全球领先,尤其中美差距相对较小。在获批IND的企业数量上,美国有9家,中国有6家。
作为全球iPSC行业的明星公司,美国的Fate和Century目前的发展并不尽人意。
Fate成立于2007年,2013年在纳斯达克上市。作为iPSC领域的先行者,其打造了全球首个iPSC衍生的通用型CAR-T疗法。
2020年4月,Fate曾与强生达成合作:强生旗下杨森公司为4个肿瘤相关抗原靶点贡献专有的抗原结合结构域,Fate来研究和开发iPSC衍生的CAR-NK和CAR-T细胞候选产品。在候选药物提交IND之后,杨森行使相关产品的商业化独家许可权。若合作顺利,Fate将获得来自杨森最高31亿美元的资金支持。
但好景不长,2023年1月,Fate宣布,拒绝强生的续约条件并终止合作协议,并将裁掉约60%的员工,同时关停大多数的在研项目,全力推动重要项目的运营。
有媒体报道,Fate已在临床一期停滞多年。其iPSC产品迟迟不能进入临床二三期(即关键性临床试验)的原因,是安全性和质控没达到FDA(美国食品药品监督管理局)的要求。临床进度不及预期,或是Fate与强生分手的导火索。
另外一边,Century成立于2018年,2021年上市时以iPSC为证券简称。但时至今日,这家“最正宗”的公司还没有一个产品进入临床阶段,并走向了和Fate相似的路径:股价下跌超90%,要大幅裁员和砍管线以维持公司的生存。
在九鼎投资看来,任何新兴技术,都要有人去推动、去冒险。iPSC治疗公司当前发展的核心在于,须把技术难点攻克,解决产品的安全性和有效性问题。如果某些技术无法突破,应及时止损,集中精力和资源在一些重点的、成功概率更高的管线上,尽快将其推向商业化,这样才能够良性循环。
而在通往新世界的途中,相比于iPSC创新药所面临的研发周期长、上市不确定性较大等挑战,九鼎投资认为,iPSC建库等技术服务类业务具备“基础设施”属性,在现阶段或许更值得投资者关注。
其中,以建库业务为例,其体量更大、商业化难度更低,也是“通用型”细胞疗法能得到普及的前提条件。
本文来自微信公众号:九鼎投资(ID:JD_Capital),作者:九鼎投资

