万物生而有灵,生命的复杂与奥妙常常超乎我们的想象。生物中一些看似微小的异常与变化,或许就能被人们延展出一门枝叶繁茂的前沿学科。
提到“遗传”“基因”,也许多数人的第一反应,就是双螺旋结构的DNA长链,上面的碱基排列组合,承载着我们生命的“密码”。但是,在DNA序列之上,还有另外一套机制在发挥作用。它就像一个信息的筛选器,控制着DNA序列中的哪些部分可以得到表达,哪些部分则会变成沉默的“无效信息”。

在生物医药领域,表观遗传学研究有重要意义。它可以帮助我们攻破肿瘤治疗的难题,比如延缓肿瘤耐药性的形成,提升肿瘤对于药物的敏感性。它还有助于我们研究红斑狼疮、阿尔兹海默症、帕金森症等由表观修饰异常引发的复杂病种,理解它们的致病机制,寻找新的治疗药物。
目前,与基因组学相比,表观遗传学的整体发展还处在早期阶段,进展主要集中在学术界,临床检测和药物研发的产业转化较少。但是我们相信,随着技术进步,表观遗传学的研究方法将迭代和普及,未来这一领域会有更多科研突破。同时,人类对复杂疑难疾病的治疗需求,也将推动生物医药工作者们在相关方向持续探索。
你将在本文读到:
为什么DNA序列不能完全决定生物的表型特征?
“同种不同命”,为什么饮食也会影响基因的表达调控?
表观遗传学如何帮助我们攻克恶性肿瘤、阿尔兹海默等复杂疾病?
表观遗传学领域,会出现下一个“华大基因”吗?
表观遗传学在学术和产业领域的发展前景如何?
在表观遗传学领域,有哪些创业和投资机会?
我们为什么要关注表观遗传学?
提到“表观遗传学”,许多人会感到十分陌生。但下面这几个生活中的现象,也许会引起你的兴趣。
第一个现象是三花猫。三花猫都是雌猫,身上有白、黄、黑三种颜色。有意思的是,造成黑色和黄色毛发的基因,是雌性猫X染色体上均为显性的等位基因。根据中心法则,雌猫的两条X染色体分别携带黄色和黑色基因时,毛发应该呈现黑色和黄色的混合色,即棕色。但我们看到的三花猫却是黄黑相间,也就是说毛发选择性地表达一种颜色。三花猫的特殊毛色是怎么形成的?
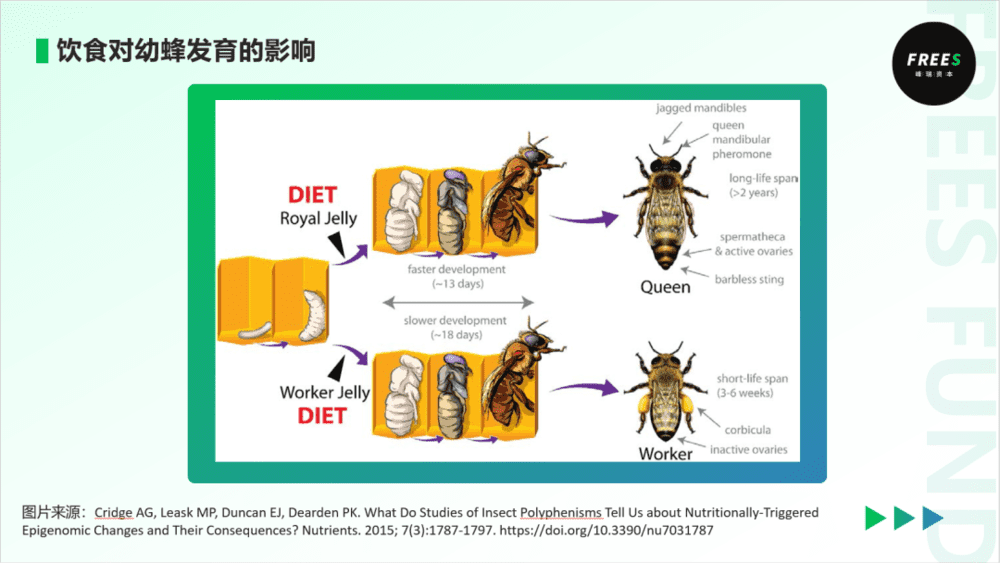
第二个现象是蜜蜂。在一个蜂群中,工蜂和蜂王都是雌性,但它们差异非常大。蜂王只负责产卵繁衍后代,而工蜂则丧失生育能力,负责采集食物、修筑蜂巢、哺育幼虫等蜂群内外的劳作。蜂王寿命有几年,而工蜂只能存活几个月。决定雌性蜂幼虫发育为工蜂还是蜂王的主要因素在于饮食:雌幼虫连续食用蜂王浆,就会发育成为蜂王;而如果前三天被喂食蜂王浆,之后被喂食蜂蜜和花粉,则会发育成为工蜂。为什么蜂王浆可以决定幼蜂的发育“命运”呢?
第三个现象是二战后期的“荷兰大饥荒”。二战后期的荷兰,流亡政府因为预判德国将要崩溃,组织人民举行罢工。作为报复,纳粹切断了1944年冬天至1945年4月份的荷兰食物供应,造成两万人死亡。这一时期被荷兰人称为“饥饿的冬天”(The Hunger Winter)。如今,“饥饿的冬天”已经过去近80年,但不幸的是,饥荒似乎被记录在了遗传物质当中,因为大饥荒时期怀孕的人生下的子女,往往体型更小。难道饥荒对人们的影响会遗传吗?
上面几个例子,都可以用表观遗传学的知识来解释。
表观遗传学是指基因组之上、之外的调控机制,英文名称为Epigenetics,其中epi-有“之上,之外”的意思。顾名思义,表观遗传学既研究“表观”的调控规律,又研究这些调控规律如何遗传的。那么,当下我们为什么关注表观遗传学?
首先,从人口年龄结构和疾病谱的变化看,我国平均预期寿命已达78岁以上,伴随人口老龄化,以神经和精神系统疾病、糖尿病、肿瘤等为代表的慢性非传染性疾病已成为影响我国居民健康的主要疾病。这些疾病往往是机体与环境的交互失调导致。作为研究生命体的基因表达和外部环境相互作用的学科,表观遗传学领域的研究与这一类疾病的致病原理十分契合,可为相关的疾病诊疗和药物研发提供新思路。
其次,从药物研发角度,当前研发者越来越关注疗法在病灶部位起效的“选择性”,也就是使药物更精准地作用在发病位置,而不累及其它健康的器官和功能。而表观遗传的本质是调控基因的表达,这一特质为提高上述“选择性”提供了新的方法。
例如,通过干预表观遗传靶点,可以增强肿瘤对于治疗药物的敏感性,克服肿瘤耐药性甚至肿瘤的转移,展现出药物联用的优势。另外,在基因治疗药物中,表观遗传元件的使用可以增强药物的精准性,使药物发挥功能向人体生理靠拢。未来,表观遗传研究在精准医学方面的价值和潜力将不断得到挖掘。
第三,表观遗传学发展仍处于早期,潜力可观。过去几十年,华人科学家在表观遗传领域做出了大量贡献,如哺乳动物DNA甲基化的建立和去甲基化,多种组蛋白去甲基化酶的发现,RNA的表观遗传学等等。未来,这一领域仍将不断取得进展,一系列新的表观遗传机制有待发现,成像和测序工具将向高效、低成本化迭代,临床端药物的种类和形式也将不断创新。
表观遗传学:出牌顺序不同,结果不同
相较于表观遗传,“遗传”和“中心法则”可能是人们更为熟知的概念。中心法则指的是遗传信息从DNA流动到RNA再流动到蛋白质。中心法则的存在,使得人们往往认为,基因组DNA序列决定着生物体所有表型。同时,由于DNA序列的稳定性,这些表型特征可以稳定、多代地遗传。应用基因编辑等技术,也有可能治疗诸如L-镰刀型红细胞贫血症、囊性纤维化这类因为单基因突变导致的遗传病。
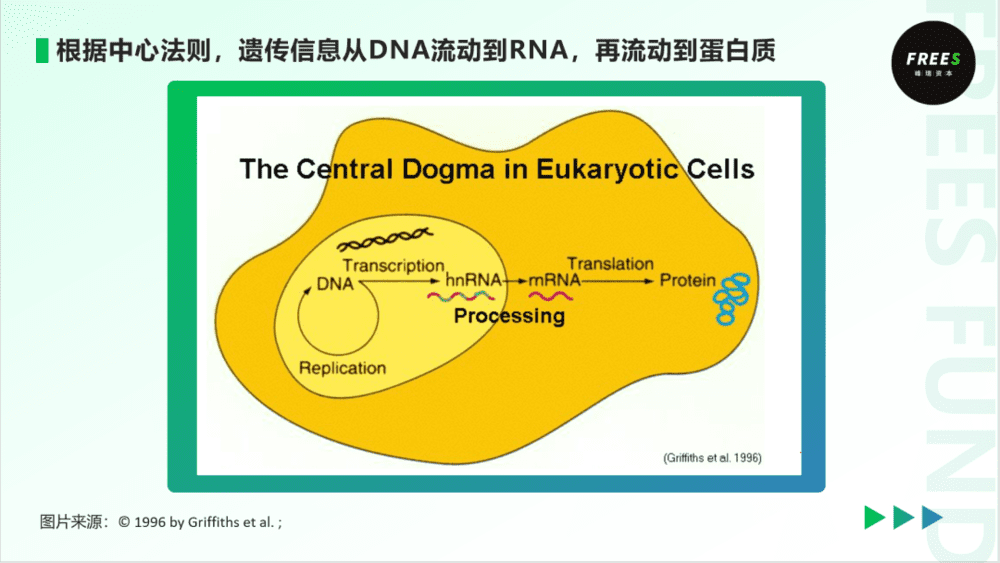
而事实上,一些生物的性质,看似不遵循传统中心法则。在DNA序列没有发生改变、启动基因表达的生物学元件没有缺失的情况下,DNA表达的调控发生了改变,造成个体和个体细胞有着不同的表型。而且,某些差异还可以遗传至下一代或子细胞。好比玩扑克牌,打牌选手和牌没有变,如果出牌顺序变化了,就会带来不同的结果。这些中心法则之外的现象,往往是表观遗传学所关注的内容。
表观遗传地势图形象地解释了“表观”的概念。图中把基因的表达类比为一个铁球从山坡滚下的过程,不同的调控因素对应不同的山坡,这些山坡的走势影响了小球落到哪个山谷,也就是如何表达。

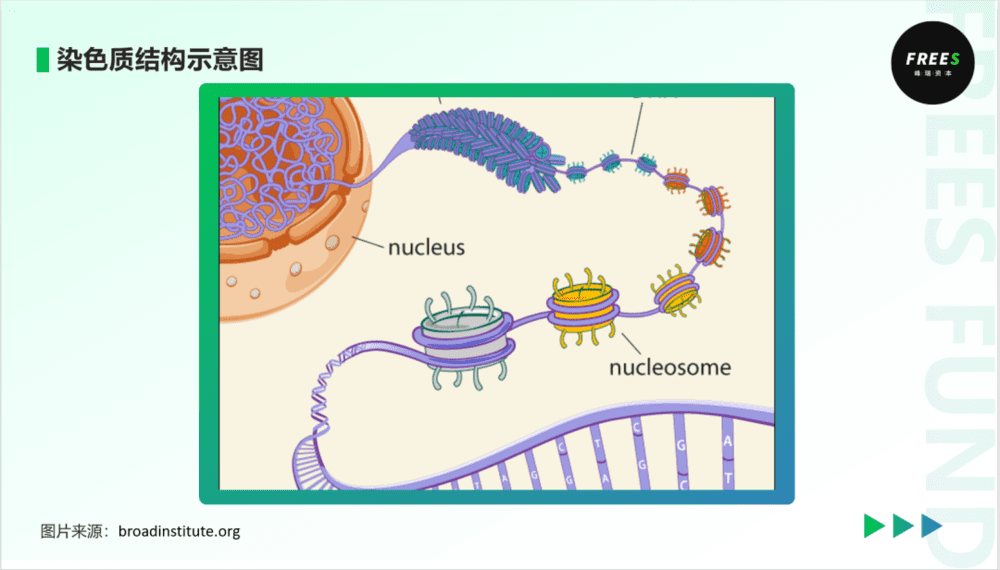
在微观层面,表观遗传学研究的中心是染色质,更确切一点,是不依赖DNA序列改变的染色质结构变化。染色质包含着个体的遗传信息,由DNA和组蛋白形成。染色质的基本结构单元是核小体,是DNA缠绕两圈组蛋白形成的圆盘状结构。人的DNA展开长达2m,而细胞核直径仅仅6微米,相当于把40km长线放入一个网球。很显然,从核小体到染色质,中间经历了非常多而有序的折叠步骤。
在不同的层次,染色质结构与DNA表达调控密切相关。染色质的结构一定程度上对基因表达进行了选择。在染色质折叠紧密的地方,基因表达元件难以靠近,基因表达受限。在折叠程度疏松的地方,基因表达则相对活跃。
三花猫、蜜蜂、“荷兰大饥荒”:解密表观遗传的微观调控机制
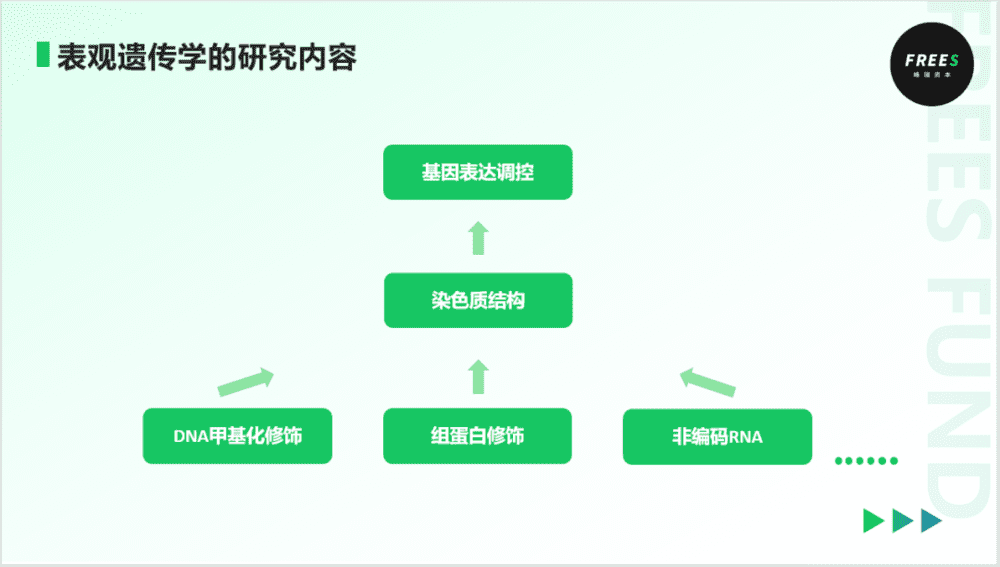
在微观尺度,主要有三个因素来调控染色质结构,从而改变基因表达。它们分别是,DNA甲基化修饰、组蛋白修饰以及非编码RNA。这是表观遗传影响个体表型最为重要的三种机制。三者共同决定染色质的结构,进而影响基因的表达。
1. DNA甲基化修饰
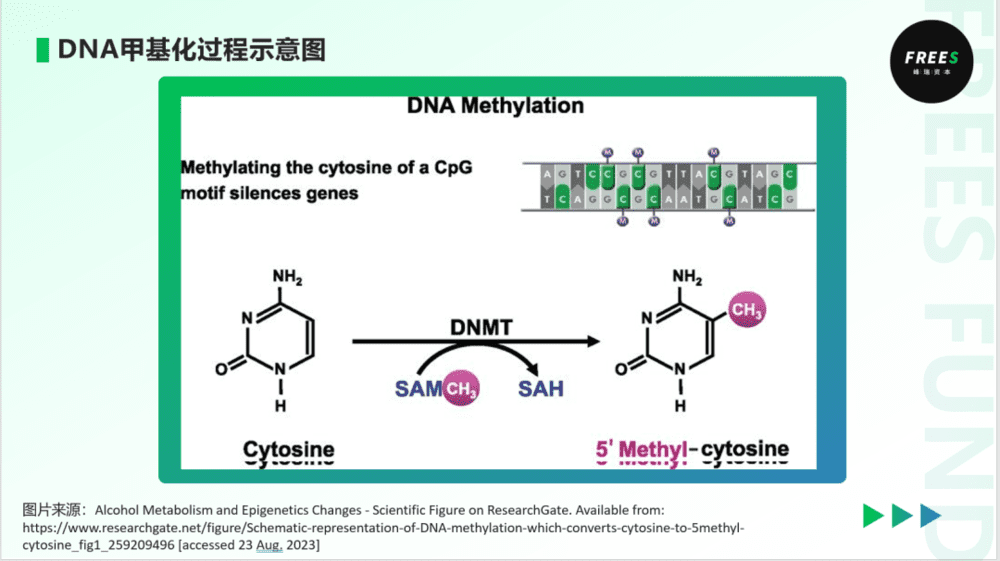
DNA甲基化(DNA Methylation)修饰,是目前被人们研究得较为充分的表观遗传机制。
DNA甲基化是指,在DNA甲基转移酶作用下,DNA上的特定C碱基(胞嘧啶)的5’位置连接上-CH3(甲基)基团的过程,在哺乳动物体内主要出现在胞嘧啶-鸟嘌呤(CpG)二核苷酸位置上。甲基化通过一个简单的化学标记,提供特定的分子形态信息,和空间上的位置障碍,通常能够阻止转录因子结合,抑制基因的表达。
在蜜蜂发育的例子中,饮食不同造成的DNA甲基化修饰差异,可能是造成雌性幼虫发育结果不同的重要因素。实验观测到,工蜂与蜂王有超过550个基因呈现不同的甲基化状态。蜂王浆能降低雌性幼虫的甲基化水平,促进幼虫发育出完整的卵巢组织,最终成为蜂王。相比之下,幼虫在后期食用蜂蜜,甲基化水平维持在较高程度,最终发育成为工蜂。有趣的是,当人为操作,降低雌性幼虫DNA甲基化水平,也会促进蜂王样的表型。
人有两套染色体组,分别来自于父亲和母亲,根据孟德尔遗传定律,父源和母源基因的表达,共同决定着子女的性状。然而事实上,人体内存在一类特别的基因,也就是印记基因,它只选择性表达父本或母本来源的等位基因。其结果是,这类基因对应的性状只由单亲一方决定。
造成这种表达差异的因素,在于父源和母源印记基因调控区域的甲基化状态不同,改变了基因表达。因而,父母只有一方会影响子代的性状。由此,人们可以通过印记基因在染色体的表达情况,推断染色体来自于父方或母方。印记基因目前也被应用于血缘分析和刑侦分析中。
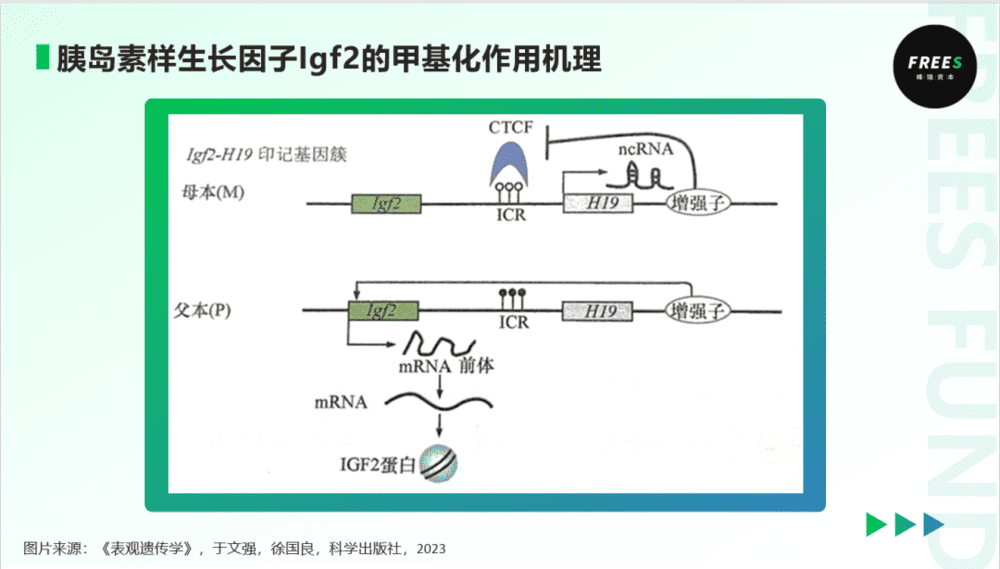
胰岛素样生长因子Igf2是目前被研究得最为彻底的印记基因之一,为我们在上文提及的荷兰大饥荒灾民的子代发育不良问题,提供了一个解释。
Igf2是一个父系表达的印记基因。如下图所示,在正常的人体生理状况下,母本Igf2的印记基因调控区(ICR)没有被甲基化,调控蛋白(CTCF)能够结合ICR区域,从而阻挡下游增强子接近Igf2基因,Igf2基因无法表达。相反,父本的调控区被甲基化,甲基的空间阻碍使得调控蛋白无法结合ICR区域。因而,下游增强子可以接近Igf2基因,并启动促进生长发育必要的生长因子的表达。简单来说,Igf2的父本印记基因表达,而母本印记基因不表达。
2008年,学者研究对比了大饥荒阶段生育的子女,与他们兄弟姐妹的Igf2调控区甲基化水平。结果显示,大饥荒阶段生育的子女的甲基化水平,显著低于未经历大饥荒的兄弟姐妹。可以推断,这些子女们的父亲,在大饥荒时期,食物中缺少甲硫氨酸等DNA甲基化的重要甲基来源,精子中Igf2调控区甲基化不足。在大饥荒时期生育子女时,父亲将这一低甲基化状态遗传给了子女。进而,低甲基化状态在子女体内稳定复制和存在。
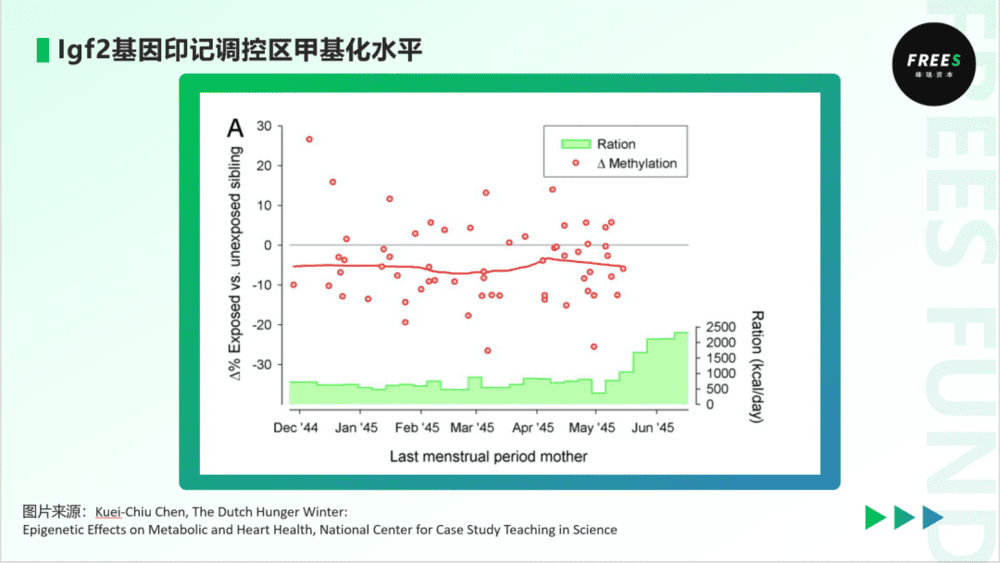
子女印记基因调控区甲基化不足,造成生长因子表达不足,表现为身材矮小(减少能量摄入)、容易发胖(储存更多能量),似乎是在“适应”父辈面临的饥饿环境。这也反映出表观遗传的一个重要功能,那就是增加子代的适应能力,虽然这种能力可能是相邻两代间的。
2. 组蛋白修饰
组蛋白修饰(histone modificaiton),指的是组蛋白尾链上的侧链基团(如氨基)发生翻译后修饰,主要包括甲基化、乙酰化、磷酸化和泛素化等。

组蛋白和DNA之间可被理解为依靠静电吸附连接在一起。组蛋白修饰通过调节组蛋白电荷、削弱核小体与外在蛋白相互作用、招募蛋白形成复合物等方式,在其尾部发生修饰,影响染色体的三维结构,调控基因表达。
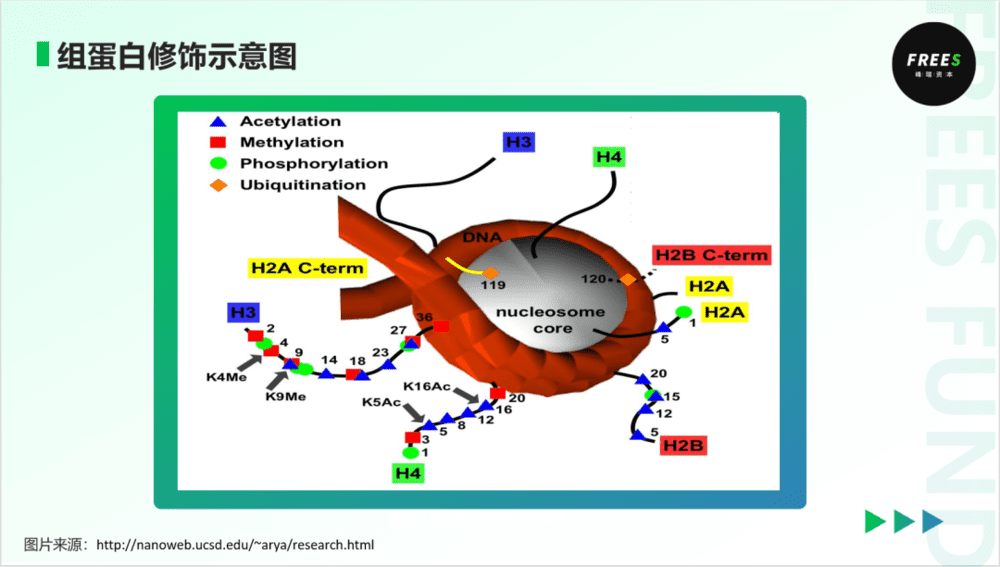
事实上,这些修饰功能除了调控转录,也在DNA复制和修复、维持基因稳定性中扮演重要角色。同时参与表观遗传和DNA修复过程,使得相关的酶一度成为肿瘤药研发的热门靶点。我们会在下文继续讲述在理解肿瘤疾病的过程中,表观遗传调控扮演着什么样的重要角色。
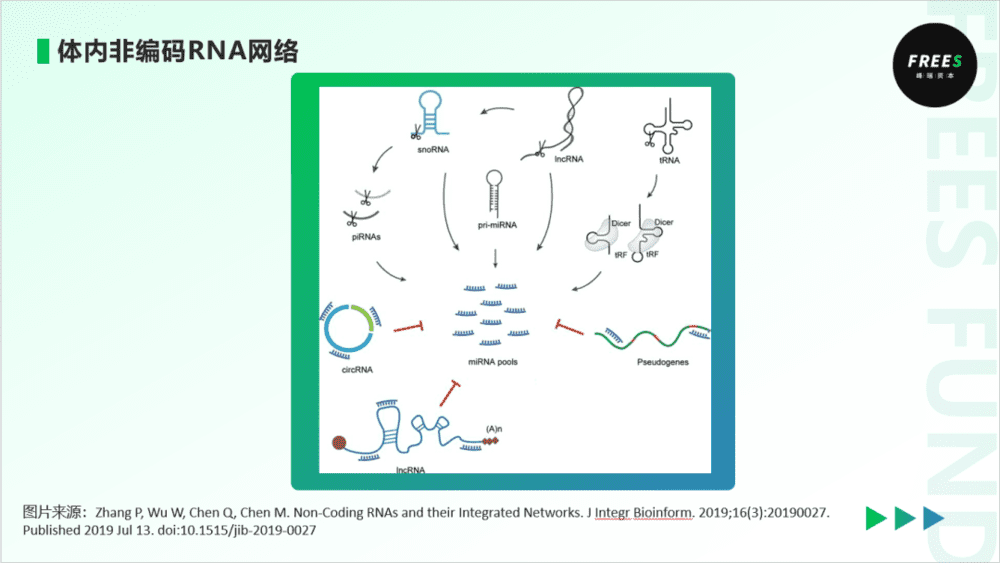
3. 非编码RNA与染色质相互作用
非编码RNA是一类不具有编码功能性蛋白或多肽能力的RNA,在DNA和mRNA两个层次,具有调控基因表达的效果。
与DNA甲基化修饰和组蛋白修饰相比,非编码RNA种类很多,但由于碱基互补配对,使之能识别特定的DNA序列,使得非编码RNA能够进行特异性的调控。同时,不同于DNA甲基化和组蛋白修饰一般针对一个或少数基因位点,非编码RNA不仅能对单个基因进行活性调节,也可以对整个染色体活性进行调节。目前,我们对非编码RNA的研究程度,尚不及DNA甲基化和组蛋白修饰。
非编码RNA一般分为三类:管家非编码RNA,如组装蛋白质中负责搬运氨基酸的tRNA;小RNA,如环状RNA、miRNA等;以及研究相对较少的长非编码RNA。
三花猫的毛色就是由一段名为Xist的长非编码RNA调控造成,Xist也是人类发现的第二个长非编码RNA。这条RNA在女性体内,能通过结合在一条染色体上,反复缠绕,诱导一条X染色体的大部分基因发生转录沉默。这一现象的生理意义在于,男性只含有1条X染色体,而女性含有2条。失活其中一条造成基因转录沉默,能够达到两性之间基因表达剂量平衡。
为什么有的三花猫毛发表达黑色基因,有的表达黄色,而非黑黄混在一起的棕色?因为两条分别编码黑色和黄色基因的X染色体,有一条染色体失活。这种失活是随机的。而三花猫的黑色和黄色毛发看起来是一簇一簇的,这可能是由于X染色体失活发生在发育早期,并且这种失活状态可以稳定遗传。因而,分裂后的细胞仍然维持同一个毛发颜色的表型。
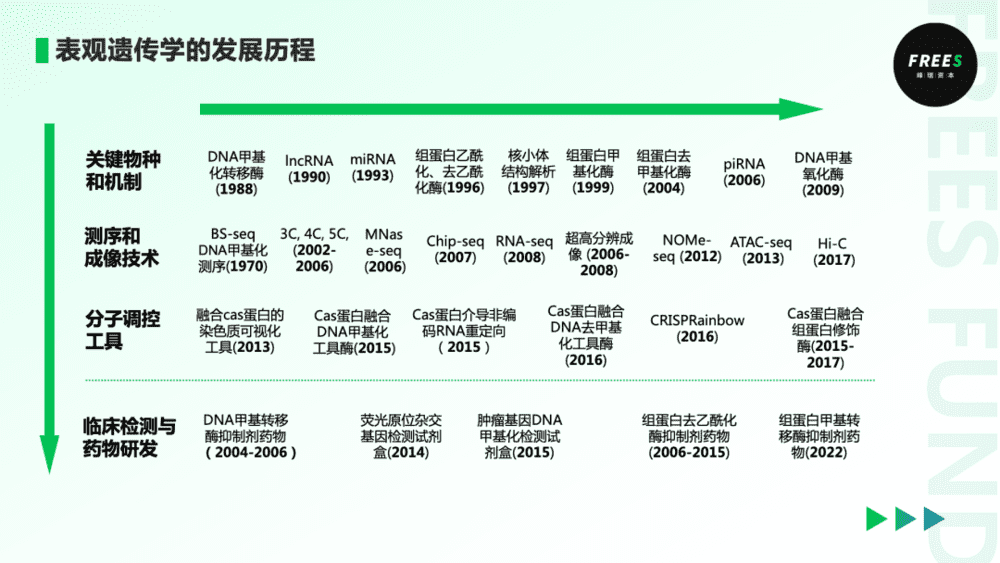
表观遗传学的发展脉络

1942年,生物学家Waddington提出“表观遗传学”的概念。之后,表观遗传学在关键物种和机制、测序和成像技术、分子调控工具、临床检测与药物研发应用等细分方向不断取得进展,经历了从观测、测量,到操控与制造的发展过程。
20世纪末~21世纪初,表观遗传修饰关键物种(如DNA和组蛋白甲基化酶)和机制(如长非编码RNA造成染色体失活)逐渐清晰。人们逐渐关注这些物种和机制在染色质上的作用结果。研究复杂染色质结构、序列、位置的测序和成像技术加速发展。
这些“测量端”的进步,为表观遗传学积累了大量数据。一方面率先转化为临床应用,出现了包括荧光原位杂交基因检测、肿瘤基因DNA甲基化检测等临床诊断产品,以及组蛋白去乙酰化酶抑制剂(如西达本胺)等治疗药物。
另一方面,测量端的进步也推动了表观遗传修饰(DNA甲基化修饰、组蛋白修饰、非编码RNA与染色质相互作用)与细胞表型之间因果关系的研究。比如,在分子水平,Crispr技术成为精确进行表观遗传修饰的有效“操控”工具之一。这些分子调控工具积累的研究数据,有望推动新一代表观遗传学药物和临床检测技术的出现。
总体而言,表观遗传学的发展有两大基础。在需求端,人们对于复杂发育调控规律的探索,对于肿瘤、神经系统疾病、免疫疾病等复杂病种有强烈的诊疗诉求。在技术端,关键物种解析、高通量测序、高分辨影像学、分子工具等不断进展。未来,需求端与技术端将继续推动表观遗传学的发展。
如何研究表观遗传学?
我们在上文提到,DNA修饰、组蛋白修饰和非编码RNA三种主要的分子调控机制,从微观层面影响表观遗传。那么,在中观层面,人们主要通过染色质及其核小体单元,对表观遗传进行观测和操纵。
在表观遗传学领域,研究方法是目前还在不断迭代的热点领域。表观遗传学以染色质为研究对象,解析染色质的方法主要分为两类,一是以显微镜为基础,直接观察染色质的空间结构,二是结合高通量测序,直接或间接确定染色质的序列、修饰和形态。

近十年来,在经典方法基础上,发展了一系列测序手段和显微观测手段,推动了研究的进步。在科研端,呈现三大发展趋势,一是开发更好的分子工具,从原理上提高精确度;二是向单细胞/少细胞、高通量、高信噪比发展;三是成像和测序相结合,同时提供序列和细胞空间定位等多维度信息。比如,我们观察到DNA甲基化测序工具(如BS-seq、DM-seq等)、组蛋白修饰测序工具(如CUT&Tag)、染色质可及性测序工具(如ATAC-see)在不断迭代和普及。
在产业端,我们需要重点关注如何降低成本、解决临床实际问题。比如在IVD领域,基于表观遗传学的应用还相对有限,主要集中在荧光原位杂交基因检测,以及肿瘤基因DNA甲基化检测。
表观遗传学如何为治疗疑难病症提供新视角?
生物生活的环境往往会潜移默化地影响基因的表达,从而改变生物的发育和对环境的适应性,与表观遗传修饰密切相关。同样地,人类也在以一种复杂的方式来感知环境。饮食习惯、慢性疾病、长期吃药、焦虑压力、生活方式和居住区域等都可能会改变我们的个人基因表达。
而在疾病层面,肿瘤(分化障碍疾病)的耐药性问题、免疫系统功能疾病、神经发育和退行性疾病的疾病过程也与这一机制有关。因此,表观遗传学的研究对于相关疾病的诊疗和药物开发具有启发意义。
表观修饰异常引起的疾病可分为两类,一类由基因突变引起,另一类由表观突变引起,而基因没有发生突变。
第一类疾病是表观修饰的功能蛋白和分子构件(如非编码RNA)的编码基因突变,比如肿瘤和发育性疾病。我们在研究此类疾病时,需要多关注突变基因,进行有针对性的药物开发。
肿瘤可以被看作是一种细胞分化障碍性疾病,往往与DNA甲基化、组蛋白乙酰化等表观修饰异常相关。因而,以DNA甲基化/去甲基化酶和组蛋白修饰酶作为靶点开发的药物,理论上有更好的靶向性。同时,在结构上,上述表观遗传修饰靶点相比转录因子,有更强的成药性。因而近几十年来吸引了大量药企开发化学靶向药物。
根据公开数据,截至2023年8月,已有2款针对DNA甲基转移酶的药物、5款针对组蛋白去乙酰化酶的药物、1款针对组蛋白甲基转移酶的药物获批上市。根据FDA(Food and Drug Administration,美国食品药品监督管理局)和中国国家药品监督管理局发布的药物说明书总结,针对组蛋白修饰酶靶点的药物,在非联用给药的注册性临床试验中客观缓解率一般在30%~35%,完全缓解率一般不足10%。以DNA甲基转移酶为靶点的药物,疗效相对更弱一些。
针对表观遗传靶点开发药物的一个主要挑战是,虽然靶点蛋白在表观修饰中的生化机制相对清晰,不过在细胞生物学和疾病生理方面可能存在其它机制,使得药物脱靶作用相对难以避免,药物优化需要建立在进一步生物/生理学研究基础上。
值得一提的是,西达本胺是我国批准上市的首个化学原创新药,主要适应症为外周T细胞淋巴瘤,后扩展至乳腺癌。西达本胺针对的是调控基因表达的关键酶HDAC,能够抑制肿瘤细胞分裂、诱导细胞凋亡,同时能减轻耐药性产生。根据《西达本胺治疗外周T细胞淋巴瘤中国专家共识(2018年版)》发布的临床研究数据,接受西达本胺单药治疗的患者客观缓解率为47%;联合治疗较单药疗效存在优势,研究显示各种西达本胺的联合方案的客观缓解率在60%以上。
第二类是表观突变,一般指发育的重编程过程中,特定基因表观修饰出现异常,而无基因序列突变,比如自身免疫疾病和神经退行性疾病。多数此类疾病致病因素复杂,涉及到年龄、自然环境甚至社会环境等与人体的交互作用等。而表观遗传研究为理解疾病机制、研发新的治疗药物,提供了新的视角。
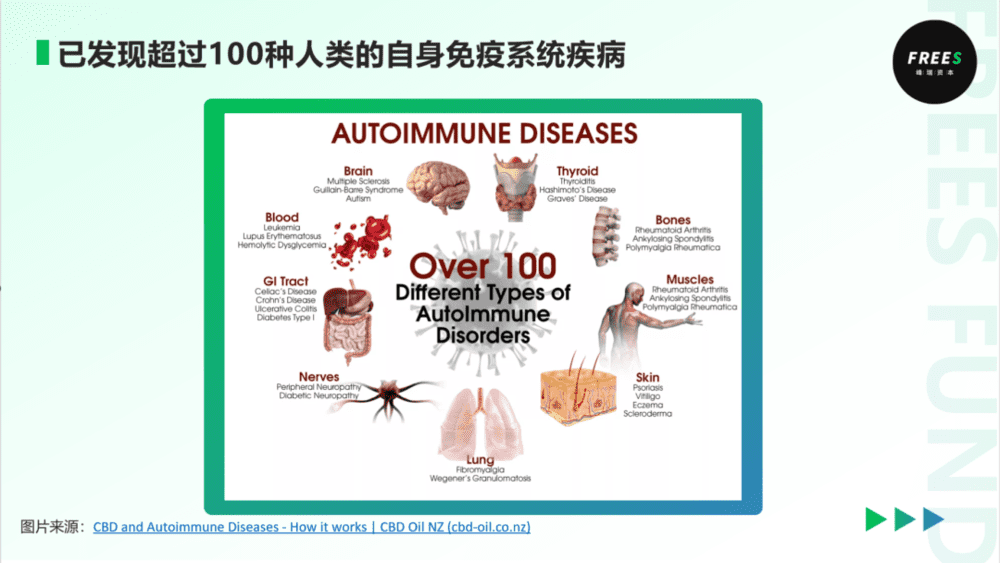
自身免疫疾病源于免疫系统错误地向健康组织发起攻击,造成组织器官损伤。根据Glinda S. Cooper、Milele L.K. Bynum等学者的研究,目前已发现超过100种自身免疫系统疾病,威胁全球超过5亿人的健康。研究表明,环境因素是自免疾病重要致病因素,其中表观遗传修饰DNA甲基化与自免疾病的发生与发展息息相关。
系统性红斑狼疮就是一种典型的自免疾病,主要特征为自身抗体大量产生和炎症损害,影响多个器官和系统。近几十年的研究证据表明,T细胞DNA病理性低甲基化,在疾病进程中发挥关键作用。在动物模型上,通过人工诱导DNA低甲基化,模拟相同的致病机制,可使正常T细胞发生特定免疫相关基因的表达激活,引发相似的症状。
另一种自免疾病银屑病,是一种常见的慢性复发性炎症性皮肤病,特征是肥厚性红色斑块以及银白色鳞屑。研究发现,相比正常人皮肤,患者皮损组织全基因组DNA呈高甲基化。这种高甲基化状态可能导致角质形成细胞的增殖与分化过程发生广泛改变,与患者皮损密切相关。
神经退行性疾病指人脑、脊髓或外周神经系统的神经元,随着时间推移,失去功能、逐渐死亡的一类疾病。阿尔茨海默症(AD)、帕金森症(PD)、肌萎缩侧索硬化症(ALS)等都属于神经退行性疾病。年龄增长是影响神经退行性疾病发生的重要风险因素之一。人在衰老过程中,染色体结构会改变,这种变化是脑功能衰退的重要诱因之一。
随着人口老龄化和平均寿命延长,未来几十年,将会有更多的人受到神经退行疾病影响。阿尔茨海默症(AD)是65岁以上老年人痴呆的主要原因,患者出现学习、记忆等认知障碍。研究表明,阿尔兹海默症的发生与组蛋白修饰异常相关。过世后的AD患者大脑海马区样本显示组蛋白去乙酰化酶(HDAC2)水平上调。用小鼠试验来模拟AD患者病情,也能看到,如果HDAC2水平上调,小鼠海马突触功能受损;相反如果HDAC2水平下调,可增强海马突触密度,从而减轻记忆障碍。
表观遗传领域,会出现下一个“华大基因”吗?
在生物医药领域,基因组学是能够和表观遗传学作比较的学科之一。基因组学领域诞生了Illumina、华大基因等等成功的公司。对比来看,我们相信,表观遗传学也同样有发展潜力。

第一,从复杂性看,基因组学关注DNA序列,表观遗传研究的染色质结构则是更复杂的体系。如果说DNA研究的是一维的排列组合,表观遗传研究的内容既包括一维的修饰,还包括二维的相互作用以及三维的空间结构和细胞内定位。
第二,从思路上,表观遗传关注细胞可塑性。基因组学关注比较稳定的“基因注释”,表观遗传更加突出“动态”和“适应”,更加贴近肿瘤、退行性疾病等疾病的生理特征。未来,表观遗传学或许能够给人们带来更多新的发现。
第三,表观遗传学的检测手段更加丰富。除了测序,表观遗传学还能通过影像学方法,提供更多维度的信息,提高临床应用转化的可能性。
表观遗传学领域,有哪些创业投资机会?
未来,表观遗传学会有怎样的发展前景?
首先,表观遗传修饰提供了细胞的可塑性,即个体对于环境的适应能力和适应速度。从这个意义上,表观遗传学在肿瘤、神经系统疾病、免疫系统疾病等关乎代谢、分化障碍的疾病上会有不错的发展前景。
从整体行业看,表观遗传领域仍处于发展早期。进展基本集中在高校,产业端转化相对较少。应用主要集中在科研测试市场,临床检测内容和方法学有限,药物开发主要建立在相关性关系上。为避免盲人摸象、以偏概全,新的应用转化应从更宏观的角度,理解表观遗传技术和规律对于生物体系的影响。比如,关注整体染色质结构调控(而不是单一基因甲基化状态的改变),关注全部miRNA的丰度调控(而不是单一miRNA的丰度变化)等等。
在科研端,新的测试工具和方法仍将不断涌现,向单细胞、高通量方向发展。这些新方法、新工具可能将显著降低成本。表观遗传学是一种“组”学,但不仅只有一维序列,也包含二维染色体联结频率和三维的空间构象与细胞内定位,在更高、更多的维度上发现规律,可能将成为研究趋势。
在临床侧,表观遗传学与个体适应性密切相关。检测与诊断上,值得关注并探索的方向包括根据表观遗传的测序结果,指导用药或联合用药方案,以及通过表观修饰,进行肿瘤、自免等疾病的早期筛选。
药物研发上,基于表观遗传学靶点开发药物仍然存在机会。目前的挑战在于,我们对靶点关联疾病的特异性的研究相对不足。人们相对清晰地了解了表观修饰的生化作用,但还未充分阐释靶点的细胞学作用和疾病病理。在临床上,我们仍然很难优化既有表观遗传靶点药物的有效性和安全性,很有必要继续探索背后的细胞生物学机制。
目前,我们发现表观遗传学有一些值得探索的方向,比如结合表观遗传调控个体适应性的观点,研究这些靶点在诸如肿瘤耐药性形成中的关键作用,依此设计联用药物,提高肿瘤对于治疗药物的敏感性,延缓耐药形成的时间。再比如,我们或许可以通过联合其它细胞调控元件,提高表观遗传靶点药物特异性,从而助力开发靶向物种间相互作用(如蛋白-蛋白相互作用)的药物。
未来,我们将继续关注表观遗传学在科研和产业端的发展,也将持续探索其它尚在成长中、有较高发展潜力的生命科学细分领域,做正确而非容易的事。
本文作者:谢达(峰瑞资本副总裁,[email protected])

