在动物、细菌或任何生命体尚未出现的数十亿年前,地球上就有RNA了。这些分子可能与氨基酸及其他基础生物分子共舞,在了无生机的行星“熔炉”中分分合合。
然后一种特别的物质不知怎么的就出现了:它是一种由数条RNA组成的简单“机器”,形如口袋,能够将氨基酸逐一排列,且可能具有将这些氨基酸连接成链的能力。这种大分子物质之后逐渐演化成核糖体,即负责将遗传信息翻译成蛋白质的“RNA-蛋白质”复合物。它的诞生(其中细节尚属假设)将在这个原本由RNA主导的“前生物”世界中引发一场根本性改变,为我们所知道的所有生命提供关键成分。
以色列魏茨曼科学研究所的结构生物学家Ada Yonath和她的团队在20年前首次提出了“原始核糖体”这一概念。此前她和其他人共同解析并确认了现代核糖体的结构,这一壮举也使她后来与他人共享2009年诺贝尔化学奖。
但为了验证假设中的原始核糖体确实存在,Yonath和她的实验室同仁必须把它造出来。

插图:Hudson Christie
其他科研人员也在关注这个项目。该实验室在过去两年中所取得的成就,即创造出可以将两个氨基酸相连接的原始RNA机器[1,2],激起了千层浪。而在日本,由东京理科大学的分子生物学家田村浩二领导的另一独立研究组也成功创造出一种相似的、具有功能活性的原始核糖体[3]。“这一研究成果是对Ada所提出的原始核糖体学说的有力支持,”美国克里普斯研究所的生化学家Paul Schimmel说,“我一直对之持开放的态度,而这种开放态度正在逐渐走向确信。”
尽管仍存在对此类研究的质疑和警告,但就从原始有机分子到所有生物的最近共同祖先所使用的核糖体这一发展道路而言,Yonath和田村的研究工作似乎重现了其中一个重要里程碑。这项任务并非易事:在Yonath的研究小组,该研究项目不断从一个研究者传给另一个研究人员,用了超过15年才取得成功。现在这一工作为研究生命起源的科学家们提供了更多细节信息。另有科学家正在以原始核糖体或类似的分子作为工具,来创造出新的生物分子。
“这应该将会成为其他更多研究领域的起点。”近年来领导了Yonath研究组工作的博士后研究员Tanaya Bose说。
来自晶体结构的启示
近几十年来,科学家们一直试图重现生物分子的化学起源。70年前,美国芝加哥大学的化学家Stanley Miller用电流通过气体混合物来生成有机化合物[4]。包括Carl Woese和Francis Crick在内的研究者们认为,核糖体最初可能是一种仅由RNA构成的分子,该想法在40年前得到了“RNA能够催化反应”这一研究证据的支持[5,6]。由此提出了“RNA世界”假说,该假说描绘了在细胞或真正的生命体出现之前,曾存在RNA自我复制并介导催化反应的一段时间[7]。
在过去十年中,有人对“RNA世界”假说提出质疑;许多科学家现在怀疑,包括原始蛋白质、脂质和代谢物在内的多种生物分子当时都可能与核酸同时存在。
Yonath怀疑早期地球上有很多RNA。“它们中的大多数都不复存在,因为它们很小也没什么用。”而她认为原始核糖体持续存在到了最后。
在2000年代初,Yonath及其同事发表了构成核糖体的两个“蛋白质-RNA”亚基的高分辨率结构[8,9],其中核糖体样例取自嗜极细菌。而随着其他生物体的核糖体结构得到发表,Yonath研究小组的一位科学顾问Ilana Agmon注意到了一些惊人之事。
在核糖体大亚基的核心深处存在一个呈半对称结构的片段。该片段区域包含一个由核糖体RNA构成的口袋状结构,被称为肽基转移酶中心(PTC)。在mRNA翻译成蛋白质的过程中,当两个氨基酸被置于PTC中时,它为这两个氨基酸相连创造条件。而且,尽管该结构中核苷酸的具体序列因不同物种而异,但该结构的形状在各样例物种中是相同的,提示该结构对核糖体发挥其支持生命的能力而言至关重要(见“事件的核心”)。
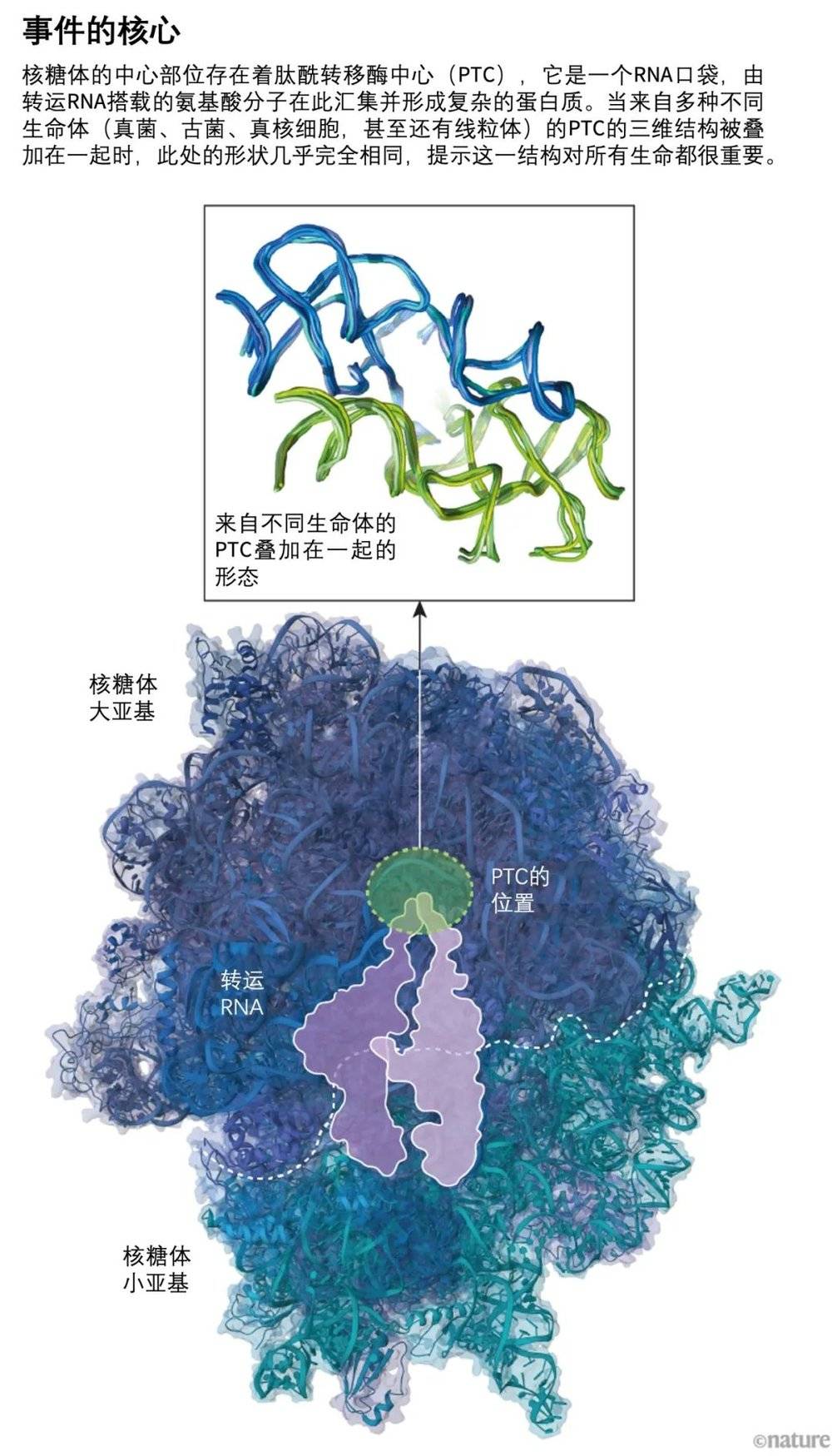
来源:参考文献1 & 3/PDB.
2006年,当Yonath开始和她的团队探讨核糖体的演化问题时,Agmon建议关注那个包含PTC的半对称区域。“我们推测这就是原始核糖体,也是核糖体演化的起始部分。”从一开始就参与该项目的高级科学家Anat Bashan回忆道。但是他们推测中可能是原始核糖体的那片区域共由178个核糖核苷酸组成,而Yonath指出这个结构过于巨大,以至于在原始地球上难以完整现身。
部分基于她所观察到的结构对称性,她提出了一个原始核糖体的分子模型,由两条相近的L形RNA组成,分别长60和61个核苷酸。研究小组认为早期地球上能出现这样大小的分子更为合理。
那样的分子片段大小确实可靠些。美国应用分子演化基金会的生化学家Elisa Biondi和她的同事成功在称为岩石玻璃的材料上合成了长度为约100~300个碱基的RNA,这种材料可以在前生物世界中通过火山活动或流星撞击形成[10]。
但并非所有人都相信Yonath和Agmon研究中的短片段RNA是自发生成的。法国斯特拉斯堡大学的有机化学家Joseph Moran赞扬了Yonath的成就,但质疑原始核糖体是否就这么突然出现了。“它肯定是从更简单的东西中生成的。”他说。
密歇根州立大学的生物学家Robert Root-Bernstein认为,这些更简单的东西可能是转运RNA(tRNA)。在现代核糖体中,氨基酸进入PTC,连着配对mRNA上的三字母代码的tTNA。这些代码决定了蛋白质中氨基酸的连接顺序。
在Root-Bernstein等人来看,PTC的核心看起来很像四个连在一起的tRNA。他指出,tRNA不仅能将氨基酸运送到核糖体中,它们还能作为多功能分子来执行多种任务,例如感知营养物质和沉默基因表达。也许它们在原始核糖体出现之前具有某种功能,而后为原始核糖体的结构提供构建模块。
非凡的证据
无论假设中的原始核糖体是如何形成的,在Agmon和Yonath首次构思这一概念时,尚无任何实验证据表明它可能存在、并像他们想的那样发挥功能。原始核糖体假说中假定了其中一种早期RNA口袋可以将氨基酸连接在一起,然后这种RNA便演化成了具有相同功能的核糖体。
与Nature交谈的科学家们表示这个想法挺不错,但未必成真。“这说得通。”美国佐治亚理工学院的演化生物学家Anton Petrov说,但他也认为早期的RNA机器可能具有不同于肽链合成的其他功能,然后随着原始核糖体的出现,它们承担了这个角色。
“这是Yonath的一个非常大胆且富有想象力的想法。”英国医学研究委员会分子生物学实验室的化学家John Sutherland说。
大胆的理论需要非凡的证据,而这也是实验室下一步要着手获得的东西。在提出原始核糖体假说后,Agmon去了以色列理工学院。由博士生Chen Davidovich率先开展相关实验。Yonath说,实验的第一步是制作用于构建这种理论中的原始核糖体的分子。
Davidovich研究了各种现代核糖体的RNA序列。核糖体作为一种大分子,其中含有几十种核糖核苷酸和辅助蛋白,但并非都与PTC的形状或功能相关。他尽可能剥除了那些看似与原始核糖体无关的东西,只留下足以构成那个半对称的口袋的RNA[2]。其中一些RNA能够成对构成一些东西,类似于Agmon想象中的PTC核心。
“这花了很长时间”,Yonath回忆道。但下一步耗时更久。第二步是证明这些假定的原始核糖体可以拿两个氨基酸连接到一起。
Davidovich试图展现PTC的活性,采用的方式就是别的研究者用于检测现代核糖体将两个氨基酸类似物连接成二肽的能力的方法。他用放射性元素标记了这样的类似物,它们与一些代表tRNA的核苷酸相连。在把它们与原始核糖体混合后,他认为他能够按分子大小对分子进行排序,从中找到分子较长、并具有放射性标记的二肽。但他一直未能找到此类二肽存在的迹象。“这几乎断送了我的职业生涯”,Davidovich回忆道。
幸运的是,他还有一个备用课题,与Yonath实验室的另一个研究兴趣相关,即研究攻击核糖体的抗生素。他于2010年毕业,目前在澳大利亚莫纳什大学领导一个研究基因表达抑制的实验室。
接下来是博士生Miri Krupkin,她被PTC的对称性及其快速构建蛋白质的能力(快于任何人类化学家所设计的分子)所吸引。利用Davidovich构建的PTC分子和Krupkin自己设计的分子处理氨基酸类似物后,她也试图根据分子大小来检测放射性二肽产物,还尝试用荧光而非放射性元素来对底物进行标记。但还是什么也没有。
Krupkin开始怀疑原始核糖体在刚出现时究竟有没有产生过肽。她测试了其他可能的化学物质,如加入或去除来自其他分子的磷酸基团,但仍然以失败告终。
“我继续探索着,因为这个问题太有趣了。”Krupkin说。但与Davidovich类似,她也不得不依靠另一个课题(也与抗生素相关)才得以在2016年毕业。她目前在美国斯坦福大学担任博士后研究员,从事HIV的RNA结构方面的研究。
直到2016年, Bose加入了这个实验室做博士后,终于完成了这个课题。Bose受过化学训练,这给了她一个看待此课题的全新视角。她意识到,如果处在原始版本的原始核糖体真能有用,它也可能效率极低,仅能产生极微量的二肽。Bose没有按分子大小分离反应产物,而是改用质谱法进行检测,当时这是最为灵敏的检测方法。实验仍然很难:她做了许多化学反应和对照实验,还试了两种质谱检测方法。最终她看到了一个代表预想中二肽的信号峰[1,2]。
“产物的数量很少”,Bose 说。她怀疑Davidovich和Krupkin当时可能一直有把产物制造出来,但量太小了,他们的方法不足以检测出来。
即使是如此小的产量也算得上是“一定程度上的壮举”,Sutherland说。“他们在一个非常困难的问题上取得了进展。”
后续步骤
当Krupkin在尝试检测二肽产物时,Yonath小组并非唯一一个探寻合成肽键最小机器的研究小组。日本的田村浩二同样也受到了半对称核心口袋的启发。他组建了一个研究小组来制作他们自己的原始核糖体样结构,包括硕士生川端舞和本科生川岛健太郎。
他们的PTC复制品由两条74个核苷酸的RNA构成,与Yonath所合成的分子相似,但为了模拟现代tRNA,他们使用了名为小螺旋(minihelice)的结构。这种分子结构在大小上约为现代tRNA的一半,也因此比Yonath所使用的tRNA替代品大得多。现代tRNA目前被认为是从小螺旋演化而来的。
Tamura的团队最终取得了属于他们自己的成功,他们也用了质谱来检测二肽[3]。“舞和健太郎都耐心又聪敏,最终我们满载而归。”田村说。
之前担任田村浩二博士后顾问的Schimmel说,小螺旋是一个关键性补充。“可以说,他把它提升到了新的高度,因为他构建出了被许多演化生物学家认为是原始tRNA的东西。”Schimmel说。他指出,一些科学家甚至猜测这些小螺旋演化出了自我复制的能力,这是迈向生物体的另一个关键步骤。
田村提醒说,两个实验室所构建的分子在工作方式上与现代PTC都不完全相同。“我们的结果都过于简单”,他说,“在我们真正理解PTC和核糖体的演化过程之前,还有很长的路要走。”
对于Bashan来说,现有结果已经足够接近了。“我们认为这就是最初的蛋白质就是这么来的。”她说。
但正如其他科学家所指出的,多肽出现于早期地球之上可能还有其他方式。将氨基酸连在一起是“非常容易”的事情,Sutherland说。
例如一些科学家提出,在早期地球环境的冰冷潮湿和炎热干燥的循环交替中,氨基酸再加上α-羟基酸(包括乳酸和柠檬酸的一类分子)可能形成多肽,这一过程不需要RNA的参与[11]。此外,去年另一团队利用一些RNA碱基(尽管不是现代RNA编码中所使用的A、C、G和U碱基)组装出了肽链。研究人员提出,这有可能在没有核糖体参与的情况下就发生于RNA世界中[12]。Sutherland说:“这种合成方式与自然界现在利用RNA来制造肽链的方式完全不同。”
Sutherland和Yonath说,就原始核糖体方面的研究工作而言,其特殊之处在于这些工作为我们可对核糖体演化过程的构想创造了可能,即核糖体的原始核心在数千年中如何积累额外的RNA和蛋白质以创造出现代核糖体。
Petrov和他的同事们通过从现代核糖体开始往回逆推的方式,准确预测出了这样的时间线。他们分析的是核糖体在原子级别的“指纹”:在新的RNA分支结构被添加进核糖体时,这些“指纹”会被遗留在核糖体三维结构中[13]。这样得到的核糖体的演化模型表明,在其结构符合Yonath的原始核糖体,且随着时间的推移会有额外的RNA片段慢慢被加入其中(见“分子的演化”)。
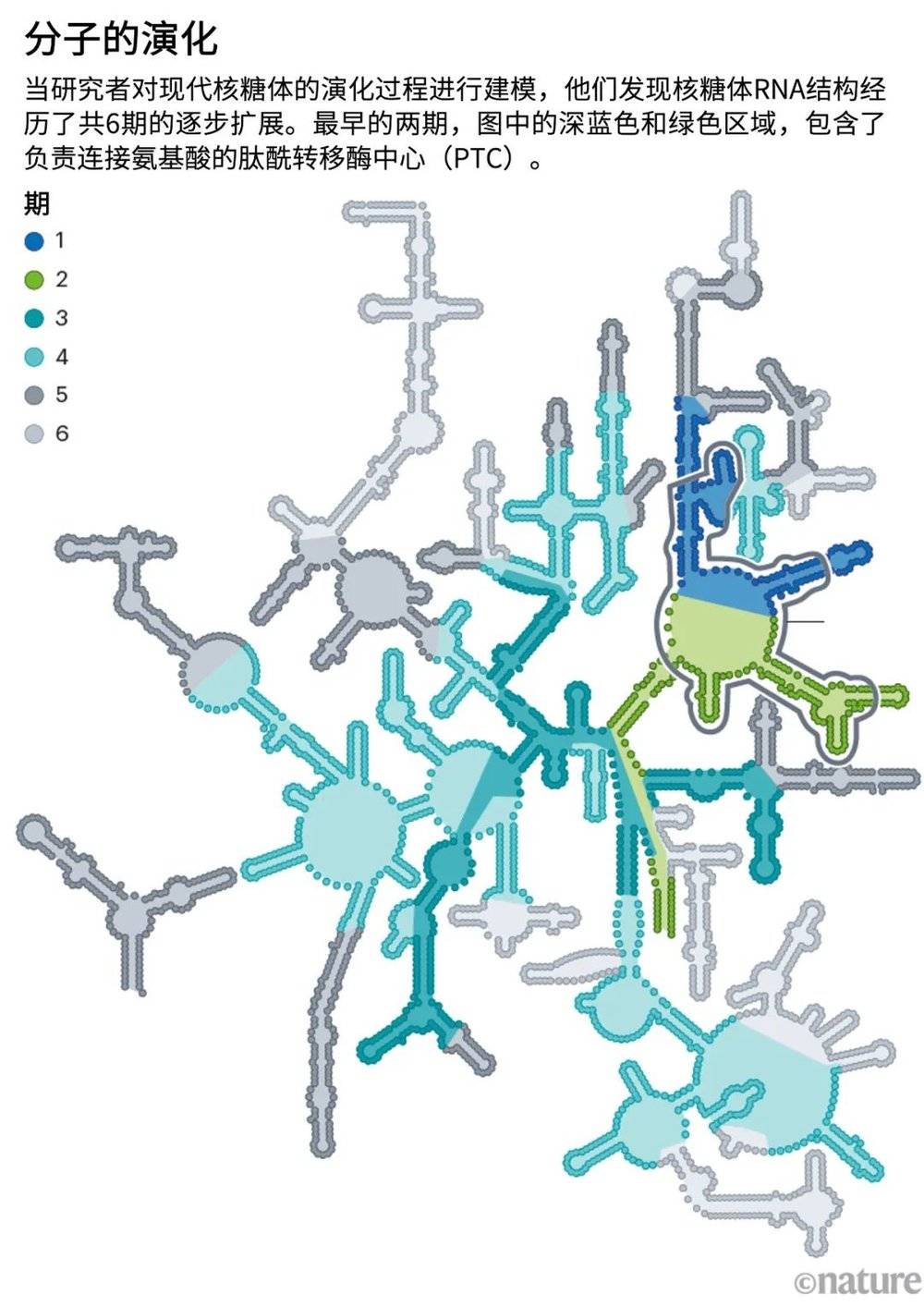
来源:参考文献13
Yonath团队所要做的下一步,便是尝试制造出多种多样的长度大于两个氨基酸的肽。Bose正在从事这方面的研究,但这将需要异于之前实验的反应起始原材料。
目前有一个研究小组宣称已从原始核糖体样结构中合成了更长的肽链。美国休斯顿大学的生物物理学家Yuhong Wang及其同事报告了他们的质谱实验,其结果表明他们利用尺寸更大的PTC生成了由九个赖氨酸组成的肽链[14]。Wang认为可能其实还生成了其他长度的赖氨酸聚合物。“我认为我们的证据很有力。”她说。但她承认实验的对照不够完整,而且也无法解释为什么长达九个氨基酸的肽链会是最显著的反应产物。
Wang等人对利用这种被剥离出来的核糖体来制造可用于医学或工业的新型生物分子很感兴趣,不限于20种常见氨基酸,甚至可以不限于氨基酸。比如他们可能会利用右旋的氨基酸来构建分子,不同于地球生物中存在的左旋氨基酸。Wang认为这种大分子合成方法可能比其他方法更为廉价与环保。
与此同时,还有很多生命起源方面的研究工作有待开展。科学家们需要弄清楚RNA是如何获得自我复制的能力的。他们还需要探寻早期核糖体如何根据原始mRNA编码来制造出特定肽段。这些生物学过程,以及核糖体合成肽的能力,可能为演化提供原材料。
Sutherland说,还有一个因素:原始核糖体所制造的早期肽一定具有某种用处,否则这种分子机器的持续存在就不具备演化上的优势了。他提出了几个推断的功能:也许它制造的这些肽能够螯合某些金属离子,不然这些金属离子可能会破坏RNA。或者这些肽可能帮助形成早期的生物分子区室,以将RNA和肽聚集在一起。
“当你得到了演化可以作用其上的东西时”,Sutherland说,“剩下的就是历史了。”
参考文献
1. Bose, T., Fridkin, G., Bashan, A. & Yonath, A. Israel J. Chem. 61, 863–872 (2021).
2. Bose, T. et al. Nucleic Acids Res. 50, 1815–1828 (2022).
3. Kawabata, M. et al. Life 12, 573 (2022).
4. Miller, S. L. Science 117, 528–529 (1953).
5. Kruger, K. et al. Cell 31, 147–157 (1982).
6. Guerrier-Takada, C., Gardiner, K., Marsh, T., Pace, N. & Altman, S. Cell 35, 849–857 (1983).
7. Gilbert, W. Nature 319, 618 (1986).
8. Schluenzen, F. et al. Cell 102, 615–623 (2000).
9. Harms, J. et al. Cell 107, 679–688 (2001).
10. Jerome, C. A., Kim, H.-J., Mojzsis, S. J., Benner, S. A. & Biondi, E. Astrobiology 22, 629–636 (2022).
11. Forsythe, J. G. et al. Angew. Chem. Int. Edn Engl. 54, 9871–9875 (2015).
12. Müller, F. et al. Nature 605, 279–284 (2022).
13. Petrov, A. S. et al. Proc. Natl Acad. Sci. USA 111,10251–10256 (2014).
14. Xu, D. & Wang, Y. Biochem. Biophys. Res. Commun. 544, 81–85 (2021).
原文以How did life begin? One key ingredient is coming into view标题发表在2023年2月28日《自然》的新闻特写版块上,© nature,doi: 10.1038/d41586-023-00574-4
本文来自微信公众号:Nature Portfolio (ID:nature-portfolio),作者:Amber Dance

