本文来自微信公众号:Nature Portfolio (ID:nature-portfolio),作者:Michael Eisenstein,原文标题:《2023 年值得关注的七项技术 |〈自然〉长文》,题图来自:视觉中国
《自然》选出将在未来一年对科学产生巨大影响的工具和技术。从蛋白质测序到电子显微镜,从考古学到天文学,本文将讲述七项有可能会在未来一年震动科学界的技术。
单分子蛋白质测序
蛋白质组体现了细胞或生物体制造的一整套蛋白质,可以提供关于健康和疾病的深入信息,但对蛋白质组的表征仍然是一项挑战性的工作。
相对于核酸来说,蛋白质是由更多的分子砌块(building blocks)组成的,约有20种天然存在的氨基酸(相比之下,组成DNA和信使RNA等分子的只有4种核苷酸);因此,蛋白质具有更大的化学多样性。有些蛋白质在细胞中的含量较少;并且与核酸不同,蛋白质不能被扩增——这意味着蛋白质分析方法必须使用任何能用的材料。
大多数蛋白质组学分析使用质谱法,这是一种根据蛋白质的质量和电荷来分析蛋白质混合物的技术。这些谱图可以同时量化数千种蛋白质,但检测到的分子并不总能明确识别,并且混合物中的低丰度蛋白质常常被忽视。现在,能对样本中的许多(甚至全部)蛋白质进行测序的单分子技术可能即将问世,其中许多技术类似于用于DNA的技术。
德克萨斯大学奥斯汀分校的生物化学家Edward Marcotte正在研究一种这样的技术,称为荧光测序(fluorosequencing)[1]。Marcotte的技术报道于2018年,该技术基于一种逐步的化学过程,在此过程中,单个氨基酸被荧光标记,然后从表面偶联蛋白的末端逐个被剪切下来,此时摄像机会捕捉到所产生的荧光信号。Marcotte解释道:“我们可以用不同的荧光染料标记蛋白质,然后在切割时逐个分子地观察。”去年,位于康涅狄格州的生物技术公司Quantum Si的研究人员描述了一种荧光测序的替代方法,该方法使用荧光标记的“粘合剂”蛋白来识别蛋白质末端的特定氨基酸(或多肽)序列[2]。
其他研究人员正在开发模仿基于纳米孔的DNA测序技术,根据多肽通过微小通道时引起的电流变化来分析多肽。荷兰代尔夫特理工大学的生物物理学家Cees Dekker及其同事于2021年展示了这样一种方法,他们利用蛋白质制成纳米孔,并能够区分通过纳米孔的多肽中的单个氨基酸[3]。在以色列理工学院,生物医学工程师Amit Meller的团队正在研究由硅基材料制成的固态纳米孔器件,该器件可以同时对许多不同的蛋白质分子进行高通量分析。他说:“你可能可以同时观察数万甚至数百万个纳米孔。”
尽管目前单分子蛋白质测序只是概念上的验证,但其商业化正在迅速推进。例如,Quantum Si公司已宣布计划今年推出第一代仪器,并且Meller指出,2022年11月在代尔夫特举行的蛋白质测序会议上有一个专门针对该领域初创企业的讨论组。他说:“这让我想起了第二代DNA测序技术面世前的那些日子。”
Marcotte是德克萨斯州奥斯汀市蛋白质测序公司Erisyon的联合创始人,他对此持乐观态度。他说:“这已经不是个行不行的问题,而是这项技术几时能送到人们手上。”
詹姆斯·韦布太空望远镜
天文学家们从去年开始就翘首以盼,兴奋不已。经过20多年的精心设计和建造,美国国家航空航天局(NASA)与欧洲航天局和加拿大航天局合作,于2021年12月25日成功将詹姆斯·韦布太空望远镜(James Webb Space Telescope,缩写JWST)送入轨道。因为仪器设备需要展开并确定第一轮观测的位置,全世界不得不等待了近七个月,JWST才开始正常工作。
等待是值得的。马里兰州巴尔的摩市太空望远镜科学研究所天文学家、JWST的望远镜科学家Matt Mountain表示,最初传来的图像超出了他的最高预期。“实际上天空并不空旷,到处都是星系。”他说,“理论上我们知道这一点,但真正看到这一景象带来了别样的情感冲击。”

JWST的设计是为了接替哈勃太空望远镜的工作。哈勃望远镜可以看到令人惊叹的宇宙景象,但也有盲点:它基本上无法看见在红外范围内具有光信号的古老恒星和星系。要弥补这一点,需要一台高灵敏度的仪器,其灵敏度要能够探测到数十亿光年外发出的极为微弱的红外信号。
JWST的最终设计包括18个完全光滑的铍质镜片阵列,当其完全展开时,直径为6.5米。Mountain说,这些反射镜的设计非常精密,“要是把一块镜面等比放大到美国那么大,上面的隆起也不超过几英寸(高)。”这些反射镜配有最先进的近红外和中红外探测器。
这一设计使JWST能够填补哈勃望远镜的空白,包括捕获来自一个有135亿年历史的星系发出的信号,该星系产生了宇宙中最早的一些氧和氖原子。JWST也带来了一些惊喜,例如,它能够测量某些类型的系外行星的大气组成。
世界各地的研究人员都在排队等待观察时间。英国卡迪夫大学的天体物理学家Mikako Matsuura正在用JWST进行两项研究,调查宇宙尘埃的产生和破坏,这些尘埃可能会导致恒星和行星的形成。Matsuura说,与她所在小组过去使用的望远镜相比,“JWST拥有完全不同的灵敏度和清晰度等级”。她说:“我们看到了这些天体内部正在发生的完全不同的现象——这真令人叹为观止。”
体积电子显微镜
电子显微镜(Electron microscopy,EM)以其卓越的分辨率而闻名,但观察的主要是样本的表面。深入研究样本的内部需要将样本切成非常薄的切片,这对于生物学家来说往往不够。伦敦弗朗西斯·克里克研究所(Francis Crick Institute)的电子显微镜学家Lucy Collinson解释说,仅覆盖单个细胞的体积就需要200个切片。她说:“如果你只有一个切片,你就是在玩统计把戏。”
现在,研究人员正在将EM的分辨率应用于包含多个立方毫米体积的3D组织样本上。
此前,从2D的EM图像重建这样体积的样本(例如,绘制大脑的神经连接图)需要经历艰苦的样本准备、成像和计算过程,才能将这些图像转换为多图像堆叠。现在,最新的“体积电子显微镜”技术大大简化了这一过程。
这些技术有各种优点和局限性。连续切面成像(Serial block-face imaging)是一种相对快速的方法,它使用金刚石刀片在树脂包埋样品上切下一系列薄片,并进行成像,可以处理约1立方毫米大小的样品。然而,它的深度分辨率较差,这意味着生成的体积重建将相对模糊。聚焦离子束扫描电子显微镜(Focused ion beam scanning electron microscopy,FIB-SEM)能制备更薄的薄片样品,因此深度分辨率更高,但更适用于体积较小的样品。
Collinson将体积电子显微镜的兴起描述为一场“安静的革命”,因为研究人员专注于用这种方法得到的结果,而不是生成这些结果的技术。但这正在改变。例如,2021年,弗吉尼亚州珍利亚研究园区(Janelia Research Campus)从事电子显微镜中细胞器分割(Cell Organelle Segmentation in Electron Microscopy,COSEM)计划的研究人员在《自然》上发表了两篇论文,聚焦了在绘制细胞内部结构方面取得的重大进展[4,5]。“这是一个绝佳的原理论证。”Collinson说。
COSEM研究计划使用精密的定制FIB-SEM显微镜,在保持良好空间分辨率的同时,可将单个实验中可成像的体积增加约200倍。将这些仪器与深度学习算法结合使用,该团队能够在各种细胞类型的完整3D体积中定义各种细胞器和其他亚细胞结构。
这种样品制备方法费力且难以掌握,并且由此产生的数据集非常庞大。但这一努力是值得的:Collinson已经看到了该技术在传染病研究和癌症生物学方面产生的见解。她现在正在与同事们合作,探索以高分辨率重建整个小鼠大脑的可行性。她预计这项工作将需要十多年的时间,花费数十亿美元,并产生5亿GB左右的数据。她说:“这可能与绘制第一个人类基因组工作的数据量在一个数量级。”
CRISPR无限可能
基因组编辑工具CRISPR–Cas9作为在整个基因组的目标位点引入特定变化的首选方法,在基因治疗、疾病建模和其他研究领域取得了突破,无可非议地享有盛誉。但它的用途多受限制。现在,研究人员正在寻找规避这些限制的方法。
CRISPR编辑由短链向导RNA(short guide RNA,sgRNA)协调,sgRNA将相关的Cas核酸酶导向其目标基因组序列。但这种酶发挥作用还需要在靶点附近有一种叫做原间隔序列邻近基序(protospacer adjacent motif,PAM)的序列;如果没有PAM,基因编辑很可能会失败。
在波士顿的马萨诸塞州总医院,基因组工程师Benjamin Kleinstover利用蛋白质工程技术,从化脓性链球菌中制造出常用Cas9酶的“近乎不受PAM序列限制的(near-PAMless)”Cas变体。一个Cas变体需要由三个连续核苷酸碱基组成的PAM,其中腺嘌呤(A)或鸟嘌呤(G)核苷酸位于中间位置[6]。“这些酶现在几乎可以读取整个基因组,而传统的CRISPR酶只读取1%到10%的基因组。”Kleinstover说。
这种对PAM序列不太严格的要求,增加了编辑“脱靶”的机会,但进一步的蛋白质工程设计可以提高其特异性。作为一种替代方法,Kleinstiver的团队正在设计和测试大量Cas9变体,每个变体对不同的PAM序列表现出高度的特异性。
还有许多天然存在的Cas变体有待发现。自然条件下,CRISPR–Cas9系统是一种针对病毒感染的细菌防御机制,不同的微生物进化出了具有不同PAM序列偏好的各种酶。意大利特伦托大学的病毒学家Anna Cereseto和微生物组研究人员Nicola Segata梳理了100多万个微生物基因组,鉴定和表征了一组多样的Cas9变体,他们估计这些变体可能总共可以针对98%以上的已知人类致病突变[7]。
然而,其中只有少数能在哺乳动物细胞中发挥作用。Cereseto说:“我们的想法是测试许多种酶,看看是什么决定因素使这些酶正常工作。”从这些天然酶库和高通量蛋白质工程工作中获得的见解来看,Kleinstiver说,“我认为我们最终会有一个相当完整的编辑工具箱,能让我们编辑任何我们想要的碱基。”
高精度放射性碳测年
去年,考古学家利用放射性碳测年技术的进步,对维京探险家首次抵达美洲的确切年份——甚至是季节——进行了研究。荷兰格罗宁根大学的同位素分析专家Michael Dee和他的博士后Margot Kuitems带领的一个团队在加拿大纽芬兰岛北岸的一个聚落中发现了一些被砍伐的木材,通过对这些木材的研究,确定这棵树很可能在1021年被砍伐,而且可能是在春天[8]。
自20世纪40年代以来,科学家一直在利用有机人工制品的放射性碳测年法来缩小历史事件发生的时间范围。他们通过测量同位素碳-14的痕迹来做到这一点,碳-14是宇宙射线与地球大气相互作用的结果,在数千年中缓慢衰变。但这种技术的精确度通常仅为几十年左右。

加拿大纽芬兰省兰塞奥兹牧草地(L'Anse aux Meadows)木材的精确放射性碳年代测定显示,维京人于1021年在此地砍倒了一棵树。图片来源:All Canada Photos/Alamy
2012年,情况发生了变化,日本名古屋大学物理学家三宅芙沙(Fusa Miyake)领导的研究小组发现[9],公元774到775年之间,日本雪松年轮中碳-14含量显著升高。随后的研究[10]不仅证实了这一时期世界各地的木材样本中都存在这种碳-14含量的显著升高,而且还发现历史上存在至少五次这样的碳-14含量上升,最早的一次可以追溯到公元前7176年。有研究人员将这些碳-14峰值与太阳风暴活动联系起来,但这一假设仍在探索中。
无论其原因是什么,这些“三宅事件”的存在,能让研究人员通过检测一个特定的三宅事件,然后对此后形成的年轮进行计数,从而准确地确定木制文物的制造年份。Kuitems说,研究人员甚至可以根据最外圈年轮的厚度来确定树木被砍伐的季节。
考古学家现在正在将这种方法应用于新石器时代聚落和火山爆发遗址的研究,Dee希望用它来研究中美洲的玛雅帝国。在接下来的十年左右,Dee乐观地认为,“我们将对这些古老文明中的许多历史事件有真正精确到年代的完全记录,我们将能够以相当精细的时间尺度谈论这些历史发展。”
至于三宅,则还在继续寻找历史中的时间标尺。她说:“我们现在正在寻找过去一万年中,与公元774到775年的事件相当的其他碳-14升高。”
单细胞代谢组学
代谢组学是研究驱动细胞的脂质、碳水化合物和其他小分子的科学,它最初是一套表征细胞或组织中代谢产物的方法,但现在正在转向单细胞水平。科学家们可以利用这些细胞水平的数据,理清大量看似相同的细胞的功能复杂性。但这一转变带来了艰巨的挑战。
代谢组包含大量具有不同化学性质的分子。欧洲分子生物学实验室的代谢组学研究人员Theodore Alexandrov说,其中一些分子存在的时间非常短暂,代谢周转率为亚秒级别。它们可能很难检测:尽管单细胞RNA测序可以捕获细胞或生物体中产生的近一半的RNA分子(转录组),但大多数代谢分析仅涵盖细胞代谢产物的一小部分。这些缺失的信息里可能包含了重要的生物学奥秘。
“代谢组实际上是细胞的活性部分。”伊利诺伊大学厄巴纳-香槟分校的分析化学家Jonathan Sweedler说,“在疾病状态下,如果你想知道细胞状态,你真的要研究代谢产物。”
许多代谢组学实验室使用分离的细胞,这些细胞被捕获在毛细管中,使用质谱法单独分析。相比之下,“成像质谱”方法获取了样本中不同位置的细胞代谢产物发生变化的空间信息。例如,研究人员可以使用一种称为基质辅助激光解吸/电离(MALDI)的技术,其中激光束扫过经特殊处理的组织切片,释放出代谢产物,用于随后的质谱分析。这种方法也能捕获样本中代谢物来源的空间坐标。
Sweedler说,理论上,这两种方法都可以量化数千个细胞中的数百种化合物,但要实现这一目标通常需要顶级的定制硬件设备,成本在百万美元左右。
现在,研究人员正在普及这项技术。2021年,Alexandrov团队报道了SpaceM,这是一种开源软件工具,它能用光学显微镜成像数据,使用标准商用质谱仪对培养的细胞进行空间代谢组学分析[11]。他说:“我们算是做了数据分析部分的体力活。”
Alexandrov的团队使用SpaceM对数以万计人和小鼠细胞中的数百种代谢产物进行了分析,并转向标准的单细胞转录组学方法将这些细胞分类。Alexandrov表示,他尤为热情的是后一项工作,以及构建“代谢组学图谱”的想法——类似于为转录组学开发的图谱,以加速该领域的进展。他说:“这绝对是一个前沿领域,并将对科学起到巨大的推动作用。”
体外胚胎模型
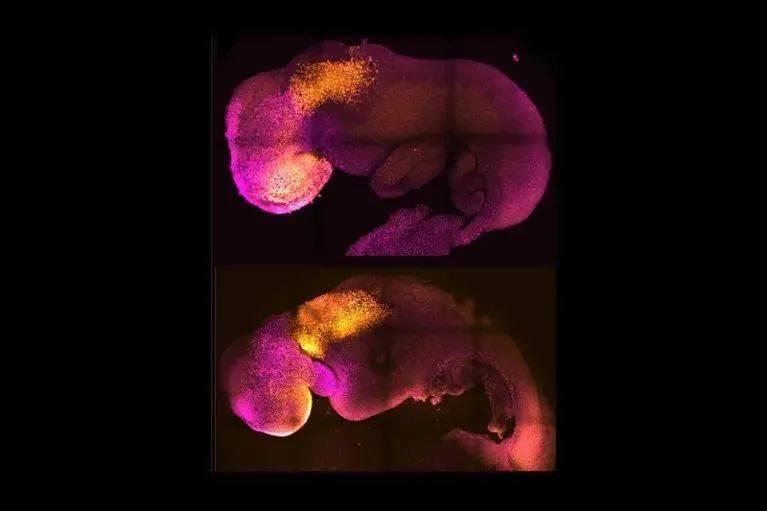
科学家们已经在小鼠和人类的细胞水平上,详细描绘了从受精卵到完全形成的胚胎这一过程。但驱动这一过程早期阶段的分子机制仍不清楚。现在,“胚状体”模型的一系列活动有助于填补这些知识空白,让研究人员更清楚地了解可以决定胎儿发育成败的重要早期事件。
该领域一些最精细的模型,来自加州理工学院和英国剑桥大学的发育生物学家Magdalena Zernicka Goetz的实验室。2022年,她和她的团队证明,他们可以完全从胚胎干细胞(embryonic stem cells,ES细胞)中产生植入期的小鼠胚胎[12,13]。
与所有多能干细胞一样,ES细胞可以形成任何细胞或组织类型,但它们需要与两种类型的胚外细胞密切相互作用才能完成正常的胚胎发育。Zernicka-Goetz团队研究出了诱导ES细胞形成这些胚外细胞的方法,并表明这些细胞可以与ES细胞共培养,以产生胚胎模型,该模型的成熟度是以前的体外实验无法达到的。“它就如你能想象的胚胎模型那样。”Zernicka Goetz说,“我们的胚胎模型发育出一个头部和心脏——而且还在跳动。”她的团队能够利用这个模型来揭示个别基因的改变如何破坏正常的胚胎发育。
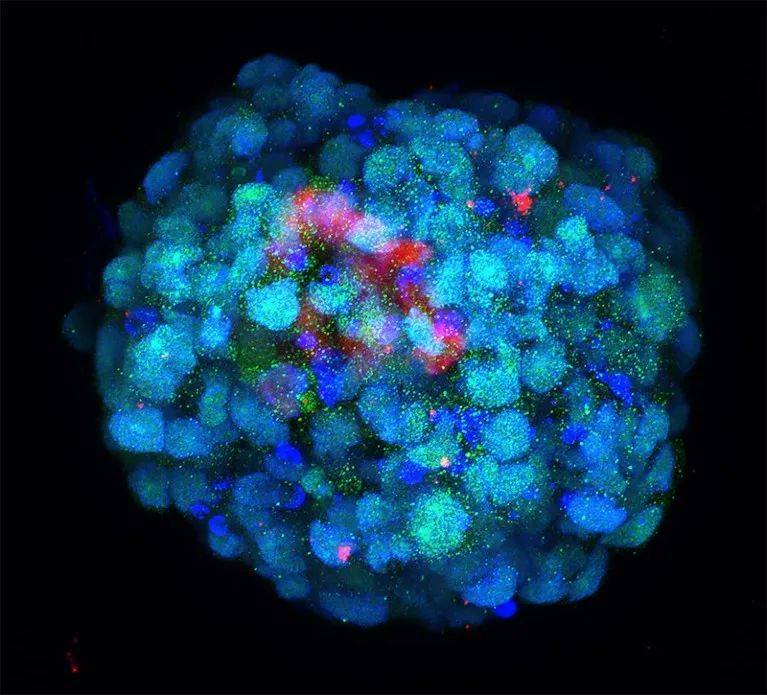
在中国科学院广州生物医药与健康研究院,干细胞生物学家Miguel Esteban和同事们正在采取一种不同的策略:重新编程人类干细胞,以模拟最早的发育阶段。
Esteban说:“我们最初的想法是,实际上甚至制造合子也是可能的。”该团队没能完全实现这一点,但他们的确发现了一种培养策略,能使这些干细胞回到类似于8细胞期人类胚胎的状态[14]。这是一个至关重要的发育期里程碑,与基因表达的巨大变化相关,最终产生不同的胚胎细胞和胚外细胞谱系。
尽管还不完美,但Esteban的模型展示了自然状态下8细胞期胚胎中细胞的关键特征,并凸显了人类和小鼠胚胎如何启动向8细胞期阶段转变之间的重要差异。Esteban说:“我们发现,一种甚至在小鼠体内都没有表达的转录因子,调节着整个转化过程。”
结合起来,这些模型可以帮助研究人员描绘出仅仅几个细胞是如何发育为高度复杂的脊椎动物躯体的。
在许多国家,对人类胚胎的研究只能在发育14天以内进行,但在这些限制条件下,研究人员仍有许多工作可做。Esteban说,非人类灵长类动物模型提供了一种可能的替代方案,而Zernicka-Goetz说,她的小鼠胚胎策略也可以产生发育到第12天的人类胚胎。她说:“在这个我们能研究的胚胎阶段,仍有很多问题有待提出。”
参考文献:
1. Swaminathan, J. et al. Nature Biotechnol.36, 1076–1082 (2018).
2. Reed, B. D. et al. Science 378, 186–192 (2022).
3. Brinkerhoff, H., Kang, A. S. W., Liu, J., Aksimentiev, A. & Dekker, C. Science 374, 1509–1513 (2021).
4. Heinrich, L. et al. Nature 599, 141–146 (2021).
5. Xu, C. S. et al. Nature 599, 147–151 (2021).
6. Walton, R. T., Christie, K. A., Whittaker, M. N. & Kleinstiver, B. P. et al. Science 368, 290–296 (2020).
7. Ciciani, M. et al. Nature Commun. 13, 6474 (2022).
8. Kuitems, M. et al. Nature 601, 388–391 (2022).
9. Miyake, F., Nagaya, K., Masuda, K. & Nakamura, T. Nature 486, 240–242 (2012).
10. Brehm, N. et al. Nature Commun. 13, 1196 (2022).
11. Rappez, L. et al. Nature Methods 18, 799–805 (2021).
12. Amadei, G. et al. Nature 610, 143–153 (2022).
13. Lau, K. Y. C. et al. Cell Stem Cell 29, 1445–1458 (2022).
14. Mazid, M. A. et al. Nature 605, 315–324 (2022).
原文以Seven technologies to watch in 2023为标题发表在2023年1月23日《自然》的技术特写版块上
© nature doi: 10.1038/d41586-023-00178-y
本文来自微信公众号:Nature Portfolio (ID:nature-portfolio),作者:Michael Eisenstein

