本文来自微信公众号:Nature Portfolio (ID:nature-portfolio),作者:Cassandra Willyard,头图来自:视觉中国
Lara Hawthorne是英国的一名插画师,她在得了COVID-19后出现了一些奇怪的症状,她很希望这些症状不是新冠病毒导致的。她刚开始病得不重,她说:“我打了三针疫苗,应该有很好的保护。”但几个月后,一连串使她身体虚弱的症状仍挥之不去:耳痛、耳鸣、充血、头疼、眩晕、心悸、肌肉痛等。有些日子里,Hawthorne的身体非常虚弱,甚至都无法下床。当她总算有体力去看病时,医生的诊断正是她最担心的结果:长新冠(long COVID)。
由于没有解药,Hawthorne感到越来越绝望。她在《卫报》(The Guardian)上读到了一篇关于血栓会如何导致长新冠症状的文章,她便马上联系了德国的一名内科医生,这名医生专门使用血液稀释剂和一种血液过滤技术治疗病人。她还没有收到对方的回复,有传言说这个医生的预约一等就是好几个月,但如果她有机会去当地接受这些未经证实的疗法,她可能真的会去。她说:“我不想在身体已经这么差的情况下还要一直耽搁自己的健康。”
长新冠让研究人员感到困惑:已有几百项研究尝试揭示其机制,但都没什么进展(相关阅读:新冠后遗症:长新冠能治好吗?|《自然》长文)。现在,一些科学家和越来越多的长新冠患者开始支持这种有待证实的假说:微小而持续存在的血栓可能阻塞了流向重要器官的血液,导致人体内出现了各种奇怪的症状。
这种理论的支持者(他们在推特上自称#teamclots)包括南非斯坦陵布什大学的生理学家Etheresia Pretorius和英国利物浦大学的系统生物学家Douglas Kell。他们俩领导了对长新冠患者血液中微血栓进行可视化的首个团队。他们说,证据显示微血栓是无可反驳的,他们希望Hawthorne想尝试的抗凝血药物能开展临床试验。Pretorius正是Hawthorne在《卫报》上读到的那篇文章的作者。
然而,许多血液学家和COVID-19研究人员担心人们对血栓假说的热情超出了现有数据。他们希望看到更大规模的研究和更强的因果证据;对于一些人贸然尝试未经证实、有潜在风险的疗法,他们也表示了担忧。
在长新冠问题上,“我们现在有了一些零星的证据”,帝国理工学院的免疫学家Danny Altmann说,“大家都想尽全力把这些碎片拼凑起来,达成某种共识。但我们离那儿还很远,进度太慢了。”
血栓滋长
Pretorius和Kell大概在10年前认识了对方。之前Pretorius一直在研究铁在凝血中的作用,但没能引用Kell的一些研究。经过Kell的主动联系,俩人开始了交流。Pretorius说:“我们先在Skype上聊了聊,然后决定合作。”他们在各类疾病患者的体内发现了异常、密集的血栓,这些血栓好多年都无法溶解。他们在这项研究的基础上提出一种理论:有些分子——包括铁、蛋白或细菌胞壁碎片——可能会诱导这些异常血块的形成。
血栓形成是个复杂的过程,但纤维蛋白原这种雪茄形状的可溶蛋白质在其中起到了很重要的作用。纤维蛋白原能在血液里自由移动。如果发生外伤,细胞会释放凝血酶,凝血酶会将纤维蛋白原切割成名为纤维蛋白的不溶性蛋白。纤维蛋白片段会缠绕成网状,促进血块形成,帮助止血。
在显微镜下,这张网正常情况下好似“一盘美味的意大利面”,Kell说道。但团队在许多炎症性疾病中发现的血栓看起来不太一样。它们“很难看,又黏又黑”,Kell说,“就像你把煮了一半的意大利面全部粘在一起。”Kell、Pretorius和同事的研究表明,这些纤维蛋白发生了错误折叠[1],变成了一种互相粘连的“淀粉样蛋白”版本。Kell说,只要少量的错误折叠就会引发灾难。“如果第一个改变了构型,剩下的也会照葫芦画瓢”,和朊病毒很像,朊病毒也是有传染性的错误折叠蛋白,会导致克罗伊茨费尔特-雅各布病(Creutzfeldt–Jakob disease)。
Pretorius最早在患有某种凝血障碍患者的血液中发现了这些奇奇怪怪、密密麻麻的血块[2],但后来她和Kell在各种疾病中都观察到了这种现象[1],包括糖尿病、阿尔茨海默病、帕金森病等等。不过,他们的假说在此之前并没有得到太多关注。
当新冠疫情在2020年暴发时,Kell和Pretorius几乎立即将他们的方法用在了新冠病毒感染者身上。Pretorius说:“我们当时想看看COVID的凝血问题,因为这是我们一直在研究的。”他们在实验中用了一种与淀粉样蛋白(包括错误折叠的纤维蛋白)结合时会发荧光的特殊染料,再在显微镜下对发光进行可视化。团队比较了13名健康志愿者、15名COVID-19患者、10名糖尿病患者、11名长新冠患者的血浆样本[3]。Pretorius说,对于长新冠和急性COVID-19来说,血栓形成“比我们之前在糖尿病或其他炎症性疾病中发现的还要多得多”。在另一项研究[4]中,他们分析了80名长新冠患者的血液,并在所有样本中都发现了微血栓。
目前为止,Pretorius、Kell和他们的同事是唯一发表过长新冠患者微血栓研究结果的团队。
但在其他尚未发表的研究中,谢菲尔德哈勒姆大学生物分子科学研究中心的神经科学家Caroline Dalton已经重复了上述结果。她和同事利用一种略微不同的方法——需使用一种自动化显微镜成像扫描仪——统计血液中的血栓数量。团队比较了3组人群,每组大概有25人:一组已知从未得过COVID-19,一组得过COVID-19且已康复,还有一组为长新冠患者。这3组人群都有微血栓,但从未得过COVID-19的人血栓数量更少,也更小;长新冠患者的血栓数量更多,也更大;有感染史的人群介于两者之间。团队的假说是:新冠病毒感染会在体内突然形成大量微血栓,但这些微血栓会随时间流逝而消失。但对于长新冠患者来说,这些血栓好像会一直存在。
Dalton还发现,疲劳度评分似乎也与微血栓数量相关——至少在部分人中如此。Dalton说,这增强了我们的信心,让我们相信我们的测量对象在机制上与这种疾病是相关的”。
从很多方面看,长新冠很像另一种无从解释的疾病:慢性疲劳综合征,也称肌痛性脑脊髓炎(ME/CFS)。康奈尔大学的美国国立卫生研究院(NIH)ME/CFS合作研究中心主任Maureen Hanson认为,Pretorius和Kell的研究让人们重新开始关注1980年代提出的关于异常血栓会导致症状的一个假说。Pretorius、Kell和同事在ME/CFS患者血液中发现了淀粉样蛋白血块,但数量比他们在长新冠患者体内发现的要少很多[5]。Pretorius说,血栓形成可能只是ME/CFS的部分原因。
微血栓之谜
这些微血栓究竟从何而来的问题还没有完全明确。但Pretorius和Kell认为,新冠病毒用来进入细胞的刺突蛋白可能是长新冠患者体内的诱导因素。他们在实验室把刺突蛋白加入健康志愿者的血浆后发现,只需这一步就足以诱导这些异常血块的形成[6]。
有证据显示,刺突蛋白可能确实参与其中。在6月发布的一篇预印本论文[7]中,哈佛大学的研究人员报道了在长新冠患者血液中发现了刺突蛋白。一个瑞典团队发表的另一篇论文[8]指出,刺突蛋白中特定多肽能自己形成淀粉样蛋白片段——至少在试管中可以。这些错误折叠片段或许提供了一个模板,论文作者、林雪平大学蛋白质化学家Sofie Nyström说。
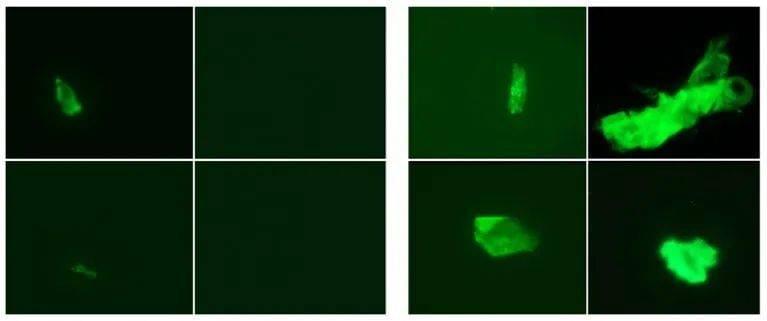
加州一个团队发现,纤维蛋白确实能与刺突蛋白结合。2021年的一篇预印本论文[9]指出,当这两种蛋白结合时,纤维蛋白会加重炎症,形成更难溶解的血栓。但这些拼图应该如何拼凑起来仍不清晰。
如果刺突蛋白是诱发异常血栓的原因,那么含有刺突蛋白或含有形成刺突蛋白指令的新冠疫苗是否也会诱发这些血栓的形成呢?目前没有直接证据显示来自疫苗的刺突蛋白能帮助形成血栓,但Pretorius和Kell已经从南非医学研究理事会拿到了研究该问题的经费。(与牛津-阿斯利康疫苗相关的罕见血栓事件被认为是由另一种机制导致的;Nature 596, 479–481; 2021)
关于新冠疫苗安全性的担忧可能会引起恐慌,林雪平大学的蛋白质化学家、Nyström的共同作者Per Hammarström说道。“我们不想耸人听闻,但如果这确实是个医疗问题,哪怕只与一部分人有关,我们都要指出来。”位于明尼苏达州的妙佑医疗(Mayo Clinic)疫苗研究团队负责人Gregory Poland也认为这个问题非常重要。“我的猜测是,我们最后会发现刺突蛋白和新冠病毒具有各种令人意外的病理生理学特征,”他说,“关于新冠疫苗的这些说法有多少是对的或不对的,我也不知道。”
数据荒
许多研究人员认为,微血栓可能导致长新冠的理论颇为可信,也值得研究。这个理论似乎也与关于血栓形成的其他数据相吻合。研究人员已知COVID-19患者更容易出现血栓,尤其是重症患者。新冠病毒能感染人体内10万千米长的血管的内皮细胞,引发诱导血栓形成的炎症和损伤。
这些血栓可能会对生理功能产生影响。德国汉诺威医学院的病理学家Danny Jonigk和同事在COVID-19死者的组织样本中发现了微血栓,并观察到毛细血管出现了分支,通过形成新的分支来维持富氧血液的流动[10]。这里的不利方面在于,这些分支会扰动血流,促进形成新的血块。
还有很多实验室也发现,对一些人来说,形成血栓的趋势会一直持续到初始感染的几个月后。都柏林圣三一大学的血液和血栓专家James O’Donnell和同事发现[11],约有25%的COVID-19康复者表现出“非常明显和不寻常”的血栓增多现象。
目前仍不清楚是否是这些异常的血栓反应导致了任何长新冠症状,“或者说,它只是与新冠相关的另一种反常现象?” O’Donnell说道。
纽约范斯坦医学研究所的血液学家Alex Spyropoulos表示,微血栓假说提出了“一种非常简洁的机制”。但他指出,仍需开展更多研究将实验室标志物与临床症状关联起来。Spyropoulos说:“令人不安的是这些作者和其他人有点太过自信了。”
加拿大麦克马斯特大学的血液与血栓专家Jeffrey Weitz则指出,Pretorius团队用来寻找微血栓的方法“根本不是一种标准方法”。他解释道,“我想看到其他研究人员的确认。”微血栓很难检测。病理学家能在组织样本中发现它们,但血液学家一般会寻找异常血栓形成的标志物,而不是血栓本身。
其他规模更大的长新冠研究则无法找到血栓形成的迹象。美国国立卫生研究院的传染病专家Michael Sneller和同事对189名新冠病毒感染者进行了全面检查,其中有些人的症状一直存在,有些人则没有,此外还有120名对照个体[12]。他们没有专门寻找微血栓,但如果微血栓堵塞了毛细血管,Sneller他们应该能发现一些证据——比如在肺和肾脏等毛细血管集中的器官会出现组织损伤。微血栓还可以损伤红细胞,导致贫血。但Sneller和他的同事没有在他们的任何实验室检测中发现这些迹象。
Kell和Pretorius表示,只是因为该研究没有发现任何微血栓的证据,并不表示微血栓就不存在。围绕长新冠的一个关键问题是:“各项检测的结果最后都在正常范围内”,Pretorius说,“但这些都是很着急的病人,他们没有诊断方法。”她希望其他研究人员能读一下他们的论文,尝试重复他们的结果。她说,“在这之后我们就能讨论一下。”她还表示,最后决定性的因果证据将是长新冠患者在接受抗凝血治疗后逐渐好转。
目前这方面已有一些有限的证据。Kell、Pretorius和其他研究人员,包括斯坦陵布什大学的医生Gert Jacobus Laubscher,在2021年12月发布的一篇预印本论文的早期版本中指出,24名使用两种抗血小板药和一种抗凝血药联合治疗的长新冠患者得到了一定程度的缓解[13]。受试者报告他们的主要症状消失了,疲劳感也减轻了。他们的微血栓也减少了。
Pretorius和Kell正在收集更多数据,以便正式发表这些结果。但其他医生已经在使用这些药物治疗长新冠患者了。有些甚至提供一种类似透析的技术来过滤血液中的纤维蛋白原和其他炎症分子。对O’Donnell来说,这类疗法还不太成熟。他认同有些长新冠患者确实更容易出现血栓,但他说,从一项小规模研究推广到治疗大量人群不会出现在我2022年的计划里。Sneller也持相同观点。“抗凝治疗不是完全无害的。你本质上是在干预血液的凝血能力,”他说,这可能会让很小的外伤也具有生命危险。
Kell表示,他已经厌倦了等待人们对长新冠疗法达成共识。他说:“这些患者深受折磨。他们身体很不好,内心很焦急。”Altmann理解这种烦恼。他几乎每天都会收到邮件问他,“这些药物的临床试验做了吗?为什么要等这么久?”但他也表示,即使在疫情白热化的日子里,研究人员也必须按流程来。“我不是在贬低任何人的数据。我只是想说我们还没有到那一步,”他说,“让我们先好好地把点连成线吧。”
参考文献:
1. Kell, D. B., Laubscher, G. J. & Pretorius, E. Biochem. J. 479, 537–559 (2022).
2. Pretorius, E., Briedenhann, S., Marx, J. & Franz, R. C. Ultrastruct. Pathol. 30, 167–176 (2006).
3. Pretorius, E. et al. Cardiovasc. Diabetol. 20, 172 (2021).
4. Pretorius, E. et al. Cardiovasc. Diabetol. 21, 148 (2022).
5. Nunes, J. M., Kruger, A., Proal, A., Kell, D. B. & Pretorius, E. Pharmaceuticals 15, 931 (2022).
6. Grobbelaar, L. M. et al. Biosci. Rep. 41, BSR20210611 (2021).
7. Swank, Z., Senussi, Y., Alter, G. & Walt, D. R. Preprint at medRxiv https://doi.org/10.1101/2022.06.14.22276401 (2022).
8. Nyström, S. & Hammarström, P. J. Am. Chem. Soc.144, 8945–8950 (2022).
9. Ryu, J. K. et al. Preprint at bioRxiv https://doi.org/10.1101/2021.10.12.464152 (2021).
10. Ackerman, M. et al. N. Engl. J. Med. 383, 120–128 (2020).
11. Townsend, L. et al. J. Thromb. Haemost. 19, 1064–1070 (2021).
12. Sneller, M. C. et al. Ann. Intern. Med. 175, 969–979 (2022).
13. Pretorius, E. et al. Preprint at Research Square https://doi.org/10.21203/rs.3.rs-1205453/v1 (2021).
(原文以Could tiny blood clots cause long COVID’s puzzling symptoms?为标题发表在2022年8月24日《自然》的新闻特写版块上)
本文来自微信公众号:Nature Portfolio (ID:nature-portfolio),作者:Cassandra Willyard

