本文来自微信公众号:高山书院 (ID:gasadaxue),根据Carlos Ibanez(诺贝尔生理学/医学奖评选委员会成员)于2021年12月2日在京课程内容整理,整编:邱施运,编辑:朱珍,头图来自现场照片,原文标题:《致胖祸首:把一个“肇事基因”捉拿归案》
过去的利器,今日的祸端
进化遗传学家多布然斯基曾说过一句著名的话:生物学的一切都讲不通,除非是从演化视角来看(nothing in biology makes sense, except in the light of evolution)。
包括今天的肥胖现象。

约15万年前,上图中间这个肩上挑着矛的古人类,每天爬高蹲低,四处奔走猎食。有时运气好,一天就能捕获几只猎物,有时却可能接连几天都空手而归。
在这样三餐不继、食物没有保障的环境下,一个善于储能的身体就是生存莫大的优势。随着时间推移,活下来的人都有着能高效储能的身体,各种“节俭持家”属性的基因也被筛选了出来。
到了今天,我们从野外彻底坐进了室内,每天对着电脑坐上十几个小时,不需要奔波,而三餐更是安逸无忧,不时再来上一份幸(kǎ)福(lù)感(lǐ)满(bào)满(zhà)的奶茶、炸鸡。
时过境迁,我们已经不再需要把多余的能量储存起来,以备不时之需;相反,它们开始成了烫手山芋,我们恨不得及早甩掉它们。
但我们的身体还是15万年前的那个身体。一样的手脚头身,大体相同的基因。因为这几百年来人类文明变化就像火箭一样太快太急剧,基因变异赶不上这个变化;同时,人类文明也已经发达到了允许我们逃离自然的选择。
所以,可以说我们现在正吃着、做着各种不符合“原厂设定”的东西。昔日的节俭基因,成了今天的肥胖基因。
嫌犯之一锁定:ALK7“党羽”
这些“跟不上时代”的肥胖祸首有哪些?
我们都知道,进食后,吃下的面条、米饭会在胃肠道一点点被“拆解”,最后变成细小的葡萄糖分子,再通过小肠钻进我们的血液里。这时候,就会发生我们常说的血糖升高的现象。
这些蜂拥而至的血糖大军,我们不能任它们的“铁骑”恣意踏身体各个精细的大小机关。这时如果不出意外,血糖的克星——胰岛素也就会及时赶到,将葡萄糖转化为其他的形态。
对此,相信很多人也并不陌生,但这里我主要想带出的是一个细节:胰岛素并不是直接作用在葡萄糖上的。胰岛素是通过跟细胞壁上的特定受体结合——从而对细胞内部发起号令(signaling),让它们开展一系列你不想知道的“化学组合拳”——最后完成转化任务。
在人体里,类似这样的机制非常多,今天我们要说的并不是胰岛素或胰岛素的受体,而是另一种受体,叫ALK7。
ALK7受体在大脑里的下丘脑、腺垂体,或是胰脏、肠道、性器官以及脂肪组织中都发挥着作用,而这些器官及组织都和我们的身体代谢、食欲调节密切相关。
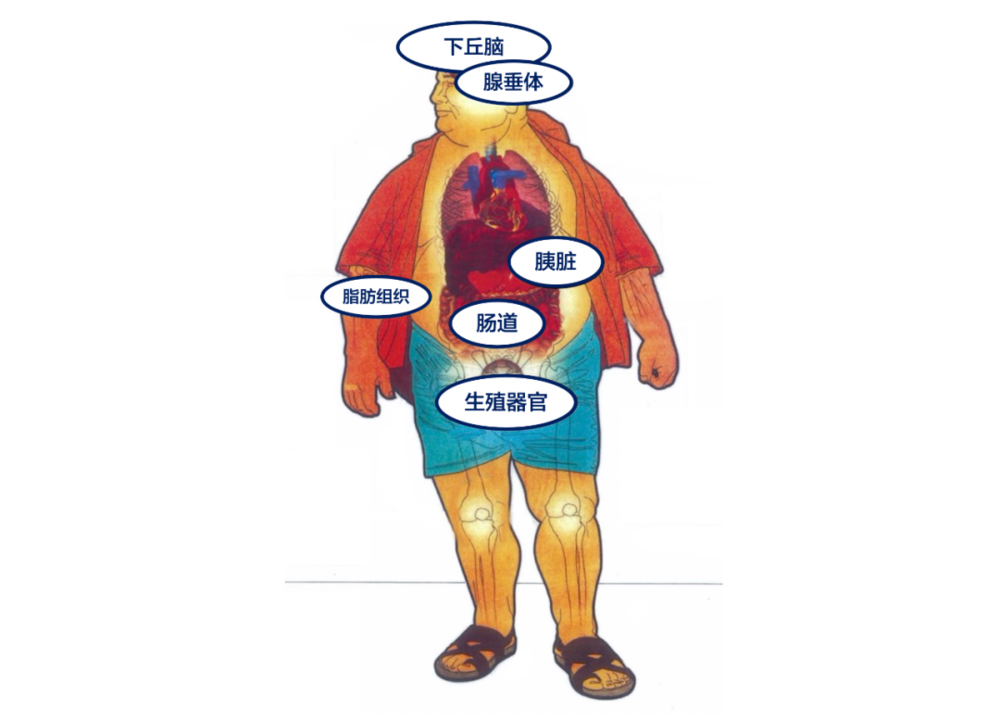
我们有理由怀疑:ALK7就是其中一个冥顽不灵,该减肥的时候带我们储能的“异端分子”。

啥?这样凭空猜测是不是太轻率了?确实,我们得做一个实验。
首先,我们通过基因编辑技术敲除掉小鼠的ALK7的相关基因,得到一组没有ALK7受体的小鼠(以下称作“变种鼠”)以及一组正常小鼠(以下称作“正常鼠”)。
然后,我们用两种饮食来喂食这些小鼠,一种是正常饮食,一种是高脂饮食。
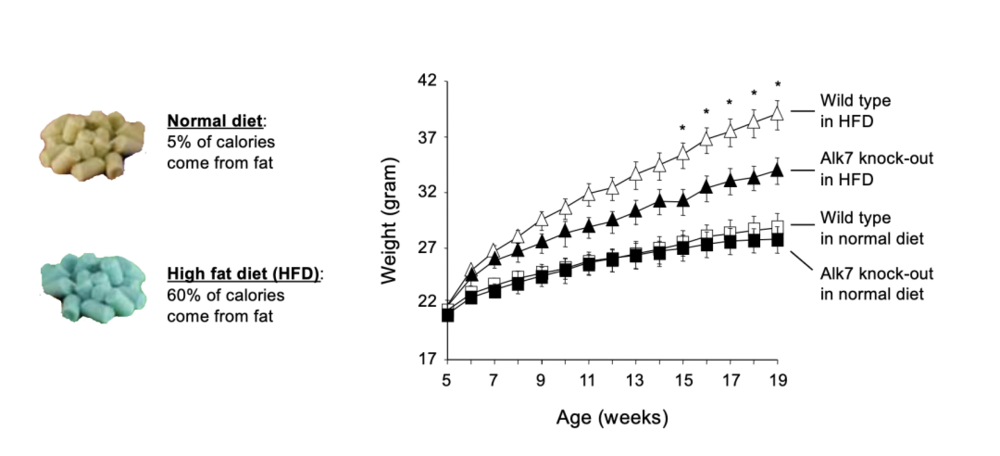
研究显示,正常饮食下的正常鼠和变种鼠,体重几乎没有差异;但在高脂饮食下,变种鼠比正常鼠变胖的程度明显要低得多。
因此我们可以得出结论:没有了ALK7的小鼠不那么容易发胖。
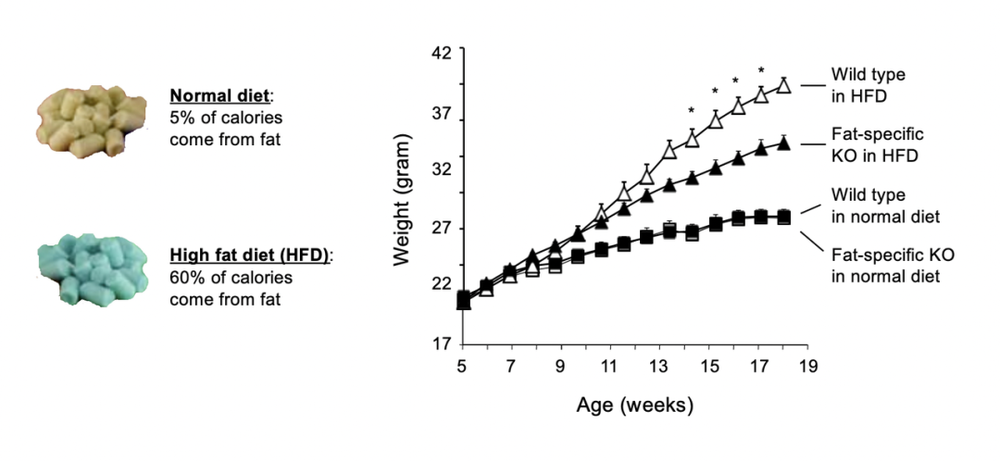
不过在这个实验里,我们是把小鼠全身上下所有的ALK7都一律搞没了——后来,我们再重复了一个相同的实验,但只是针对性地关闭了脂肪组织里的ALK7。
而实验结果是一致的。这说明了,小鼠发胖与否主要取决于脂肪组织上的ALK7是否起作用,和其他器官组织的ALK7关系不大。
不过实验里测量的是小鼠的整体体重,但没准这些增加的体重是肌肉呢?所以我们进一步对小鼠们的体脂做了确认。
通过核磁共振我们发现,经过了高脂饮食以后的变种鼠与正常鼠,在肌肉量上相差无几;但在脂肪量上,变种鼠要比正常鼠少了将近一半。
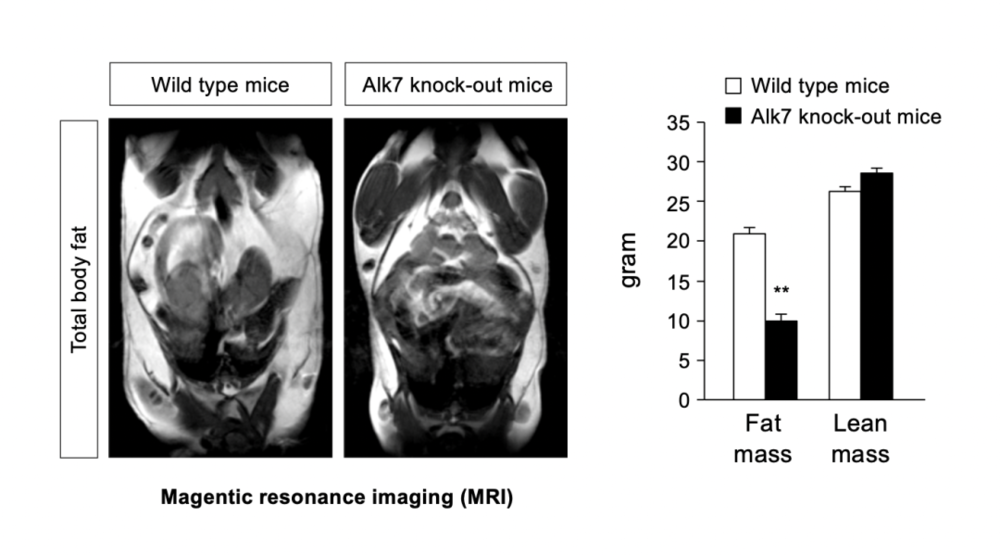
这下还不证据确凿,人赃并获?!
且慢。单从结果上看,ALK7确实“犯案”了,但“犯案动机“和“具体过程”还没谱儿呢——比如为什么小鼠没有了ALK7比较不容易发胖?或反过来,为什么有了ALK7的小鼠容易发胖?
为了还原事实真相,我们还得继续往下深挖。
ALK7是怎么犯案的?
但头绪究竟要往哪找?既然肥胖和脂肪脱不了干系,我们就先从脂肪身上找找线索,看看能不能从侧面突破。
常常被我们挂在嘴边的脂肪,实际上可以分为两类。
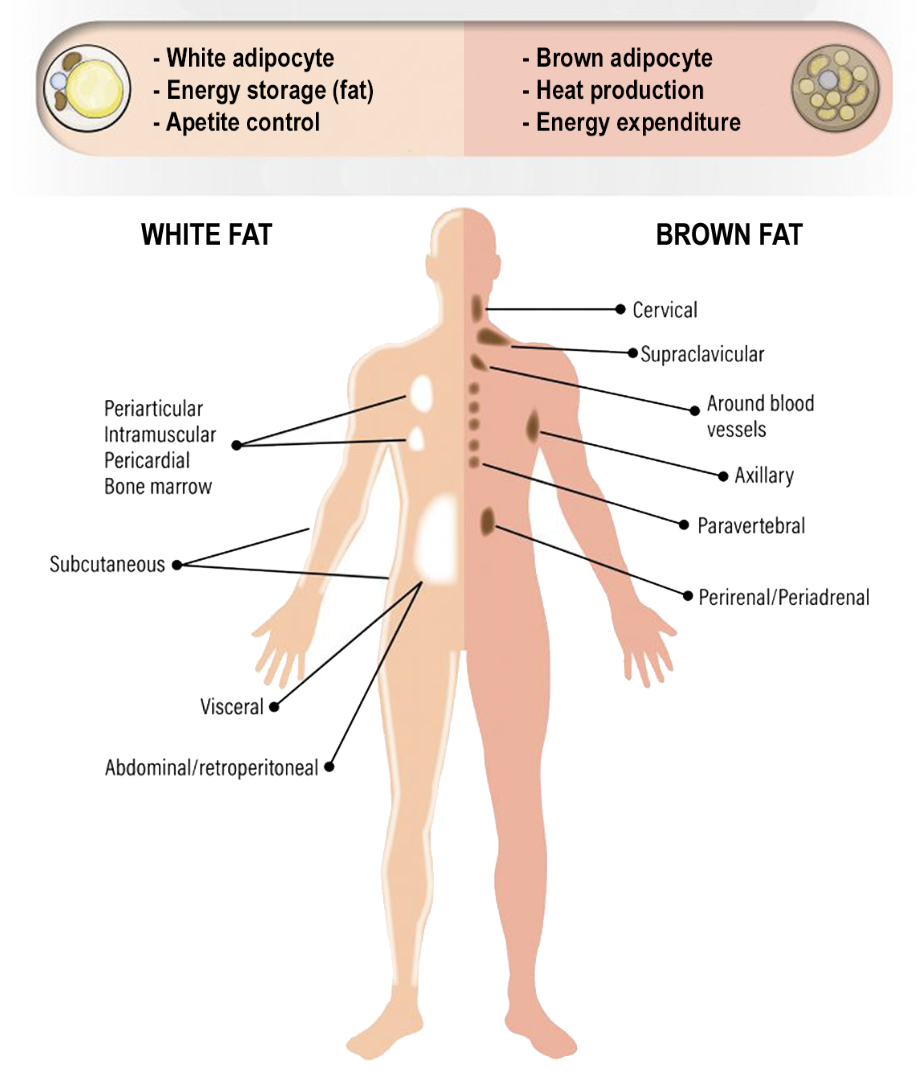
我们较为熟知的一类是白色脂肪组织,其中又分为皮下脂肪和内脏脂肪。皮下脂肪,顾名思义一般储存在表皮底下;而内脏脂肪,则储藏在脏器之间的间隙尤其是腹腔内,对健康可以带来各种代谢性/机械性危害。
这些白色脂肪组织的主要功能是储能,也就是贮脂肪(所以我们可以在上面的图中看到,白色脂肪细胞里有一个大脂肪泡占据着大部分的空间)。
除此之外,另外还有一种迥然不同的脂肪,叫棕色脂肪组织,它的任务在于供能,释放热量。
比如当我们进入一个冰冷的环境,身体的第一个反应是打哆嗦,那是透过肌肉去制造热能;而随着我们持续哆嗦了一段时间,身体会触发另一个机制,让棕色脂肪组织开始燃烧自己,温暖世界(你)。
过去我们曾以为人类没有棕色脂肪组织,但后来逐渐了解到,它在我们刚呱呱坠地的阶段扮演着一个重要的角色。婴儿因为个头小,所以比表面积大,失热非常快,特别需要这样的机制。
现在有很多团队正研究着怎么促使身体将白色脂肪转为棕色脂肪,并将脂肪的能量释放出来,有兴趣的朋友可以关注一下。
但棕色脂肪跟肥胖实在没啥关系,先把它搁一旁——值得我们注意的是,身体的白色脂肪平时是怎样开始“自焚”的?
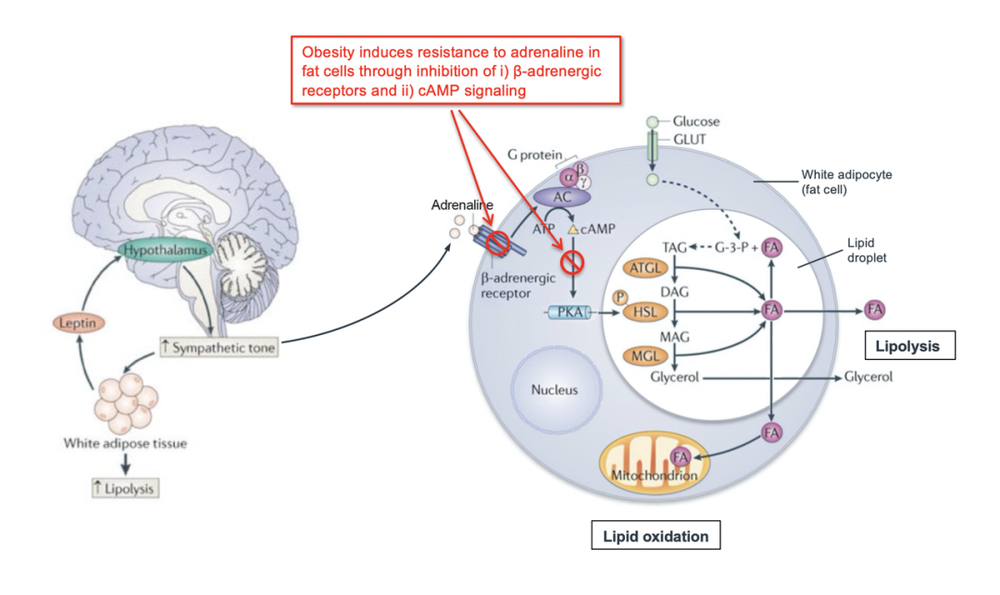
一般情况下,白色脂肪组织会分泌瘦素,瘦素发送信号给大脑,大脑再派遣我们熟悉的肾上腺素回到白色脂肪组织上——像前面提到的胰岛素,先刺激表面受体,然后触发一系列你依然不想知道的化学魔法——督促脂肪分解,把能量释放出来。
那么我们自然也好奇:失去ALK7的变种鼠之所以不容易变胖,是否跟这个机制有关?
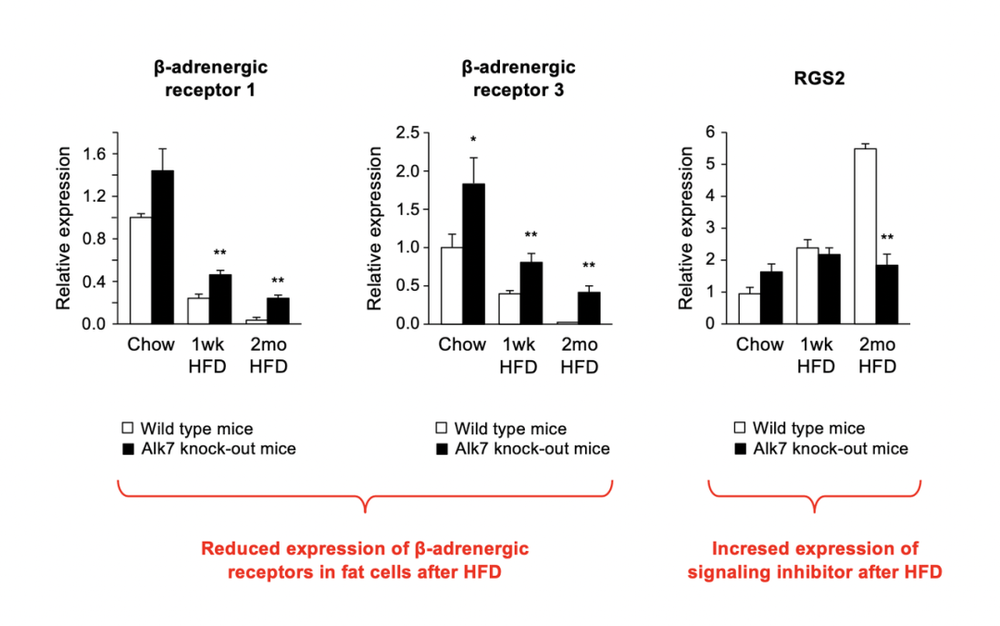
为了研究这个问题,我们把小鼠们放在了一个特殊设计的笼子里进行一系列实验和观测,实验结果显示:变种鼠的脂肪组织对肾上腺素确实更敏感,因此燃烧脂肪更充分,消耗的热量也更多。
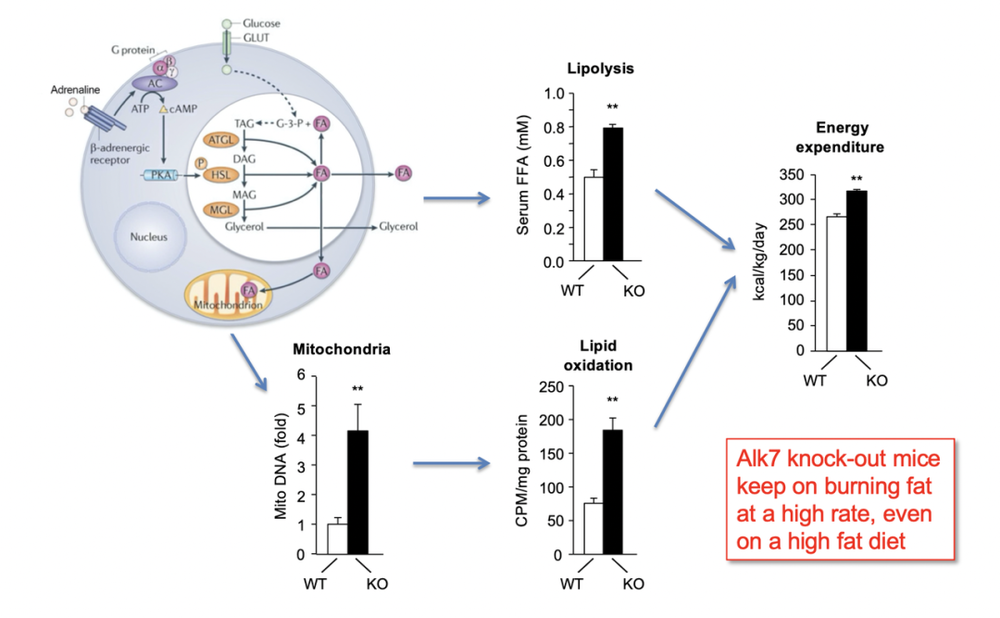
这下……总算真相大白了。
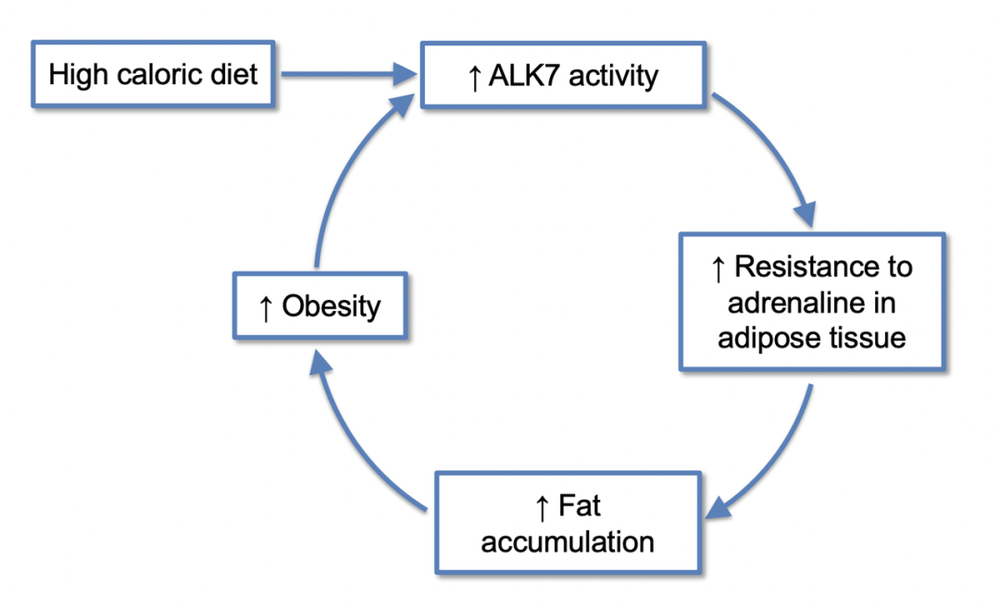
由于高卡路里饮食里的成分容易激活ALK7受体,从而打断了脂肪组织对肾上腺素的反应路径,使得白色脂肪组织对肾上腺素变得不敏感。于是,脂肪无法分解并持续累积。
更惨的是,这是一个恶性循环——随着脂肪积累,ALK7会进一步被激活,脂肪像雪球一样滚下去。
剿灭ALK7,就可以瘦下来?
所以这些实验是否意味着:我们可以靠关闭掉ALK7受体,治疗今天这个肆虐全球的肥胖“流行病”?
这也正是我们做这些研究的主要目的之一——但在那之前,有三道问题要面对:
(1)这安全吗?
ALK7在人体内有没有其他关键功能?贸然把它们关掉会不会引发什么后遗症?
在小鼠实验中,失去ALK7并没有对它们的发育、繁殖和寿命等方面造成任何影响,唯一看到的不同是,燃烧了更多脂肪——所以如此“挥霍”的小鼠一旦回到野外将很难生存。
而从人类的基因库中,我们也看到了几种ALK7相关的基因变异,其中一种变异导致了66720个欧裔中18个人身上的ALK7失活,相关研究同样显示:失去ALK7的人身上没有出现不可承受的后果。
(2)这要怎么操作?
在前面的实验里,关闭小鼠ALK7靠的是在它们出生前进行基因编辑,出生后想这么干也没办法——未来临床更不可能对人类这么干。所以我们必须考虑用其他方式关闭ALK7,比如药物。
那么前面的实验我们必须换一个方式来进行:不靠基因编辑,而是通过药物关闭ALK7,把结论都重新验证一次。
不过棘手的是:现阶段市面上还没有能特别精准针对ALK7的靶向药物。但是,山不过来,我就过去,既然药物匹配度不够好,而药物不好改,那我们就……改基因。
我们针对性的对小鼠基因进行了编辑,以至于小鼠既能生成正常运作的ALK7受体,同时这些受体又可以被我们的药物精准关闭。换句话说,这些小鼠在喂药之前会一直在ALK7正常运作的情况下正常长大;只有在吃药之后,ALK7才会关闭。这批小鼠,我们称作ASKA鼠。
最后,我们得到了类似的结论——通过药物关闭ALK7的小鼠不那么容易发胖,燃脂机制也更充分。
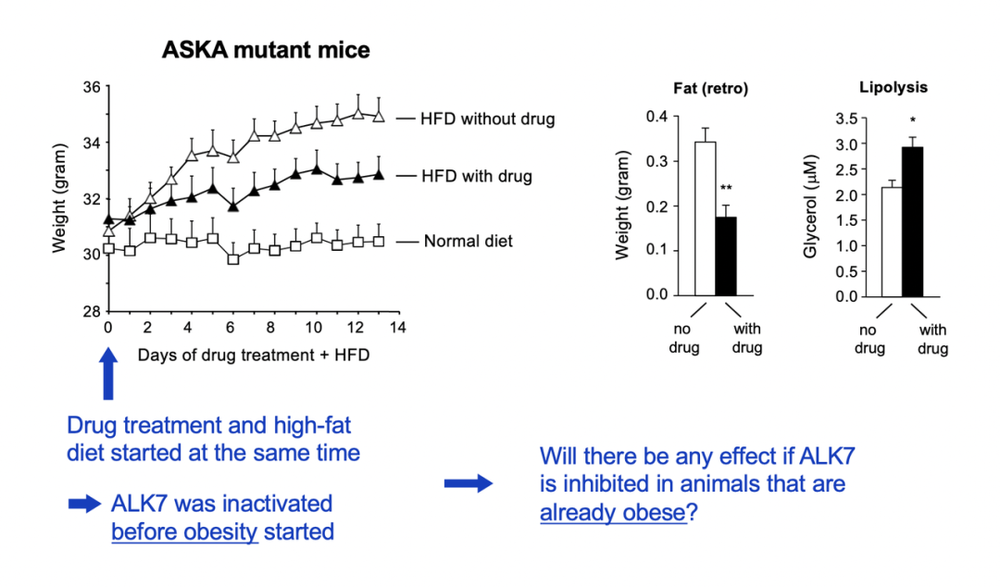
两道问题摆平了,剩下最后一道,也是最关键的一道。
(3)不容易胖=容易瘦吗?
严格来说,前面所有的研究证明的是,ALK7关闭以后瘦小的小鼠不那么容易长胖,而不是肥胖的小鼠更容易瘦下来!
这两者之间看似雷同,但实际上存在本质区别,不能理所当然地等同视之;而现实中,需要肥胖治疗的都是已经肥胖的个体。
所以,需要用已经肥胖的小鼠再重复一次实验。我们从瘦小的ASKA鼠开始培养,让它们经过12个星期的高脂饮食,长大成肥胖小鼠。
然后,胖鼠瘦身计划启动。
Round 1
首先我们把肥胖的ASKA鼠分成两组,一组吃药(关闭ALK7)、一组不吃药,同时继续维持高脂饮食。
结果,一盆冷水当头浇下来——吃药和不吃药的ASKA鼠的体重几乎没有差别。实验室里的学生都要哭了,因为这似乎意味着关闭ALK7的药对于对抗肥胖无效。
但随即,我们调整了思路再次出发。
Round 2
同样,我们把肥胖的ASKA鼠分成两组,一组吃药(关闭ALK7)、一组不吃药——但差别是它们不再维持高脂饮食,而是转换到正常饮食。
这时,我们看到不吃药的小鼠体重下降了,但吃药的小鼠就瘦得更多了。First Blood!
所以,只要搭配饮食调整,我们依旧看到了关闭ALK7药物对肥胖小鼠的减重作用。
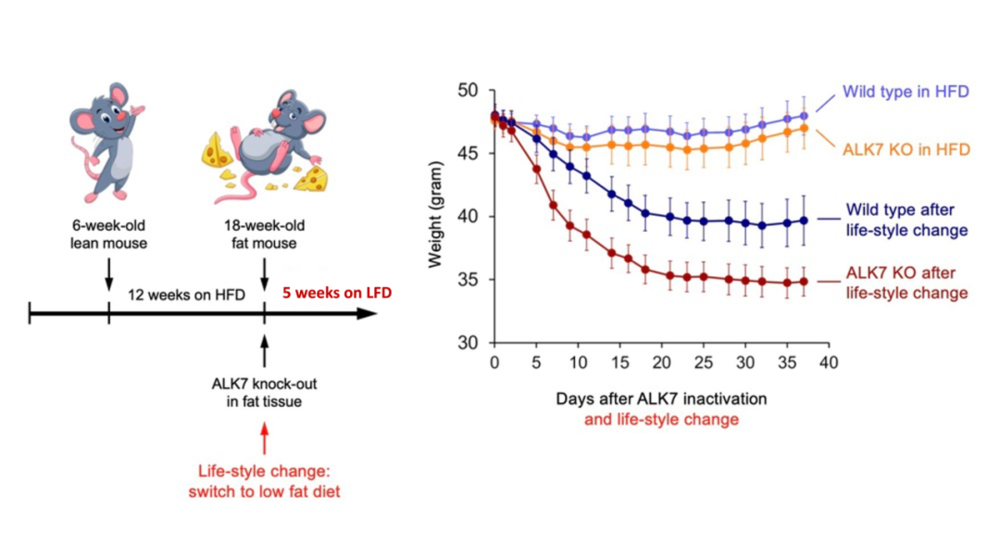
但这里也抛出了一个问题:为什么单独用药没效果,非得搭配饮食调整才有效果?单独用药的做法究竟是缺少了什么,而饮食调整又加强了什么?
这就要说到肥胖患者身上一个难以避免的代谢问题——细胞发炎。
发炎是什么?如果我们不小心跌倒扭伤了脚踝,脚踝会开始发肿,发肿的背后实际上就是炎症反应,各路的免疫细胞开始涌来,这也是我们身体的重要防御机制。
肥胖的时候也一样。随着脂肪细胞变大,细胞之间会相互推挤,产生机械应力;除此之外,脂肪细胞出现的缺氧问题,以及肠道代谢出的各种脂肪酸等分子,这种种的因素都会让脂肪细胞生成一些分子去招募以及激活免疫细胞,进而启动炎症反应。
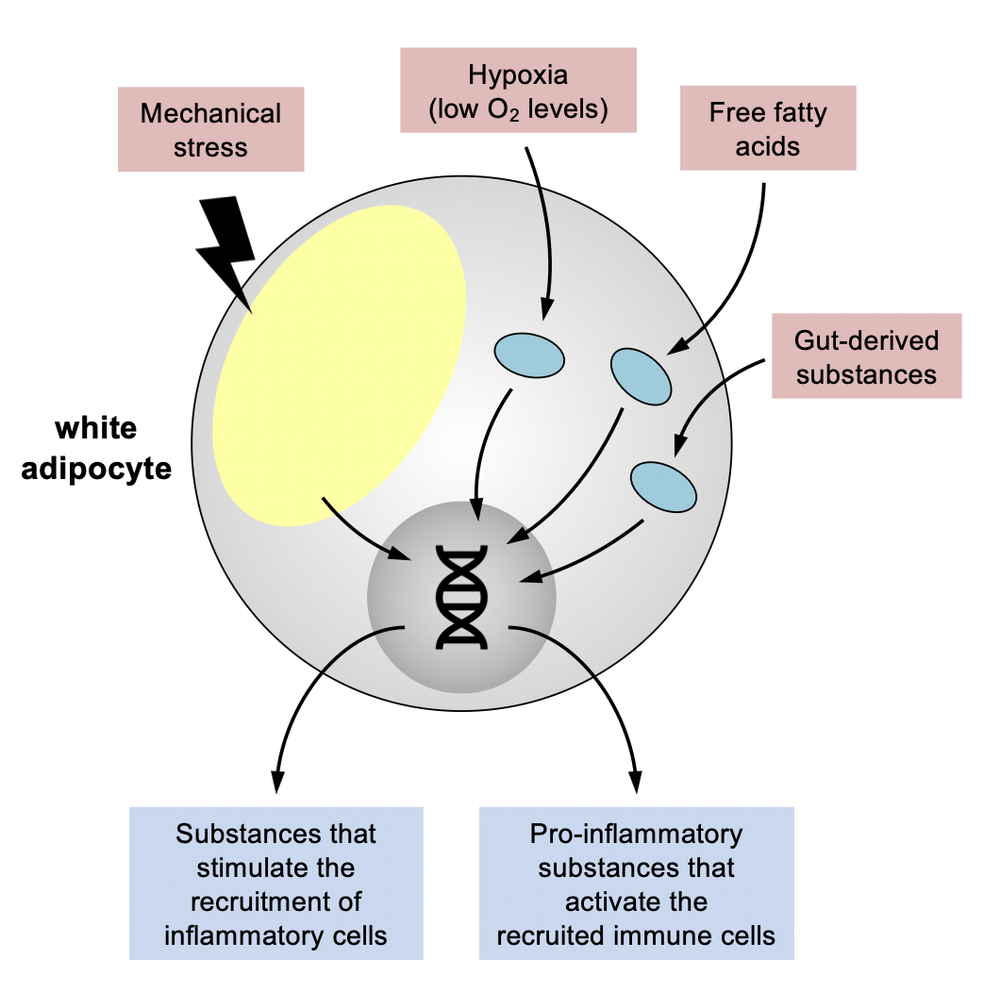
随着小鼠饮食的转变,这些促发炎性的细胞因子少了,炎症反应也就减少了。
想到这里,我们也突发奇想:如果用抗发炎药取代饮食调整的话,是否也能达到有类似的减重效果?于是有了另一版实验。
Round 3
我们同样把肥胖的ASKA鼠分成两组,一组吃药关闭、一组不吃药,并维持高脂饮食——但这次我们同时也喂它们吃最简单的消炎药阿司匹林。
结果显示,使用阿司匹林以后,ALK关闭与不关闭的小鼠初期都体现了体重下降的现象。但随后,ALK不关闭的小鼠的体重很快就攀升,追上了没有吃抗炎药的小鼠,而ALK关闭的小鼠的体重则可控得多。Double Kill!
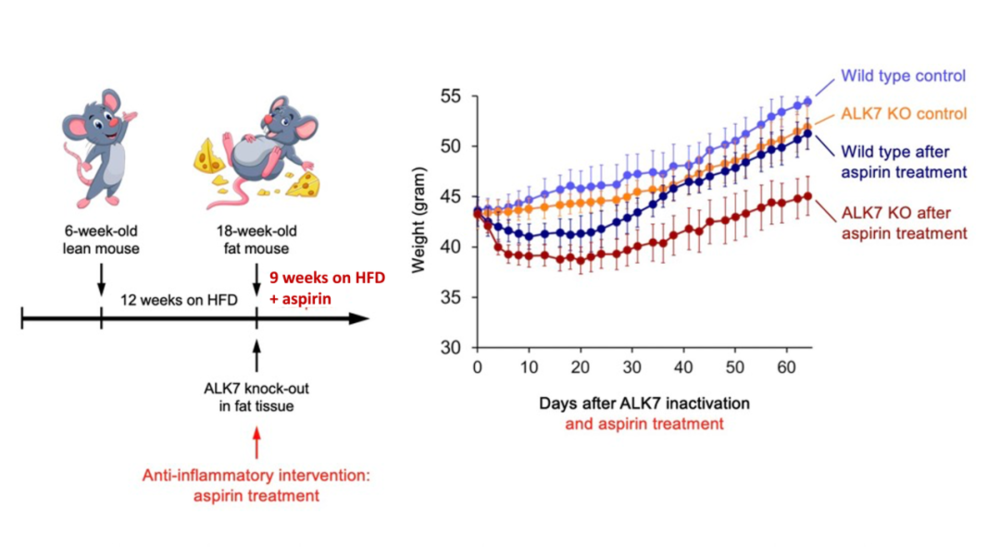
所以这里我们再次确认了,单独用药关闭ALK7对于肥胖问题没有帮助,但搭配抗炎方案(不管是饮食还是药物),减重效果一定程度就显现出来了。
但是我们知道,在减重这件事上一直存在一个很现实的问题,就是减肥后的复胖——减重很难,但维持更难。
过去美国有一个风靡一时的减肥真人秀,减肥最成功的参赛者能赢走25万美金。最终赢走奖金的参赛者,体重从346磅多掉到178磅,掉了整整50%。

但后来,一项研究跟踪报道了这个真人秀的参赛者6年后的样子,发现他们很多人比之前更重了。这些减肥以后复胖得更厉害的人,也被称为“最大输家(the biggest loser)”。
为什么会这样?
其中一个基本的原理就在于,减重饮食/运动的本质依赖于热量赤字。身体在经过一段时间的热量赤字以后,会逐渐降低新陈代谢进行适应;一旦恢复到过去的饮食,变本加厉地复胖也在所难免。尤其前面我也提到,我们的身体这几万年来都是朝着储存能量,而不是消耗能量的方向进化的。
这时,我们又有了一道新的问题:这个药能不能帮助改变这些最大输家的命运?
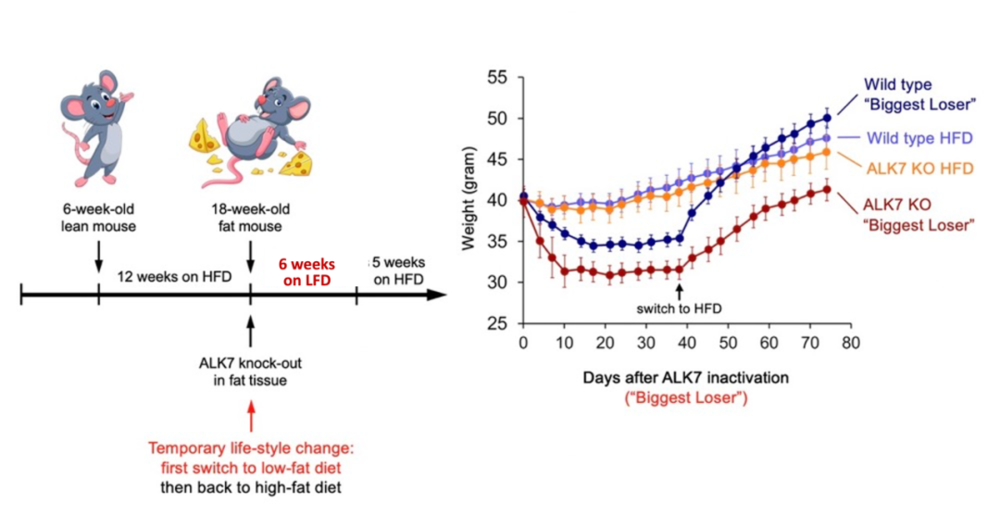
Round 4
这相当于重复Round 2的实验,先把肥胖的ASKA鼠分成两组,一组吃药关闭ALK7、一组不吃药,并转换到正常饮食——但几周后,再让它们回到高脂肪饮食。
最后,实验确认了“最大输家”的复胖现象——ALK7正常的小鼠一旦回到高脂饮食,比一直吃高脂饮食的ALK7正常鼠更胖了。
但值得庆幸的是,用药关闭ALK7以后,小鼠复胖的情况得到大幅度的控制。Triple Kill!
结语
“越是肥胖,越是易增胖、难减重”,是一个肥胖患者容易面临,并苦苦深陷的恶性循环。
其中,ALK7以及相关基因是如今我们的团队发现的罪魁祸首之一——如果能有效抑制它,同时调整生活方式以及抗炎疗程,就能有效减重,以及避免减重之后的复胖宿命。
当然,接下来我们还需要找到一个能精准关闭人类ALK7的药物,并通过小鼠动物模型进行一系列更深入的研究,再转到灵长类动物模型,最后才再展开一二三期临床……
但实际上,以上所有关于ALK7的内容都不是今天的重点——我更希望的是通过我们对ALK7的这些研究,让大家看到生物学正在通过什么样的方式与思路,去探究并解答人类社会遇到的医学问题。
而这个过程中常常有一些比较细碎的步骤(没有一一展现),因为科学领域要求实事求是,我们叫原理论证(proof of principle),对当中的各种细节进行验证。
最后,特别感谢过去15年跟我一起完成这些研究工作的各地团队,其中包括了新加坡国立大学(NUS),以及瑞典的卡罗林斯卡学院(KI)。现在我到了北京大学继续研究这个基因,希望未来会有更多的发现。
本文来自微信公众号:高山书院 (ID:gasadaxue),根据Carlos Ibanez(诺贝尔生理学/医学奖评选委员会成员)于2021年12月2日在京课程内容整理,整编:邱施运,编辑:朱珍

