本文来自微信公众号:Nature Portfolio(ID:nature-portfolio),作者:Kendall Powell,头图来自:视觉中国
Ali Brivanlou的实验室中所开展的一系列实验已进行至第13天,而此时他却面临着一项痛苦的抉择。他领导的发育生物学家团队解冻了数十个人类胚胎,并将它们放入单独的培养皿中,以观察胚胎发育最早期的生长过程——全世界也仅有少数研究者曾对此进行过观察。但他清楚,实验是时候结束了。
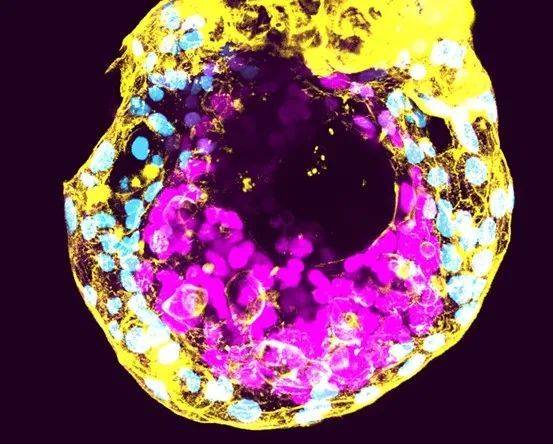
如果让这些胚胎继续生长的话,他们就将违反一项名为“14天准则”的国际共识,即研究者在体外培养人类胚胎的时间不得超过14天(自受精之日起计算)。第14天大致是原条(primitive streak)出现的时间,原条的出现标志着胚胎体轴(body axe)的建立,自此逐渐能区分出胚胎的头尾以及左右。
当Brivanlou回想起2015年在洛克菲勒大学的实验室中开展的研究时,他表示:“这是我一生中所做出的最艰难的决定之一,但是时候结束这项实验了。”在试验的第13天,研究小组将胚胎从培养皿底部剥离并将其冷冻,从而阻止胚胎的进一步发育。“我们无从得知这一刻之后会发生什么。”他说。
而现在,Brivanlou和其他发育生物学家终于有机会一探究竟。
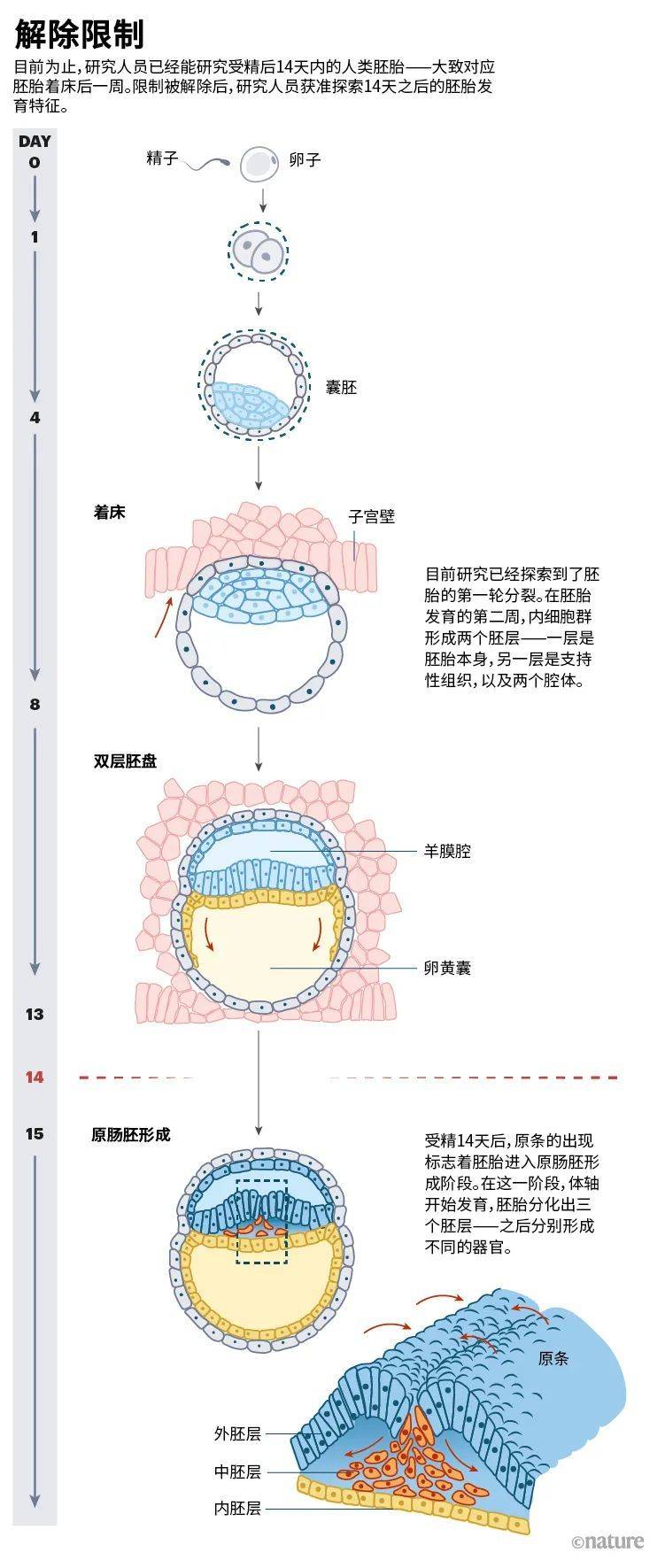
2021年5月,国际干细胞研究学会(ISSCR)发布了新版指南[1],对“14天准则”进行了放宽,从而扫清了上述障碍。尽管全世界仅有少数几所实验室具备将人类胚胎培养至第14天所需的完备技术,但如今科技发展日新月异。放宽后的规则允许研究团队在所在国法律许可的前提下,向监管机构申请对14天后的胚胎继续进行研究。自然情况下,受精后约一周胚胎开始着床。14天后的胚胎研究,可揭示胚胎着床后的发育特征。大约在受精后第14天到第22天之间,胚胎会经历原肠胚形成(gastrulation)的阶段,此时躯体的主要特征开始显现,并为之后的器官形成奠定基础。
若能对14天之后的胚胎发育阶段进行观察,科学家们就能更深入地理解流产和先天性缺陷的成因——据信,约1/3的流产以及许多先天性缺陷就发生在这一时期。此外,针对这些发育阶段的研究,或能揭示细胞分化为组织和器官的机制,从而促进再生医学的发展。
多数研究者期待,Brivanlou团队以及少数其他几个团队会立即投入到相关的工作中,拓展人类胚胎体外长期培养的技术边界。有能力完成此类工作的少数几个研究团队正处在激烈竞争之中。而在其他地方,首先需要修改有关法律以推进此类研究(见“解除限制”一图)。例如,中国的一些研究人员正在讨论本国目前奉行的“14天截点”政策是否应该修改,昆明理工大学的胚胎学家李天晴说。
因此,研究人员预计目前暂时不会涌现大量的“14天后胚胎”研究,而且他们对这类实验的正当性意见不一。“我对于将人类胚胎本身用作研究体系持谨慎态度。”英国弗朗西斯·克里克研究所的发育生物学家Naomi Moris说道。
为了避开限制,研究人员在过去五年中开发了一系列人类胚胎模型,其中大部分模型是由干细胞混合制成。这些模型可以模拟早期胚胎发育过程中的多个短期阶段,而且避免了使用接受体外受精(IVF)治疗的人所捐赠的那些既稀缺、又颇具伦理争议的人类胚胎。目前为止,“14天准则”尚不适用于这些胚胎模型。但是随着这些模型变得愈发复杂,有可能形成可分辨的组织结构、甚至器官,它们也会进入自己的道德“灰色地带”。
无论使用的是人类胚胎模型还是真正的胚胎,科学家们认为其中都有很多东西需要学习。“胚胎是卓越的大师。” Nicolas Rivron说,他是奥地利科学院分子生物技术科学研究所的干细胞生物学家和胚胎学家。“胚胎能全方位揭示人类生长发育以及衰退的机制。”
拓宽限制
“14天准则”最早于1979年提出,彼时IVF技术的出现使得人类胚胎第一次能在体外存活——尽管当时它们在体外只能存活数日之久。2006年,ISSCR发布了首部人类胚胎干细胞(ES细胞)指南,“14天准则”自那时起便在学术界确立起了牢固地位。
目前,该指南已被世界各地的研究人员和研究资助者广泛采用。在德国和奥地利等国,对人类胚胎进行任何研究都是非法的。其他许多国家,如英国、中国、日本、澳大利亚和加拿大则将“14天准则”写入法律。而在美国和以色列等少数国家,仅有相关的指导意见,而无法律明令禁止或限制人类胚胎研究,只不过这些研究在美国不能得到联邦政府的资助。
前一版的ISSCR指南发布于2016年,正好在两个研究团队发表突破性研究成果之前。
自2013年起,英国剑桥大学的Magdalena Zernicka-Goetz实验室开始尝试对人类胚胎进行7天以上的体外培养。他们想了解人类胚胎在囊胚即“细胞球”期之后会发生什么。该研究团队对激素和生长因子配方进行了改良。至2016年,该研究团队[2]以及Brivanlou团队[3]均报道称,他们已经在体外将人类胚胎培养至第12天~13天。
“我们正在开展的研究,例如人类胚胎会从哪个部位长出头部,具有非常重要的意义。”Zernicka-Goetz说。她目前在她英国的实验室以及加州理工学院的实验室之间来回奔波。“我对第二、第三和第四周的人类胚胎发育过程很感兴趣,这些阶段的胚胎虽然无法用超声进行观察,但主要器官的祖细胞会在这些阶段开始发育。”
其中一个科学问题是,胚胎生长过程中细胞内的基因是如何表达的。作为迄今为止规模最大的人类胚胎研究之一,Zernicka-Goetz研究小组从体外培养的16个胚胎中分离出了4820个单细胞,并对其进行分析。这些胚胎处于着床期(第5天)到准备形成原肠胚(第11天)之间的阶段。单细胞RNA测序揭示了在胚胎细胞从全能性(totipotency,即仍具有分化为体内各种细胞的潜能)向多能性(pluripotency,一种更加分化的状态)转变的过程中,哪些基因会关闭,又有哪些会开启[4]。
虽然小鼠胚胎发育中的这些发育信号已经揭晓,但这是首批揭示参与人类胚胎发育分子的研究之一。
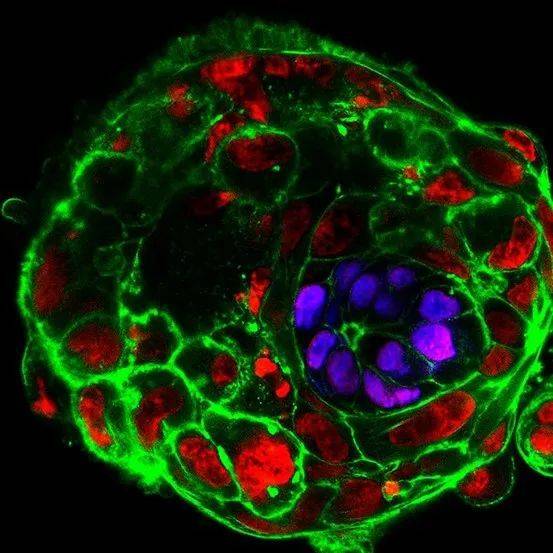
在其他一些必须依赖人类胚胎的实验中,Brivanlou团队和Zernicka-Goetz团队追踪了那些携带有非整倍体细胞(aneuploid cell)的人类胚胎的命运。非整倍体细胞有染色体数量异常,而这种异常被认为造成了多达半数的早期流产。
IVF诊疗机构在分析胚胎的遗传健康状况时,通常仅检测少量胚胎细胞。但多项实验结果表明,这样的分析结果可能具有误导性。Zernicka-Goetz研究小组发现,被诊断有某些类型的非整倍性的胚胎在体外培养中仍能正常发育[5]。Brivanlou小组分析了人类胚胎从第3天到第14天的基因表达,他们发现那些染色体数量异常的细胞会被清除——这些异常细胞或是发育为支持性组织,或是凋亡后被清除[6]。这两项研究都表明,IVF胚胎上常用的非整倍体检测,可能将许多胚胎被误诊为“不健康”。
这些发现要归功于人类胚胎,Brivanlou说道。“如果不能直接观察人类胚胎的发育,我们便无法取得这些认识。”他说。目前Brivanlou正在规划试验(其中一些实验可能要持续到第14天之后),以探索携带非整倍体细胞的胚胎的自我调节机制。
超越两周限制
动物胚胎研究领域的研究人员已经将动物胚胎的体外培养时限不断外推,已经超过了相当于人类胚胎发育第14天,这可能会为后续人类胚胎的体外培养的进步奠定基础。2021年3月,以色列魏茨曼科学研究所的Jacob Hanna研究小组将小鼠胚胎的体外培养时长从第5.5天延长至第11天(大致相当于人类胚胎的第13天到第30天)[7]。尽管其他研究人员认为该实验过程太过繁琐,但Hanna仍取得了理想的结果——这些小鼠胚胎顺利生长至器官发育的阶段。
Brivanlou和Zernicka-Goetz都计划进一步扩展人类胚胎体外培养的时限,在人类胚胎中实现Hanna团队在小鼠胚胎中所做的工作。Brivanlou想要解码将干细胞转变为首批脑细胞的遗传程序,他还希望能揭示调控四腔心脏形成的分子指令。这两个生理事件都发生在第14天之后,而揭开它们背后的机制则是理解神经发育障碍和常见先天性心脏缺陷的关键。
包括Brivanlou在内的多位学者认为,未来研究人员能在技术层面上实现将人类胚胎植入体外子宫。他的研究团队正在向所在大学的监管委员会提出申请,将他们的人类胚胎研究延长至受精后第21天。在第3周,全身的发育雏形就已建立,包括那些将发育为脊髓、脑、骨骼、心脏、血液、肌肉和面部的结构。“我不清楚我们能否将人类胚胎的体外培养时限延伸至第14天之后,”他说,“不过一旦可以这么做了,之后我们就应谨慎行事。”(欢迎阅读《自然》旧文:当人体胚胎在实验室中有望活过第14天)
建立胚胎模型
研究人员已经有办法来观察哺乳动物原肠胚的形成过程,他们不用真正的胚胎,而是用一些由三维混合干细胞所构建的胚胎模型。
在过去的五年里,研究人员在实验室中制作了多种胚胎模型,能一窥胚胎发育第14天之后的阶段。大多数情况下,这些胚胎模型不受“14天准则”或任何特殊审查的约束。
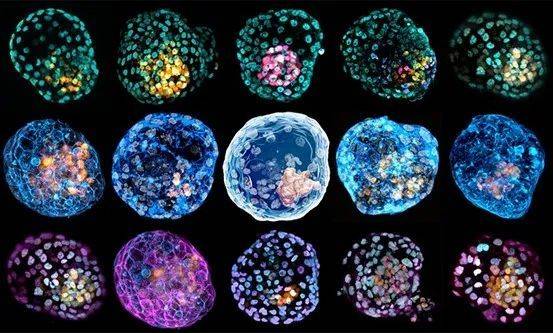
2017年,密歇根大学安娜堡分校的生物医学工程师傅建平及其团队构建了第一个人类胚胎模型。他们仅将胚胎干细胞进行三维培养,这些细胞便能自组织形成羊膜囊(amniotic sac)及原条的早期特征[8]。傅建平称,这一发现在领域内引起了轰动。“人类胚胎干细胞竟然有这般潜力,真是太棒了。”
类似傅建平团队的其他体外胚胎模型随之涌现,并能模拟小鼠和人类胚胎发育部分最早期阶段——包括胚胎着床[8]、原肠胚形成[9,10],以及脑[11]、脊髓[12]和心脏等器官的初始发育阶段。例如,傅建平等人构建了一种名为“类神经胚”(neuruloid)的模型[12],该模型可模拟人类脊髓和脑的前体细胞的形成过程。而且傅建平认为,该模型将帮助研究人员培养可植入患者体内的功能性神经元。由细胞混合制成的胚胎模型在外观和生物行为上往往与相同阶段的胚胎十分相似,但它们是否复现了正常胚胎发育过程中的分子和细胞活动——这仍是研究的空白领域。
傅建平等人坦言,随着人类胚胎模型进一步发育并形成更复杂的结构,新的伦理问题将会出现。例如,这些模型中的神经元可能会开始放电,心脏细胞可能会开始跳动。此外,这些模型可能会拥有进一步发育、超出当前实验模拟阶段的能力。虽然大多数胚胎模型缺乏形成完整胚胎所需的全部生命支持性组织。但在过去的几年里,已有少数实验室构建出了小鼠和人类的囊胚阶段胚胎模型,即所谓的“类囊胚”(blastoid)。这些模型含有可发育出上述支持性组织的前体细胞,理论上能形成完整的生命体[13–15]。
ISSCR已注意到这一领域,并在其指南中指出:包含这些支持性组织的胚胎模型必须受到特别监管,而且在达成研究目标的前提下,应尽可能地缩短其生长时间。随着这些模型的发展,则需重新考虑与之相关的伦理问题,ISSCR指导委员会主席、弗朗西斯·克里克研究所的干细胞生物学家Robin Lovell-Badge说。“这一领域显然必须密切注意。”
随着真实胚胎和胚胎模型研究的不断推进,科学家们迫切地想知道这两者之间究竟有几分相似。探寻胚胎模型与真实胚胎之间的分子机制以及细胞行为上的差异,是研究人员希望将真实胚胎的体外培养时间延长至14天以上的主要原因。“我们可以从胚胎模型中获得许多认识,”德国马克斯·普朗克分子细胞生物学和遗传学研究所的发育生物学家Jesse Veenvliet说道,“但重要的是要知道它哪里会出问题。”
2020年,Moris与其同事对小鼠胚胎和小鼠“类原肠胚”(gastruloid)进行了基因表达层面的平行对比,她们发现两者调控机体发育的信号激活时间点极为相似[16]。她认为,同样应该对人类的“类原肠胚”进行这种精确的基准化分析(benchmarking),而这就需要将人类胚胎培养至第21天左右。Rivron则构想了人类胚胎发育各阶段的分子图谱。
足量的基准化分析工作一旦完成,研究人员就可以在后续研究中减少真实人类胚胎的用量,并且仅在具备充分正当理由时才使用。
停在何处
但是应该将人类胚胎的体外培养时间放宽至多久呢?有人批评ISSCR不负责任,因为他们放宽了“14天准则”,却没有设定一个新的截止点——这似乎在为人类胚胎研究开绿灯。
ISSCR委员会的新版指南的制定历时18个月,并在此期间办了一百多次线上会议,傅建平参与了这一过程。“科学发展日新月异,作为科学家群体,我们很难再画下一个休止符。”他说。反之,研究指南允许这些研究在经过适当的审查之后得以进行。
Brivanlou也支持这一决定。“凭良心说,我清楚打破‘14天准则’能带来巨大好处。”他说,意指围绕异常染色体所开展的工作。“它或许能在下一代人中挽救不少生命。”他和Lovell-Badge认为,禁止受精14天后的胚胎研究是不道德的,因为这些研究可以揭示各器官的细胞是如何演化出来的,也可以阐明流产和先天缺陷的发生机制。
哪些实验和模型应被视作与受精14天后的胚胎研究具有相同地位,这一界限也愈发模糊。ISSCR指南进行了明确的伦理学划分,只将包含支持性组织的模型(理论上有可能得以完全发育的模型)与受精14天后的胚胎划为同类(该指南还禁止将实验研究中的人类胚胎、“人类-动物”嵌合胚胎或人类胚胎模型移植到动物或人类子宫中)。
一些研究人员对取消“14天准则”持保留意见。例如,Moris就认为公众尚无法估量受精14天后的胚胎实验的后果。
而黑斯廷斯中心的生物伦理学家Josephine Johnston则想得更远:“我认为放弃‘14天准则’却不提出另一条规则,这样的做法是错误的。”Johnston认为,限制性规则可以向外界传递出信号——即科学界理解社会大众对于人类胚胎的珍视,并对这份情感表示尊重。而取消限制性规则“有可能真正动摇公众的信任”。此外,她认为研究人员需要更清楚地解释,受精后14天的胚胎研究“究竟能如何造福人类”。研究人员还需要预先阐明胚胎研究的细节,Johnston说。“虽然此类研究大多还感觉十分遥远,但若不加以限制未免过于大意。”
参考文献:
1. Lovell-Badge, R. et al. Stem Cell Rep. 16, 1398–1408 (2021).
2. Shahbazi, M. N. et al. Nature Cell Biol. 18, 700–708 (2016).
3. Deglincerti, A. et al. Nature 533, 251–254 (2016).
4. Molè, M. A. et al. Nature Commun. 12, 3679 (2021).
5. Shahbazi, M. N. et al. Nature Commun. 11, 3987 (2020).
6. Yang, M. et al. Nature Cell Biol. 23, 314–321 (2021).
7. Aguilera-Castrejon, A. et al. Nature 593, 119–124 (2021).
8. Shao, Y. et al. Nature Commun. 8, 208 (2017).
9. Sozen, B. et al. Nature Cell Biol. 20, 979–989 (2018).
10. Moris, N. et al. Nature 582, 410–414 (2020).
11. Xue, X., Wang, R. P. & Fu, J. Curr. Opin. Biomed. Eng. 13, 127–133 (2020).
12. Veenvliet, J. V. et al. Science 370, eaba4937 (2020).
13. Rivron, N. C. et al. Nature 557, 106–111 (2018).
14. Yu, L. et al. Nature 591, 620–626 (2021).
15. Liu, X. et al. Nature 591, 627–632 (2021).
16. van den Brink, S. C. et al. Nature 582, 405–409 (2020).
原文以What’s next for lab-grown human embryos?为标题发表在2021年8月31日《自然》的新闻特写版块上
本文来自微信公众号:Nature Portfolio(ID:nature-portfolio),作者:Nature Portfolio

