本文来自微信公众号:品玩(ID:pinwancool),作者:白宁,头图来自:视觉中国
十四年前,在靠木屑和雨水坚持36天之后,借助一张从废墟中直视镜头的照片,一只猪登上了各大媒体首页,它原本几个月后将送往屠宰场的命运也被彻底改变。
此后的十三年,亿万国人共同见证了它的不凡猪生:被博物馆收养,拥有自己的名字:小名“36娃儿”、大名“猪坚强”,一跃成为有产阶级之猪——拥有独属于自己的一室一厅和保健医生。它的生活也很规律健康,吃饭、睡觉、散步,然后不时接见一下来“探望”以及“求合影”的国内外粉丝。
汶川地震一年后,成都市劳动人民文化宫梦想剧场甚至举办了一场“猪坚强”版草根春晚,晚会播放了“猪坚强”获得2008年感动中国十大动物奖的MV,16名演员还表演了音乐剧《猪坚强36天的故事》。
2021年6月16日,14岁高龄的“猪坚强”因年老器官衰竭离世时,媒体报道郑重其事地使用了“遗体”这个称谓:“猪坚强的遗体被冰冻了起来”。无数网友在网上留言,感谢“猪坚强”的幸存“让许多人为生命的顽强所鼓舞,生发出对抗天灾的勇气”。“猪坚强”也因此成了人们对于汶川特大地震公共记忆的一部分,对那个特殊时刻活生生的注解。
天选之猪的生命轨迹也就莫过于此吧。
今年年初,猪再次经历了类似的特殊时刻。只是这一次,它并非以一个个体,而是作为一个族群,被写入了人类种族的共同记忆。
一、当代版“人面兽心”
回归到具体的事件中,这次的主角依然是一只猪,年满1岁,体重一百多公斤。
它的专属“保健医生”是eGenesis,美国的一家生物技术公司。为了完成使命,从出生以来,它就被严格控制饮食,甚至接受了10处基因改造:3个最容易引起人体免疫攻击的基因被敲除;1个生长基因被改写,让猪心脏不会继续长大发育;6个人类基因被插入到猪的基因组中,让它足以“骗过”人体的免疫系统,免于排异反应。
于是,在备受心力衰竭折磨的57岁老人大卫·贝内特濒临极限、机器和普通的心脏移植都无法维持他身体机能的正常运转后,这只猪以某种“救世主”的姿态出现,成为他获救的唯一可能。2022年新年前夕,贝内特拿到了FDA基于“同情使用”条款的特别许可,医院终于有机会为他移植这只猪的心脏。
这实际上是一次大胆的临床试验,人类有史以来第一次从猪身上接受培育的心脏器官。在此之前,人类移植异种器官从未获得过真正意义上的成功。患者存活最长的那次移植发生在1964年,美国医生将黑猩猩的肾脏移植给肾衰患者,同时给予硫锉嘌呤、激素、全身照射等治疗,因此患者在术后活到了史无前例的9个月。但更多的例子中,患者要么因为排异反应,要么因为凝血问题或跨物质感染,在几天十几天内死掉。
手术风险巨大,但贝内特别无选择。手术前,贝内特已卧床六周,他说:“要么死,要么做移植手术。这是我最后的选择。”
2022年1月7日,在马里兰大学医学中心,贝内特接受了异种器官移植手术。
为提高手术成功率,医疗团队在此之前已尝试将猪的心脏移植到50只狒狒体内进行实验,以研究免疫抑制、低血压、血液凝固受阻等术后反应的应对方法,并使用全新的灌注装置来保存猪的心脏,采用新开发的药物来抑制免疫系统,并预防排斥反应。
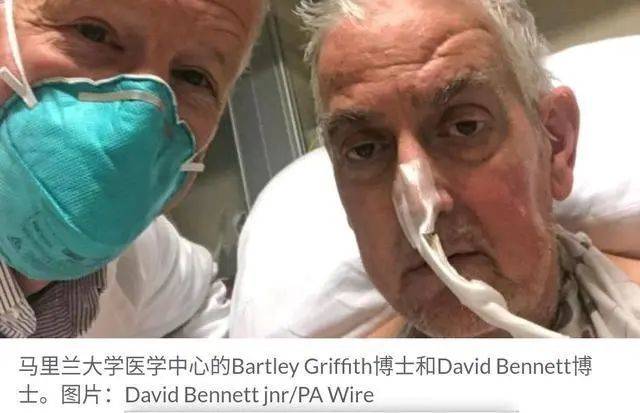
漫长的7小时手术之后,一颗经过基因编辑的猪心脏替换了贝内特那颗早已超负荷的属于人类的器官。
手术团队称,看见猪的心脏在人体里正常“工作”,那是“从未见过却梦寐以求的景象”。
手术后3天,患者仍需体外膜肺氧合(ECMO)替代一部分心脏泵血功能,但总体来说情况稳定,没有发生超急性免疫反应。手术后8天,马里兰大学向外界表示,患者已于2天前脱离ECMO,可以下地走路了。
根据之前专家们的分析:患者脱离ECMO是衡量手术成功的标志。那么,到目前为止,手术基本可以判定为成功——一次具有里程碑意义的成功,也因此在生命科学界引发激荡。人们公认,这将是医学史上跨时代的事件之一。这不仅意味着,器官衰竭患者拥有了更多的希望与机会,更意味着,在对生命探索的道路上,人类已可以取自然赋予的自身之外的躯体为己用。
二、为什么是猪?
此时回过头来看这次手术,我们可能会有种种疑问,首要的大概是:为什么偏偏是“二师兄”?虽然科学早已证明它并非人们以为的“蠢笨”,甚至颇为聪慧,但也完全没办法把一只猪和“人”联系在一起。
事实上,如果顺着异种移植的发端追溯到百年前,我们会发现,人们更认可的理想供体确实不是猪。
1905年,法国医生Princeteau将兔肾切成薄片植入肾功能衰竭的儿童体内。16天后,儿童死于排斥反应引发的肺部感染,手术宣告失败。这是世界上第一例临床异种移植手术。此后,1920年至1930年之间进行的百例异种移植手术都采用了猩猩作为供体:目标均是将猩猩的睾丸移植于人体。六七十年代异种移植再次掀起热潮,大多数使用的动物源还是灵长类,其中以猩猩或狒狒居多,并且集中于器官移植,不过也均以失败告终,存活效果极差。比较成功的只有两例:
一个是上文所述1964年所做的异种肾移植,6个病人接受了黑猩猩的肾,其中一位年轻的妇女存活9个月;
另一个就是著名的BabyFae,狒狒的心脏在她体内存活了20天。
八九十年代,随着SIV(猴免疫缺陷病毒)、埃博拉病毒、艾滋病毒等一系列杀伤力极强的灵长类病毒传染到人体,以及发现灵长类动物的器官移植到人体上会发生重组,甚至会产生更多有害病毒之后,人们开始警惕来自相近种族动物的威胁。再加上灵长类动物培育时间长,繁殖率低,饲养成本也较高,个体比人小等种种原因,人类很快放弃了在它们身上取得异种移植领域进展的希望,转向别的动物群体。
九十年代之后,猪是异种器官供体的最佳选择逐渐成为国际共识。人们发现,猪的基因、结构与人类有颇多相似之处。另外,猪心的大小与人的心脏差不多,其管道分布和动力输出也相似。华中科技大学同济医院心脏大血管外科副主任程才说,“猪的心脏和人的心脏结构很相似,从外科角度,可以说移植是‘没有难度的’。”
据《新英格兰医学杂志》报道,与非灵长类动物相比,猪与人类的关系较远,猪通过移植器官传播病原体的可能性比非灵长类动物要小得多。再加上猪产仔多,生长快,成本低,所有的一切都在提高猪在人们心中的评分——虽然这并不是一件值得猪高兴的事。
90年代,有几百个病人接受了临床异种移植试验,主要集中在细胞移植和体外治疗领域。许多病人接受了猪心瓣膜、猪胎神经组织、猪胎胰、岛细胞、猪骨等等。猪的神经细胞被植入患退化性神经疾病的病人体内,如帕金森症和亨廷顿舞蹈病;将急性肝衰竭病人的血液灌注进盛有猪的肝细胞的装置;将人的表皮细胞在鼠的细胞系中进行体外培养,用于取代严重烧伤病人的皮肤。根据后续跟踪,所有这三种类型的异种移植物的受体都存活了多年。
不过,当异种移植从细胞、组织扩大到整个器官时,依然存在巨大的医疗风险。这主要体现在两方面:一,猪的基因组携带内源性逆转录病毒,移植到人体后可能“有毒”;二,猪器官可能在患者体内引发免疫排斥反应——猪比人多了一种蛋白酶,这种蛋白酶可以把α-Gal基因置于细胞表面的分支糖链上,使人体免疫系统把α-Gal作为攻击的信号。
“这也是异种器官移植面临的最大问题之一——超急性排异反应。”同济医院器官移植研究所教授、《中华器官移植杂志》总编辑陈忠华说。所谓的超急性排异反应是指在器官移植后,以分钟和小时为单位的时间内发生的急性排异反应。
2013年,CRISPR-Cas9的基因治疗法被发明出来,从此编辑基因的难度大大降低,而且在几乎所有物种的细胞DNA上都能实现。这给免疫排斥和内源性逆转录病毒的解决提供了强大的武器。
2017年,研究人员用基因编辑技术“敲除”了猪基因组中的所有内源性逆转录病毒,免除了这些猪的器官移植给人类时出现相关病毒感染的风险。
去年10月,美国纽约大学甚至成功将基因编辑后的猪肾移植到了一位肾功能不全的脑死亡患者的大腿上,虽然体外观察实验只持续了三天,但移植术后,没有出现超急性排异反应,同时产生了尿液,肌酐水平下降,并正常“工作”了54个小时。对医学界,这无疑是一次莫大的激励。
当然,严格来说,这并不是一次真正意义上的临床异种器官移植,只能说是一种介于动物实验与临床研究之间的“亚临床试验”。但,“这一特殊模型的建立和试验研究是非人灵长类试验与临床研究之间必不可少的‘桥梁’”。
同样在去年秋天,美国阿拉巴马大学伯明翰分校(UAB)成功将转基因猪的两个肾脏移植到了脑死亡的人体内,并于今年1月20日在《美国移植杂志》发布研究结果。根据研究团队的说法,这只经过基因改造的猪肾被移植到脑死亡的成年人体内后,可正常被血液灌注, 就像人类同种异体移植一样。也就是说,两个物种间的交叉匹配首次得到验证。而当UAB团队对移植的猪肾进行再灌注时,肾脏甚至重新恢复了应有的色泽,“在23分钟内,它就开始排尿了。”
不过,虽然利用基因编辑技术“修改猪心脏”确实可以降低被人类免疫系统接受的难度,但是异种心脏移植的排斥几率毕竟远远大于同种移植,因此制定抗排斥药物方案、预防感染肿瘤等并发症依然是关键。另外,成年猪的心脏偏大,基因修饰可以使其停止发育,但是能否精准地实现供受体之间心脏大小及功能的匹配,却很难说。
而对已被评价为“成功”的1月7日猪心脏移植手术,北京大学第三医院普通外科主任修典荣表示,手术的确显示,敲除α-Gal后能够逃避超急性排斥反应,但引起超急性排斥反应的靶点不只α-Gal,还有CMAH基因、β4GalNT2基因和ASGR1基因等,“将相关基因都敲除,或许才能把异种移植超急性排斥反应降到最低。”
此外,肝脏功能复杂,仅以蛋白合成来说,动物肝脏合成的白蛋白与人白蛋白并非完全相同。
因此,此次将基因改造后的猪心脏移植到人的体内,诚然是一种具有里程碑式的科学尝试,但这“并不意味着未来一大批心衰患者可以通过移植‘猪心脏’来挽救生命”,要在临床上实现应用,异种心脏移植还有很多难关要过。
不过,即便如此,异种器官移植依然给患者带来了极大的希望。
全球移植器官严重短缺已是不争的事实。据世界卫生组织(WHO)统计,全世界每年大约有200万人需要器官移植。阻碍这些患者的最大难题不是技术(从手术技术上来说,心脏移植基本已没有任何难度,目前手术成功率都在95%以上,手术后一年的存活率高达94%-95%),而是器官供体的严重短缺。
根据美国器官获取和移植网络的数据,目前美国约有11.7万人正在等待移植器官,只有少数人能够真正等到器官。在我国,求大于供的问题则更为严重。相关数据统计显示,我国每年超过30万人的器官出现衰竭,有移植手术需求,但受器官来源、经济条件、医疗条件的限制,每年仅有约1万人能够接受移植手术,供求比几乎达到了1:30。

所以,医学界面临的主要问题是:心脏从哪里来?
于是,“为了解决移植器官短缺的困境,科学家们将视线转向了动物器官。”
也就是说,在未来,猪在填补人类身体的饥饿之后,可能还要被用于修补人类身体的缺损。
三、真正的挑战
去年10月份,当媒体为那只移植后在体外存活了54个小时的猪肾欢呼时,陈忠华缺认为:“这并不是科学技术的进步,只是伦理学突破,但具有明显的预示性临床意义。”
在此之前,异种器官移植已经积累了充分的动物实验数据。陈忠华认为,这种手术在医疗技术上并不难,而为何2~3年后才得以实现,其中最重要的原因就是,伦理学障碍以及知情同意前提下的标准试验的寻找和征集。
脑死亡是美国终止治疗的法定标准,但在我国,脑死亡临床判定虽已有了自己的医学标准及规范,但普及性应用仍然缺乏相应的政策、法规、法律支撑。
另外,异种器官移植的安全性问题还需要进一步检验,比如需要考虑跨物种感染对个体和人群健康的影响。有研究显示,有些动物携带的病毒、细菌病原体在携带者体内不发病,但对人类也许是致命的,也可能与人体病毒基因重组产生新的病毒导致疫病的产生和流行。因此,建立对接受了异种移植的人群的终身观察也很有必要,需要对他们献血、器官捐献等行为进行限制和监控。
器官移植是一项复杂的系统工程,除供体短缺问题,还有高昂费用、急性排斥反应、免疫抑制剂使用的副作用以及免疫抑制剂使用后的感染问题。“有的患者器官移植后长期效果满意,但也有患者会出现原发疾病复发问题。此外,移植后患者的长期管理随访也不容忽视。”修典荣说。
跨物种移植还涉及人类尊严、人格同一性、技术可及性和动物福利等问题,这必然会对伦理道德提出更高的要求。如果控制不当,甚至会影响对人类这个物种的认同。
公元1世纪,普鲁塔克提出了哲学史上的一个经典问题:如果忒修斯的船上的木头被逐渐替换,直到所有的木头都不是原来的木头,那这艘船还是原来的那艘船吗?
而在异种器官移植领域,“忒修斯之船”完成了从抽象理论到具象问题的跨越:当人的身体慢慢被其他物种的器官填充,那么我还是以前的我吗?甚至还能称之为一个人吗?
当然,人类真正面临这样的问题可能是在很多很多年以后,对于现在的我们而言,更紧迫的问题可能是以怎样的姿态与猪相处。毕竟,它确实已经在口粮的基础上加持了救命恩猪的属性——一个真正意义上的人类之友。
参考资料:
雷瑞鹏《异种移植:哲学反思与伦理问题》
中国科技报《世界首例异种移植尚需谨慎乐观》
《独家 | 首例猪心移植一周后,患者已脱离ECMO可下地行走》
https://mp.weixin.qq.com/s/kuXtkrOSvqTZ-pe4YhuivA
https://onlinelibrary.wiley.com/doi/10.1111/ajt.16930
本文来自微信公众号:品玩(ID:pinwancool),作者:白宁

