据央视新闻报道,7月18日,最新一批约86万剂”复必泰”疫苗已运抵香港。本批疫苗由复星医药(600196.SH)联合BioNTech(纳斯达克,代码BNTX)生产,并在德国Baxter厂房封装。
一周前的7月12日,复星医药才刚刚公告,控股子公司复兴实业与台积电、鸿海、永龄基金会和裕利医药签订协议,将向对方销售合计1000万剂mRNA新冠疫苗。而早在今年1月和2月,香港和澳门已先后批准,后分别向复星医药订购了750万剂和40万剂mRNA新冠疫苗。


▲来源:复星医药公告
公告里的mRNA新冠疫苗,就是被外界寄予厚望的复星医药与全球领先的德国生物技术公司BioNTech共同开发的BNT162b2疫苗。双方于去年3月签订协议,截至去年10月,复星医药为其累计投入研发费用6619万元(未审计)。之所以有多个名称,与药企之间的合作机制有关。
德国BioNTech是全世界范围内生产mRNA 疫苗的平台型生物技术公司之一,但生产能力和商业化能力不足。所以,在去年3月,其先后与复星医药(通过全资子公司复星医药产业)和世界500强企业辉瑞制药(纽交所,代码PFE)签订协议,共同开发和商业化mRNA新冠疫苗。其中,复星医药负责大中华区(含港澳台),辉瑞负责全球其他区域。


▲来源:BioNTechSE公告
今年5月,复星医药全球研发中心总裁兼首席医学官回爱民博士,在接受央广网采访时介绍,mRNA技术路线研发周期短、能够快速开发新型候选疫苗;完全合成,没有任何病毒成分,也就没有感染风险;而且虽然技术壁垒很高,但是技术壁垒突破后,生产工艺简单,可以大批量地生产。
虽然截至今年5月,已经有超过65个国家和地区授权或临时授权使用。但作为mRNA技术在疫苗领域的第一款产品,BNT162b2的安全性一直都面临争议。
有人质疑,也有人关注。
光大证券曾在研报中提到,7月14日,复星医药(港股)在股东大会上表示,药监局对“复必泰”的审定工作已经基本完成,专家评审已经通过了,目前正在加紧进行行政审批阶段。据“财新网”报道,复星医药董事长吴以芳称,在供货问题上,复星医药已经与BioNTech提前启动生产准备工作,”复必泰”疫苗一旦获批,就能第一时间供应到中国国内。


▲来源:复星医药官网
而对于盛传的将被作为加强针接种的问题,接近复星医药的行业人士称,目前还是未知,复星医药自己决定不了。
“复必泰”如此受关注,和其有效性有关。今年4月辉瑞和BioNTech宣布,BNT162b2有效率为91.3%。不过,不良反应也时有见诸报端。
抢在辉瑞之前谈合作
事实上,复星医药与BioNTech的合作,远比公告来得跌宕起伏。
回爱民在接受央广网采访时称,在自己2017年11月加入复星医药之后,开始了解mRNA技术。2020年1月在对所有疫苗的技术路线筛选和评估之后,最终决定与BioNTech合作。同年3月16日,复星医药与BioNTech正式宣布签订国内合作协议。次日,辉瑞官宣与BioNTech达成中国境外区域的合作协议。
要知道,辉瑞与BioNTech本就是合作关系,要抢在辉瑞之前达成合作并不容易。在签订协议之前,回爱民曾借BioNTech联合创始人兼CEO Ugur Sahin到波士顿见投资人的机会,争取来吃一顿盒饭的间隙,与对方进行了深入交流,为达成合作打下基础。
在达成战略合作的同时,复星医药控股子公司复兴实业还与BioNTech签订《约束性条款书》。复星实业拟以31.63美元/股的价格认购BioNTech新增发行的158.08万股普通股,认购金额约为5000万美元。


▲来源:复星医药官网
2020年11月,辉瑞向美国药监局提交紧急使用申请,并在次月获批。复星医药也在紧锣密鼓准备。
同年11月24日,复星医药在中国江苏泰州和涟水,启动BNT162b2国内的II期临床试验。随后便披露增发公告,拟募资不超过49.83亿元(后修改为44.84亿元),其中22.2亿元用于创新药物临床、许可引进及产品上市相关准备,包括mRNA新冠疫苗的引进工作。在今年6月的反馈意见回复报告的二次修订稿中,复星医药明确将总募集资金的7.24%,即3.25亿元,用于mRNA新冠疫苗。
紧接着在12月,复星和BioNTech签订《许可协议修正案一》和《供货协议》,就区域内 mRNA 新冠疫苗的销售供货、提成分享等事项达成进一步约定。今年5月,双方拟投资设立合资公司。复星医药称,将提供年产能10亿剂mRNA新冠疫苗的生产设施,并作为出资的一部分注入合资公司。
对业绩影响几何?
辉瑞疫苗在去年12月被美国药监局批准紧急使用后,已经在数十个国家接种。根据辉瑞2021年一季报数据,一季度营收145.82亿美元,同比增长42%,其中BNT162b2的收入为35亿美元,如果剔除BNT162b2,营收仅同比增长8%。
同时,根据截至4月中旬所签订单,辉瑞预计BNT162b2将在2021年全年,为其带来260亿美元的收入。辉瑞同时强调,该数据会随着新签合同的增加而有进一步的调整。

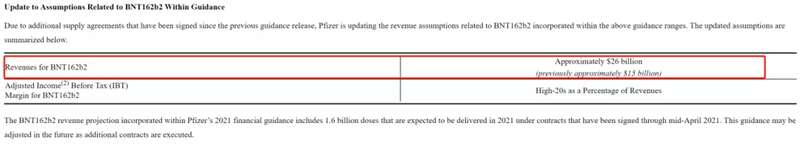
▲来源:辉瑞2021年一季报
康希诺(688185.SH)的业绩同样受益于新冠疫苗的上市。根据康希诺2021年上半年业绩预告,预计2021H1营收在20亿-22亿之间,同比增加495.33-544.96倍之间;实现归母净利润9亿-10.5亿元,一举脱离连续多年的亏损泥潭。


▲来源:康希诺公告
公告提到,报告期内,重组新型冠状病毒疫苗(5型腺病毒载体)获得墨西哥、巴基斯坦等国的紧急使用授权及中国附条件上市批准,这对收入及归母净利润产生了积极影响。
复星医药也会完美跟随吗?
一季报显示,复星医药2021Q1营收同比增长37%,归属净利润同比增长46.78%,经营活动现金流净额同比增长92.62%。复星医药在公告中解释称,业绩增长主要是收到中国香港及中国澳门政府mRNA新冠疫苗首付款以及支付相关采购支出与研发销售费用后的净贡献。不过,复星医药并未将新冠疫苗的贡献分列显示。
事实上,虽然新冠疫苗带来了不少好消息,比如,今年三月,欧洲药品管理局批准将BNT162b2储存在-25℃至-15℃两周。不过,摆在“复必泰”面前的未知还很多。
首先,复必泰是否获批、何时获批,目前还是未知数。虽然吴以芳称正在走行政审批,但最终需要等待官方确认。其次,获批后是否真的可以第一时间供应?众所周知,疫苗的生产要求很高,即使生产设施已备好,也还有后续的现场检查、环评等程序,这都需要时间。在上市后,疫苗的运输和储存也是重要环节,尤其是mRNA疫苗本身就有较高的保存要求。
考虑到目前我国附条件上市或紧急使用的新冠疫苗达到5款,已经累计注射逾14亿剂。复必泰的需求量有多大?针对新冠病毒变种及疫苗产生抗体的持续性问题,多家药企都在研究加强针,竞争并未消失。还有上文提到的安全性问题,在传统的灭活疫苗(国药和科兴疫苗是灭火疫苗)面前,mRNA疫苗面临的检验还太少,人们的接受程度有多高?
当然,理论上讲,待复星医药mRNA疫苗生产设施准备完毕后,还可以为辉瑞生产BNT162b2,但这都是比较遥远的事情,需要双方甚至与BioNTech签订三方新的协议。
而且,自今年4月以来,复星医药已上涨逾90%。股价提前涨了,当“复必泰”在国内正式上市,会不会见光死?也未可知。

