无论是从首个获得美国FDA批准的癌症疫苗来看,还是通过肿瘤疫苗自救的诺奖得主拉尔夫·斯坦曼以及积极抗癌的马西亚的失败经历,癌症疫苗的发展史写满了悲壮的故事。到底癌症疫苗靠谱不靠谱,能否成为治病救人的良方,此前癌症疫苗的设计存在哪些短板?本文会逐一进行解读。在本文作者看来,癌症疫苗科学性没啥毛病,但离临床广泛应用还有距离。
本文来自微信公众号:赛先生(ID:mrscience100),作者:丁零(科普写作者、生物化学博士),原文标题:《癌症疫苗不靠谱?实际上,这是一部屡败屡战的奋斗史》,头图来自:视觉中国
当今炙手可热的癌症免疫治疗排行榜中,除了出镜率高的免疫检查点PD-(L)1抑制剂和细胞免疫疗法(CAR-T等)外,治疗性癌症疫苗不但榜上有名,还享有癌症免疫疗法圣杯的盛誉。
预防性癌症疫苗伴随HPV疫苗的普及而广为人知,原来癌症疫苗还有治疗功能?这神乎其神得像天方夜谭。
更为吊诡的是,一方面临床喜讯频频传来,比如癌症疫苗帮助晚期卵巢癌摆脱癌症困扰高达5年[1],又比如黑色素瘤患者接受疫苗后肿瘤完全消失,且25个月内无复发[2]。治疗小鼠表现更为惊人:2018年就有报道癌症疫苗根治率高达97%[3],近期又热传癌症疫苗将治疗率提升275%[4]。部分媒体报道虽有标题党嫌疑,但引用数据都是发布在正儿八经的学术期刊上。
另一方面,治疗性癌症疫苗研发几十年举步维艰,冷冷清清只有一款产品在美国获批,上市后也不大受待见。
此外,因为“魏则西事件”被公众了解到的癌症疗法DC-CIK,其原理和癌症疫苗有相似之处,都是利用情报员——树突状细胞收集肿瘤信息(抗原)速递给极具杀伤力的主力军T细胞。收到情报后,T细胞便可精准围剿癌细胞。
令人不解的是,和魏则西人财两空的悲剧不同,诺贝尔奖得主拉尔夫·斯坦曼(Ralph Steinman)胰腺癌晚期确诊后,利用自己研发的树突细胞癌症疫苗自救,成功存活了超过4年,而大多数类似患者往往撑不过一年。
难道癌症疫苗还看人下菜碟?如果真是这样,圣杯的光环可就德不配位了。那真相究竟是怎样,癌症疫苗到底靠谱不靠谱?
屡败屡战的奋斗史
癌症疫苗发展史可谓荆棘塞途,以下几段轶事便道出此间艰辛。
癌症免疫疗法史上的“黑色星期三”
作为美国首个也是迄今为止唯一获批的治疗性癌症疫苗,Provenge的境遇怎一个难字了得。
2007年,Provenge凭借乐观的临床试验数据(对照组相比,患者寿命延长了4.5个月;25.9个月VS. 21.4个月;p=0.01)[5],得到到了美国FDA大多数成员的投票赞成(13:4)。
但投反对票的少数在癌症领域非常有影响力,对Provenge临床有效性提出质疑:生存率有改善,但肿瘤大小并没有显著变化。
于是,反对者发起声势浩大的公关活动,指责投赞成票的人在癌症药物这档子事上压根一窍不通,才会轻易被这种刺激免疫系统治疗癌症的古老概念诱骗。Provenge疫苗安全性问题不大,也就是大概率治不死患者,但这不能粉饰它在疗效方面的“乏善可陈”[6]。
![Provenge临床三期数据,数据来源:[5]<br>](https://i.aiapi.me/h/2021/06/02/Jun_02_2021_11_15_59_9631129591310568.png)
迫于形势和舆论压力,FDA只能宣布Provenge投票作废,并要求提供更多临床数据支持。一石激起千层浪,前FDA官员愤慨之下,在《华尔街日报》上将此次事件称为癌症免疫疗法史上的“黑色星期三”,扼腕叹息这将使得免疫疗法一夜回到解放前(dawn of a new era in cancer immunotherapy was driven back into thenight)[7]。之后Provenge反对者还因此收到威胁邮件。
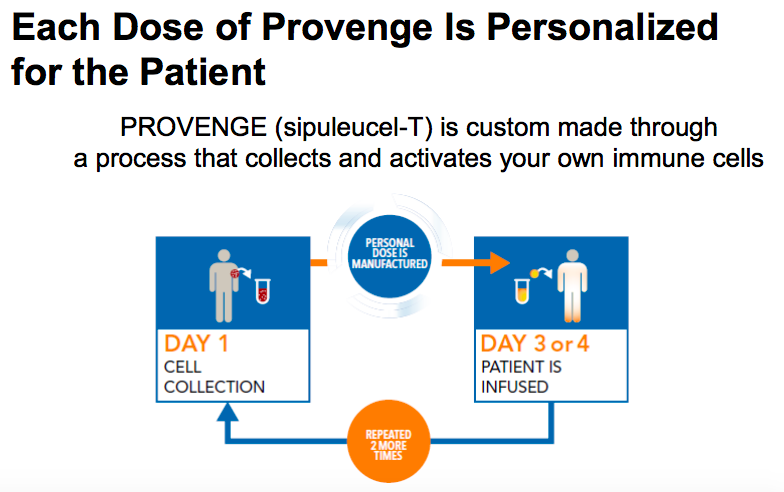 Provenge肿瘤疫苗基本原理
Provenge肿瘤疫苗基本原理
兜兜转转三年,直到2010年,Provenge才获得FDA的批准,开创了癌症免疫治疗新时代。然而好景不长,Provenge的开发商Dendreon过于自信,在2011年撕毁与巨头GSK的合作协议,独自承担Provenge生产工作后才发现力不从心。再者,高昂的价格(9.3万美元)、复杂的治疗方案劝退了不少医生和患者,Provenge销售额2011年只有2.14亿美元,和当初夸下海口的3.5亿~4亿相差甚多。到2014,因无能力偿还巨额债务,Dendreon经宣布破产,其命运走势让人大跌眼镜。
雪上加霜的是,同样也是治疗前列腺癌的阿比特龙和恩杂鲁胺分别在2011年和2012年上市,凭借亲民的价格(4万美元左右)以及口服药的优势大卖。阿比特龙获批后第二年的销售额就冲到9.6亿美元,Provenge只能望其项背,之后不得不战略性捆绑,阿比特龙/恩杂鲁胺加上Provenge,死亡风险降低45%,总生存期延长14.5个月(35.2个月 vs20.7个月;p<0.0001)[8]。
Provenge在疗效这个刚需上表现平平,又缺乏便利性,在竞品上市后被市场抛弃也是很自然的事。设想下,如果Provenge早上市10年,在没有太多竞争情况下应该能斩获不错的业绩,市场反应积极既然激发对癌症疫苗更大的热情,那整个领域就能形成良性循环加速发展。
只可惜历史终究无法重写。
以身试药是疯狂还是笃信?
汤姆·马西亚(Tom Marsilje)和斯坦曼一样,同是研究癌症的科学家,同患癌症,也同样在绝境中寄希望于癌症疫苗。
马西亚的一生似乎都在和癌症进行斗争。1999年,马西亚研究生毕业前,母亲苔丝(Tess)被诊断出患有晚期胰腺癌。母亲的不幸去世,坚定了马西亚成为癌症药物研发科学家的决心,之后毅然搬去圣地亚哥加入诺华制药。
2012年6月4日对马西亚来来说是一个充满戏剧性的日子,一方面他参与的癌症药物Zykadia取得重大突破,这一天是正式对公众发布的日子,然而也在同一天,汤姆被诊断出患有三期结肠癌。
汤姆太清楚,化疗并不能改变他的命运,体内肿瘤迟早有一天会爆发,而在一切为时已晚之前,他将尽一切可能战胜癌症,为自己争取更多陪伴妻子和两个女儿的时间。
确诊后,马西亚穿上跑鞋,通过每隔一天跑步六英里来增强免疫力,并设法完成了一场半程马拉松比赛。他还成为结肠癌患者社区的倡导者,分享自己对治疗方案以及临床机会的见解,给其他患者提供帮助。
马西亚调研各种临床机会后,认为免疫疗法是最有希望。遗憾的是大部分临床试验都不接受有继发性癌症的患者,因为担心会混淆试验结果,而马西亚在肠癌后又被发现了黑色素瘤,因此不符合要求[9]。
马西亚并没有放弃,几经周折后争取到参加个性化疫苗临床试验后,马西亚兴奋地说:“我愿意将希望寄托在10%或20%的机会上,因为这肯定好于零。”如果疫苗奏效的话,有可能使马西亚癌症变成可控制的慢性病,甚至将其消灭。
只可惜,分析完马西亚癌细胞数据,筛选设计疫苗抗原后,他的病情恶化最终无法参与临床试验,于2017年去世。也留下了一个无从得知的答案:癌症疫苗是否能在马西亚身上创造奇迹?
斯坦曼和马西亚选择都是癌症疫苗,但后者加入了量体裁衣的元素,称为个性化疫苗。所谓个性化疫苗就是将患者体内的癌细胞研究个透(测序),鉴定出每个患者癌细胞的特征(特异性抗原),再根据特征信息设计疫苗。疫苗在患者体内可以给情报员树突状细胞提供癌症特征,树突状细胞再将情报快递给T细胞,于是T细胞便拿着癌细胞画像,找到善于伪装的癌细胞后火力全开,一举歼灭。
![癌细胞抗原呈递。图片来源:[10]<br>](https://i.aiapi.me/h/2021/06/02/Jun_02_2021_11_16_04_9631134619631313.png)
个性化疫苗获得里程碑式突破来自2017年发表在《自然》期刊上的两篇研究[2, 11],一篇来自Dana-Farber癌症研究所,另一篇则是约翰内斯堡大学/BioNTech的成果。隔着一个大西洋两个独立小组的疫苗设计虽不尽相同,但殊路同归:接受癌症疫苗治疗后,一半以上患者肿瘤完全消失,复发患者联合免疫检查点抑制剂后,肿瘤也完全消失。甚至在癌症疫苗治疗4年后,疫苗引发免疫反应仍然强大,并能有效地控制癌细胞[12]。
而个性化疫苗的发展离不开一个重要的功臣:新抗原。
大有来头的新抗原
多年来,共享肿瘤抗原一直是癌症疫苗的重点。毕竟共享就意味着可以批量生产,比量体裁衣成本更低。为此,美国还专门成立了一个工作组制定共享肿瘤抗原的优先级清单[13],名列前茅的包括业内比较熟悉的WT1,MUC1,HER-2等等。
![肿瘤抗原优先级排序,数据来源:[13]<br>](https://i.aiapi.me/h/2021/06/02/Jun_02_2021_11_16_05_9631136068605339.png)
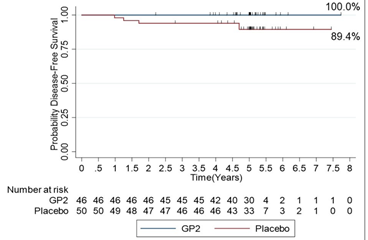
这些官方认证的抗原确实有不错的早期临床表现,最受关注之一的是2020年圣安东尼奥乳腺癌研讨会上一款名为GP2(HER2蛋白一段多肽)疫苗横空出世,乳腺癌患者接受治疗后,随访5年的无病生存率(DFS)为100%,复发率为0%,因此GP2疫苗的东家GLSI当天股票上涨20多倍,因为波动太过激烈停牌不下20次。
当然功败垂成的案例也层出不穷,比如针对抗原PSA的癌症疫苗Prostvac在临床二期明明可以延长前列腺患者生存期8.5个月,到临床三期关键时候就大掉链子,对生存期并没啥影响,只能提早终止临床[14]。
不管是HER2还是PSA,虽然呈现了癌细胞的重要特征,但在正常细胞上也含蓄表达(水平相对较低),这就埋下了两个隐患:第一这些抗原引发的免疫反应可能误伤正常细胞,产生副作用,第二作为自身起源抗原,免疫系统对其往往有一定耐受性,也就是把它们当作自己人,未必能启动免疫反应。
随着对肿瘤认识的日益加深,科学家发现癌细胞突变后,会产生独特表达的新抗原(neoantigen)。这就意味着,开发基于新抗原的疫苗可以完美解决了上述两大隐患。既能对抗耐受,引发真正的肿瘤特异性免疫反应,又能避免正常细胞无辜躺枪。顺着这条思路,下一代测序和生物信息学工具又提供实操层面的技术支持,新抗原个性化疫苗已经不再遥不可及[15]。
治疗不同癌症,利用新抗原这把利剑各有各的烦恼。诸如黑色素瘤和肺癌等“热肿瘤”,太热衷于突变,因此有成百上千的新抗原,然而其中只有一小部分能顺利落入免疫细胞法眼,进而激发肿瘤特异性免疫反应。也就是说,每个新抗原就好比一张彩票,如果随机挑选的话最后中奖几率并不是很高。
所以设计疫苗时最重要的一步就是确定抗原优先级。如何辨别最有可能中奖的新抗原,这就需要依赖前沿的深度机器学习和AI技术。最后谁能脱颖而出,天花乱坠吹牛都没用,技术才是硬道理。
当然,抗原孰强孰弱也不全是两眼一黑无迹可循,科学家发现了一些端倪,比如说,克隆(clonal)突变比亚克隆(subclonal)突变引发免疫的几率大一些[16](如果癌细胞突变是一棵进化树,克隆突变是主干,亚克隆是旁枝),又比如更为暴烈的突变(移码插入和缺失等)可能比温和的单位点突变更有效。
和“热肿瘤”恰恰相反,油盐(T细胞)不进的“冷肿瘤”只有非常少的新抗原。典型代表包括成胶质细胞瘤、胰腺癌和卵巢癌等。
选择太多虽然容易挑花眼,但总比没得挑好,所以这些年新抗原疫苗的关键临床都是针对黑色素瘤,大量的变异给了疫苗研究者很大的空间去选择抗原。对于冷肿瘤,基于新抗原的开发难道就是一条死胡同?
兵来将挡水来土掩,这些高冷的癌细胞虽然难搞,也不是牢不可破。就连最致命的成胶质细胞瘤的也有一款名为AV-GBM-1的疫苗表现不错:接受AV-GBM-1治疗患者的15个月的总生存率为76%,只有48%[17]。
除此之外,癌症疫苗还可在“冷”肿瘤中诱导免疫反应,从而有可能将其转变为“热”肿瘤,给PD-1抑制剂等创造一展拳脚的条件。
寻找理想型癌症疫苗
如果要给理想型癌症疫苗画像的话,至少得满足以下几项:1)消退肿瘤,并尽可能根除残留;2)建立持久的抗肿瘤记忆;3)避免非特异性或不良反应。
回顾历史,成功案例都相似,失败案例各有各的不同。有些是从一开始选择抗原时挑了战斗力弱的,直接输在起跑线上,有些挑选抗原这步棋没走错,却缺乏有效的帮手(佐剂)助疫苗一臂之力,还有些抗原和树突状细胞合不来,树突状不愿意给其一席之地,更别提招募T细胞过来协助。
目前正在进行的个性化临床试验,按照疫苗递送方式,大致可以分为三大类:多肽、RNA/DNA、和树突状细胞。
从下图可以看出,万变不离其宗,这三种类型归根结底就是让癌细胞抗原能顺利扎营在树突状细胞上。如果是树突状细胞作为传递方式,相当于大部分安装工程都得在体外完成,如果选择RNA/DNA就比较取巧(偷懒),体外简简单单合成以后,丢到人体内,让人体细胞自己完成剩下的工作,但却有抗原不能顺利被树突状细胞接纳的风险。
![不同癌症疫苗类型,图片来源:[18]<br>](https://i.aiapi.me/h/2021/06/02/Jun_02_2021_11_16_11_9631141470959018.png)
DNA和RNA生产流程都比较简单,但RNA疫苗递送至细胞后,可立即作为蛋白质生产的模板,并且还可以对RNA进行工程改造,实现自我扩增(比如近期受关注的Ziphius Vaccines平台),最为重要的是,避开了DNA整合到患者基因组的风险(注释:只是理论上可能,没有确凿临床证据),所以相对来说,RNA得到的关注更多。
理想型癌症疫苗还有一个优秀品质,就是乐于交友,毕竟单打独斗从来都不是智者的选择。除了和PD-1抑制剂等双剑合璧联合治疗外,更为亲密的合作伙伴(佐剂)包括GM-CSF,TLR激动剂等,其目的就是增强机体对抗原的免疫应答。比如上市的Provenge就得到了GM-CSF的强力支持。
结语
个性化癌症疫苗虽然取得一定进展,但还不能彻底唤醒了人体自带的抗癌武器[19-21]:在108例实体瘤患者中,只有有9例对癌症疫苗有反应(ORR 8.3%)[20];另一项名为NT-001研究中,ORR最高可达59%,患者存活却没有显著改善[19],毕竟患者能活多长时间才是考量的黄金标准。
此外,个性化癌症疫苗成产周期长和成本高这个短板不容忽视。在已经非常拥挤的免疫疗法临床试验,争取患者竞争非常激烈(强调一下:患者资源非常珍贵,收费参加临床都是诈骗行为),这可能会限制个性化疫苗开发,而倾向更适合大规模生产,成本更低的通用疫苗。
幸运的是,伴随新抗原更为精准的预测,跨学科之间的合作,比如加州理工大学化学家James Heath就召集各领域人才共同设计了预测新抗原的微流控设备[22]。相信只要有足够的想象力,个性化疫苗将会越走越远。既然电脑可以从最早几十吨到现在掌上平板,个性化疫苗从现如今几个月周期到几天甚至几个小时也不是没有可能。
另一个可以另辟蹊径的破局方法就是取预防和治疗的折中,也就是说当癌症还处在良性/早期阶段,借助癌症疫苗来阻止进一步恶化。事实上,这个思路在宫颈癌和结肠癌癌变前患者中都有不错的表现[23, 24],或者像上文提到的GP2疫苗的策略一样,在病人接受其他疗法病情稳定后作为辅助疗法来预防复发。
![基于新抗原癌症疫苗和细胞疗法的潜在价值,数据来源:[25]。<br>](https://i.aiapi.me/h/2021/06/02/Jun_02_2021_11_16_11_9631141712994516.png)
回到文章最初的问题,癌症疫苗靠不靠谱,这取决于靠谱的定义。癌症疫苗科学性啥毛病都没有,但离临床广泛应用还有距离。如果指望在短期内成为彻底治愈癌症患者的救世主,那难免要失望。
参考文献
1. PersonalizedTumor Vaccine Shows Promise in Pilot Trial. 2018.
2. Ott, P.A., et al., An immunogenic personal neoantigen vaccinefor patients with melanoma. Nature, 2017. 547(7662): p. 217-221.
3. Sagiv-Barfi, I., etal., Eradication of spontaneousmalignancy by local immunotherapy. Sci Transl Med, 2018. 10(426).
4. Koerner, J., et al.,PLGA-particle vaccine carrying TLR3/RIG-Iligand Riboxxim synergizes with immune checkpoint blockade for effectiveanti-cancer immunotherapy. Nat Commun, 2021. 12(1): p. 2935.
5. Small, E.J., et al.,Placebo-controlled phase III trial ofimmunologic therapy with sipuleucel-T (APC8015) in patients with metastatic,asymptomatic hormone refractory prostate cancer. J Clin Oncol, 2006. 24(19): p. 3089-94.
6. DeVita, V.T., Jr., The Provenge decision. Nat Clin PractOncol, 2007. 4(7): p. 381.
7. Thornton, M., Black Wednesday at the FDA. The WallStreet Journal 2007.
8. Real-World Study of 6,000+ Medicare Patients with Advanced ProstateCancer Shows Adding PROVENGE® (sipuleucel-T) to Treatment Regimen Reduced Riskof Death by 45%. Businesswire, 2020.
9. Robbins, R., A cancer researcher races to find a cure —for his own incurable cancer. STAT, 2016.
10. Sun, C. and S. Xu, Advances in personalized neoantigen vaccinesfor cancer immunotherapy. Biosci Trends, 2020. 14(5): p. 349-353.
11. Sahin, U., et al., Personalized RNA mutanome vaccines mobilizepoly-specific therapeutic immunity against cancer. Nature, 2017. 547(7662): p. 222-226.
12. Hu, Z., et al., Personal neoantigen vaccines inducepersistent memory T cell responses and epitope spreading in patients withmelanoma. Nat Med, 2021. 27(3):p. 515-525.
13. Cheever, M.A., etal., The prioritization of cancerantigens: a national cancer institute pilot project for the acceleration oftranslational research. Clin Cancer Res, 2009. 15(17): p. 5323-37.
14. Gulley, J.L., et al.,Phase III Trial of PROSTVAC inAsymptomatic or Minimally Symptomatic Metastatic Castration-Resistant ProstateCancer. J Clin Oncol, 2019. 37(13):p. 1051-1061.
15. Zaidi, N., Can Personalized Neoantigens Raise the TCell Bar? Cell, 2020. 183(2): p.301-302.
16. McGranahan, N., etal., Clonal neoantigens elicit T cellimmunoreactivity and sensitivity to immune checkpoint blockade. Science,2016. 351(6280): p. 1463-9.
17. AIVITA Biomedical's Phase 2 Glioblastoma Trial Shows ImprovedProgression Free Survival.
18. Saxena, M., et al., Therapeutic cancer vaccines. Nat RevCancer, 2021.
19. Ott, P.A., et al., A Phase Ib Trial of Personalized NeoantigenTherapy Plus Anti-PD-1 in Patients with Advanced Melanoma, Non-small Cell LungCancer, or Bladder Cancer. Cell, 2020. 183(2):p. 347-362 e24.
20. Lopez JS, e.a., A phase Ib study to evaluate RO7198457, anindividualized neoantigen specific immunotherapy (iNeST), in combination withatezolizumab in patients with locally advanced or metastatic solid tumors. .Cancer Res., 2020. 80:CT301. .
21. Burris HA, e.a., A phase I multicenter study to assess thesafety, tolerability, and immunogenicity of mRNA-4157 alone in patients withresected solid tumors and in combination with pembrolizumab in patients withunresectable solid tumors. 2019.
22. Ma, C., et al., A clinical microchip for evaluation ofsingle immune cells reveals high functional heterogeneity in phenotypicallysimilar T cells. Nat Med, 2011. 17(6):p. 738-43.
23. Trimble, C.L., etal., Safety, efficacy, and immunogenicityof VGX-3100, a therapeutic synthetic DNA vaccine targeting human papillomavirus16 and 18 E6 and E7 proteins for cervical intraepithelial neoplasia 2/3: arandomised, double-blind, placebo-controlled phase 2b trial. Lancet, 2015. 386(10008): p. 2078-2088.
24. Kimura, T., et al., MUC1 vaccine for individuals with advancedadenoma of the colon: a cancer immunoprevention feasibility study. CancerPrev Res (Phila), 2013. 6(1): p.18-26.
25. Schumacher, T.N., W.Scheper, and P. Kvistborg, CancerNeoantigens. Annu Rev Immunol, 2019. 37:p. 173-200.
本文来自微信公众号:赛先生(ID:mrscience100),作者:丁零(生物化学博士,青年写作者。曾就职霍华德·休斯医学研究所及MD安德森癌症中心,现从事咨询行业。)

