北京时间4月1日消息,当我们身体中的细胞失去其生物学“身份”时,肿瘤就会开始生长。最近,科学家开发出了一种很有前景的治疗方法,或许可以帮助肿瘤细胞恢复“自我意识”。
大多数癌症患者并不是死于所谓的原发肿瘤(癌症起源的部位)。一旦发现原发肿瘤,外科医生就会将其切除,或采用化疗、放疗或免疫疗法等手段将其杀死。然而,癌细胞具有不可思议的移动能力。它们会穿过血管壁,搭上血液的便车,前往体内其他的部位。例如乳腺癌最容易转移到肝脏、肺、骨骼和大脑。一旦到达这些部位,它们就开始繁殖,变得几乎不可能杀灭。
病人死亡源自于癌症的转移,病人死因可能是大脑肿胀,或是肺部充满液体,还可能是肝脏被肿瘤取代,无法再发挥功能,患者因此会出现肝衰竭。当癌细胞在器官中扩散,而且数量超过正常细胞时,真正糟糕的情况就开始了。目前,研究人员正在请求外界的肿瘤捐赠以供更多研究。
细胞和分子生物学家大卫·斯佩克特特专注于破解恶性肿瘤细胞的内部运作机制,主要研究这些细胞如何移动并侵入其他器官。换句话说,他研究的是乳腺癌细胞的“隐秘生活”以及如何克服它们的方法。斯佩克特认为,他可以用一种正在研发的药物来阻止正在移动的癌细胞。这些细胞可能经历了某种身份危机;它们忘记了自己是谁,从而在我们的血液中肆意流窜。当这种新研发的药物完善之后,就可以对细胞进行重新编程,让它们记住自己是谁,并开始正常的活动。
斯佩克特对癌细胞行为方式及其RNA的研究,是在人类基因组计划(Human Genome Project)及随后的ENCODE计划——该计划旨在创建一部DNA元件的百科全书——的指引下进行的。人类基因组的完整测序结果显示,只有大约2%的基因组在编码蛋白质——细胞和组织的基石。与此同时,基因组的很大一部分(大约80%)都用来制造不同成分的RNA分子。这一惊人的发现让科学界重新思考这些RNA在人类和其他生物体中的作用。“这引出了一个很大的问题,”斯佩克特说,“基因组只有一小部分在编码蛋白质,而很大一部分基因组是用于制造大量的其他分子。这意味着这些基因肯定在做某些很重要的事情,因为对细胞来说,转录这些分子是一种能量的浪费。我们想知道这些分子在做什么。”基于这一思路,斯佩克特等人燃起了对RNA研究的新兴趣。
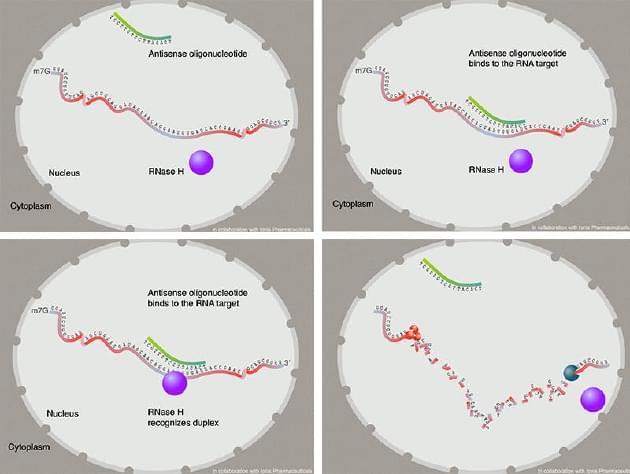
预备,瞄准,一击即中:反义寡核苷酸与MALAT1 RNA上的特定区域结合,类似于魔术贴带的粘合方式。紧接着,一组酶将会过来将MALAT1 RNA分解。
RNA即核糖核酸,是一种用途极为广泛的分子,被誉为细胞内的“驮马”,几乎参与了细胞功能机制的每一个方面,如基因的编码、解码、调节和表达。RNA由多种核苷酸组成,具有各种各样的形状和大小——有些短,有些长,还有一些是圆形的,但每一种都有特定的细胞功能。作为人体的基本结构,人体细胞由两个主要的单元组成:细胞质,有不同的分子和化合物在其中发挥作用;以及由膜结构包裹的细胞核,包含染色体和DNA。RNA在细胞核内“诞生”,或者更确切地说是在细胞核内组装而成,它们当中有一些会在细胞核内度过“一生”,另一些则挤过核膜上的小孔,进入细胞质。在那里,它们会执行组装蛋白质的指令,帮助将氨基酸合成为蛋白质。
斯佩克特一直对癌症感兴趣,他的研究主要集中在长链非编码RNA上。长链非编码RNA由200个甚至更多的核苷酸组成,不为编码任何蛋白质,也不帮助蛋白质进行组装。而且,长链非编码RNA往往会留在细胞核内,这一点尤其令斯佩克特感兴趣。他推测,这些RNA之所以不冒险进入细胞质,可能是因为它们在打开或关闭DNA链上的基因时具有某种作用。如果不能正常发挥这种作用的话,就会导致癌症——错误基因的激活会导致细胞的恶性生长,正如特定基因的沉默会抑制肿瘤一样。斯佩克特还对另一个事实产生了兴趣,那就是在构成人类基因组的6万多个基因中,只有2万个基因与制造蛋白质有关,而制造长链非编码RNA的基因数量几乎与此相当。“人类基因组中,大约有19000个基因可以产生长链非编码RNA。”斯佩克特说道。
目前,科学家们仍然不知道人体细胞中存在多少种不同类型的长链非编码RNA,但它们的确执行着十分重要的功能。有些RNA可以充当分子支架,像伴侣一样,将蛋白质带到特定基因上,使其开启或关闭。有些RNA则像海绵,可以将其他分子在细胞内隔离起来,使其无法发挥作用,等到需要时再释放出来。所有这一切,看起来就像细胞内拥有某种程度的智力。
经过18年来对细胞及其RNA“隐秘生活”的研究,斯佩克特的团队已经锁定了一种导致乳腺癌扩散的罪魁祸首:一个被称为MALAT1的长链非编码RNA。当乳管表面的健康上皮细胞产生过多的MALAT1分子时,它们就会陷入“疯狂”。在生物学上,适当的平衡是健康的关键,所以当一些RNA过度表达(数量过多)或表达不足(数量太少)时,疾病就会发生。
这种RNA的过度表达使乳腺上皮细胞失去了自身的生物学意义,开始增殖和扩散,正常的乳腺上皮细胞知道自己的使命所在,比如在需要的时候产生乳蛋白。但癌细胞认为它们需要生长和生存,并寻找新的家园,转移到新的器官,打个比方,这些RNA表现得就像细胞的分子同谋,使它们能够四处晃悠,杀死其他的正常细胞,MALAT1 RNA参与了细胞的移动和转移。
斯佩克特团队的下一步是观察用药物减少RNA的数量会发生什么。为了完成这项工作,他们与伊奥尼斯制药公司的合作者设计了一个聪明的分子方法。伊奥尼斯制药公司将MALAT1项目授权给了Flamingo Therapeutics公司。研究人员开发了一种能与MALAT1 RNA结合的化合物。这种化合物被称为反义寡核苷酸,由16个核苷酸组成,与MALAT1 RNA上的特定区域互补。因此,当二者在细胞内部相遇时,就会像拉链或尼龙扣带一样粘在一起。这种结合标志着MALAT1 RNA将被“就地处决”:它们会向一组酶发送信号,由这些酶像微型剪刀一样将MALAT1 RNA切成小块,当这种寡核苷酸在细胞中发现MALAT1时,会与之结合,然后刺激酶的识别,从而使这些RNA降解。
不过,最令人称奇的事情发生在RNA降解之后。随着MALAT1 RNA含量的减少,细胞恢复了部分生物学特征,这种药物似乎可以重新编程细胞,使它们突然想起自己是谁,就像“哦,我是一个乳腺上皮细胞,我不需要转移到别的地方去。相反,我应该在家里做一些事情,比如支持乳腺的功能”。
斯佩克特的团队将这种前瞻性的治疗药物命名为MALAT1 RX。他们发现,该药物可以阻止小鼠和类器官(由科斯特罗夫的病人捐赠的小块组织生长而成的微型肿瘤)的癌症发展。下一步,他们将在活人身上进行临床试验,希望这能在一两年内实现。
就典型的药物开发过程而言,MALAT1 RX的开发速度已经很快了。尽管病人非常无私地将自己的组织捐献给斯佩克特的研究,但他们可能没有机会从这种未来的药物中受益。不过,在未来几年里,其他癌症患者可能会幸运地迎来转机。

