嗜甲烷细菌(也称甲烷氧化细菌)每年消耗近3000万吨的甲烷,并因其将强大的温室气体转化为可用燃料的自然能力而吸引了研究人员的注意。然而,研究人员对这一复杂的反应是如何发生的知之甚少,限制了他们利用这一双重优势的能力。通过研究细菌用来催化该反应的酶,美国西北大学的一个团队现在已经发现了可能驱动该过程的关键结构。
他们的发现将于3月18日发表在《科学》杂志上,最终可能导致开发出将甲烷气体转化为甲醇的人造生物催化剂。
论文的资深作者、西北大学的Amy Rosenzweig说:“甲烷有很强的结合力,所以有一种酶可以做到这一点,这非常了不起。如果我们不确切了解该酶是如何进行这种困难的化学反应的,我们就无法为生物技术应用设计和优化它。”
Rosenzweig是西北大学温伯格文理学院生命科学的Weinberg Family特聘教授,她在分子生物科学和化学领域都有任职。
这种被称为颗粒甲烷单加氧酶(pMMO)的酶是一种特别难以研究的蛋白质,因为它被嵌入了细菌的细胞膜中。
通常情况下,当研究人员研究这些甲烷细菌时,他们使用一种严格的程序,即用一种洗涤剂溶液将蛋白质从细胞膜上撕下来。虽然这个过程有效地隔离了酶,但它也杀死了所有的酶的活性,并限制了研究人员能够收集多少信息--就像监测一个没有心跳的心脏。
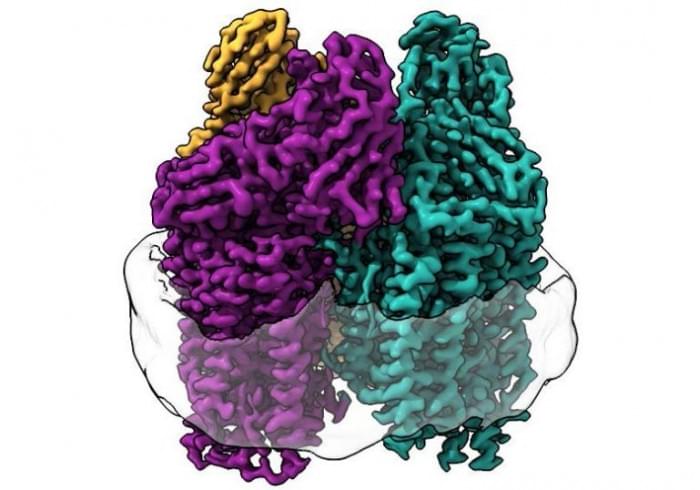
在这项研究中,该团队完全使用了一种新的技术。Christopher Koo是第一作者,也是Rosenzweig实验室的博士生,他想知道通过将酶放回类似于其原生环境的膜中,他们是否能学到一些新东西。Koo利用来自细菌的脂质在一个被称为纳米盘的保护性颗粒内形成一个膜,然后将酶嵌入该膜中。
Koo说:“通过在纳米盘内重新创造酶的本地环境,我们能够恢复酶的活性。然后,我们能够使用结构技术在原子水平上确定脂质双分子层是如何恢复活性的。在这样做的过程中,我们发现了酶中可能发生甲烷氧化的铜位点的完整排列。”
研究人员使用了低温电子显微镜(cryo-EM),这是一种非常适合膜蛋白的技术,因为在整个实验过程中,脂质膜环境没有受到干扰。这使他们能够首次高分辨率地观察到活性酶的原子结构。
Rosenzweig说:“作为最近低温电子显微镜‘分辨率革命’的结果,我们能够看到原子级的结构细节。我们所看到的完全改变了我们对这种酶的活性部位的思考方式。”
Rosenzweig表示,低温电子显微镜结构为回答继续堆积的问题提供了一个新的起点。甲烷是如何进入酶的活性部位的?或者甲醇是如何走出酶的?活性部位的铜是如何进行化学反应的?接下来,研究小组计划使用一种称为低温电子断层扫描(cryo-ET)的前沿成像技术直接在细菌细胞内研究该酶。
如果成功的话,研究人员将能够准确地看到该酶在细胞膜中的排列方式,确定它在真正的本地环境中如何运作,并了解该酶周围的其他蛋白质是否与它相互作用。这些发现将为工程师提供一个关键的缺失环节。
Rosenzweig说:“如果你想优化这种酶,把它插入生物制造途径或消耗甲烷以外的污染物,那么我们需要知道它在本地环境中是什么样子,以及甲烷在哪里结合。你可以用带有工程酶的细菌从压裂现场采集甲烷,或者清理石油泄漏。”

