纽约基因组中心(New York Genome Center)和纽约大学(New York University)的科学家开发了一个基因筛选平台,以识别能够增强免疫细胞的基因,使它们更持久,并提高它们根除肿瘤细胞的能力。
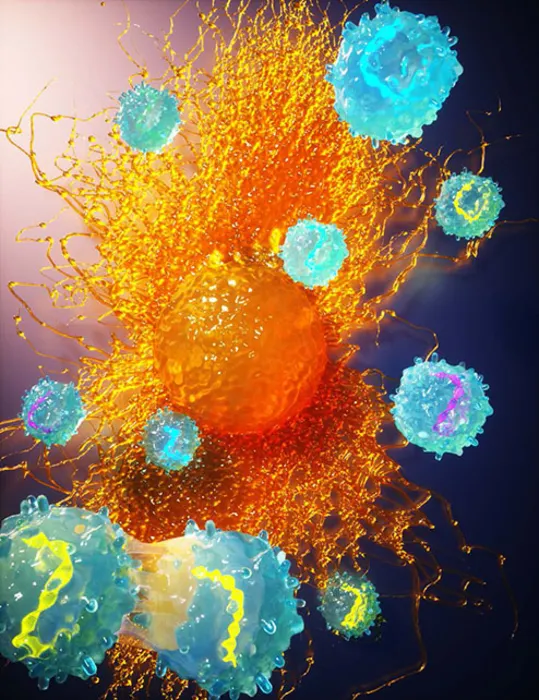
带有条形码修饰基因的工程T细胞接近肿瘤细胞。
FDA批准的首个基因疗法是活的药物:从癌症患者身上提取的免疫细胞,设计成靶向肿瘤细胞。然而,对于许多患者来说,这些先进的治疗方法并不能带来持久的缓解。现在,纽约基因组中心(New York Genome Center)和纽约大学(New York University)的科学家们开发了一个基因筛选平台,以识别能够增强免疫细胞的基因,使它们更持久,并提高它们根除肿瘤细胞的能力。研究人员在《自然》(Nature)杂志上描述了合成基因程序的发现,该程序深刻地重组了一种名为T细胞的特殊免疫细胞,使它们更有效地发现和抗击癌细胞。
该研究团队由纽约基因组中心核心教员、纽约大学生物学助理教授、纽约大学格罗斯曼医学院神经科学和生理学助理教授Neville Sanjana博士领导,分析了来自人类供体的多个T细胞亚群中近12000个不同基因的影响。这项大规模基因筛查的目的是准确识别那些使T细胞增殖的基因,并了解这些基因如何影响与抗癌相关的免疫细胞功能的其他方面。
以前的T细胞工程主要是通过仔细选择癌症或组织特异性蛋白(抗原)来靶向特定类型的肿瘤。自30多年前首次开发以来,嵌合抗原受体(CAR)-T细胞疗法已被证明在靶向血癌细胞方面非常有效,导致了多种CAR-T疗法获批。CAR-T细胞的表面有抗原受体,可以识别癌细胞上的特定蛋白质,从而锁定并摧毁它们。一些患者在接受CAR-T细胞治疗后甚至十年都没有癌症,因为早在几年前引入的T细胞仍在发挥作用。但是生物医学面临的主要挑战之一是理解为什么大多数接受CAR-T细胞治疗的癌症患者不能获得持久的缓解。
通过将筛选出来的修饰基因与现有的CARs结合,研究人员能够改造T细胞,使其更有效地消除肿瘤细胞。其中一种特殊的修饰基因,淋巴细胞毒素受体(LTBR),就像青春的分子喷泉:有了LTBR, T细胞就可以繁殖,有更多的年轻细胞,更多的类似干细胞的细胞,并且抵抗随着时间的推移而衰竭。添加LTBR也会导致T细胞分泌更多的细胞因子,这对T细胞的抗肿瘤活性至关重要。细胞因子在使T细胞更好地与体内其他免疫细胞沟通并协同攻击癌症方面发挥着重要作用。有趣的是,LTBR通常在T细胞中不表达,这突出了基因组规模的筛选来发现激活全新细胞程序的基因的能力。
他们开发的新方法——Oversite seq——允许研究人员测试不同修饰基因对T细胞状态的影响,包括每个基因的表达、细胞表面的蛋白质以及每个细胞表达的独特T细胞受体(克隆型)。Oversite seq为研究人员提供了每个修饰基因如何增强T细胞活性的详细图片,并在一个单细胞实验中对所有排名靠前的基因进行了增强。对于LTBR来说,这产生了一个早期线索,即大量基因正在发生变化,这导致研究人员进一步确定了一种被称为NF-kB的研究充分的基因表达调节剂,驱动了其中许多变化。这种LTBR驱动的深度重编程也见于所谓的非常规T细胞,如γδT细胞,其丰度低于常规T细胞,但可针对更多样化的肿瘤。
该团队还将一些顶级的基因修饰剂与CARs相结合,类似于两种现有的FDA批准的血癌治疗方法:Tisagenelecluel(Kymriah)和Axicabatagene ciloleucel(Yescarta)。几乎所有被测试的调节剂都增强了CAR-T反应,包括LTBR。由于来自癌症患者的T细胞与来自健康捐赠者的T细胞相比处于较差的状态,研究人员还想测试LTBR使癌症患者的T细胞恢复活力的能力。他们将LTBR和CAR结合到诊断为弥漫性大B细胞淋巴瘤(一种血癌)的患者的功能失调的T细胞中,发现了类似的T细胞功能增强,这表明该技术可以作为一种优化的临床治疗。
研究团队还表明,用修饰基因增强的T细胞不仅能更好地根除白血病,还能根除胰腺癌细胞。这些结果不仅有助于开发更大范围的针对血癌的增强型CAR-T疗法,而且有助于它们在靶向实体瘤方面发挥关键作用,在这一领域,建立有效的CAR-T免疫疗法更具挑战性。
研究评论
该研究的资深作者Sanjana博士解释说:“迄今为止,T细胞的基因工程一直专注于寻找新的抗原或新的CARs。我们采取了一种截然不同的方法:与其改变抗体,不如尝试加入基因,将T细胞转化为更具攻击性的抗癌细胞。这些修饰基因在血癌中工作得很好,我们相信它们可能会在多种抗原和实体肿瘤中发挥作用。”
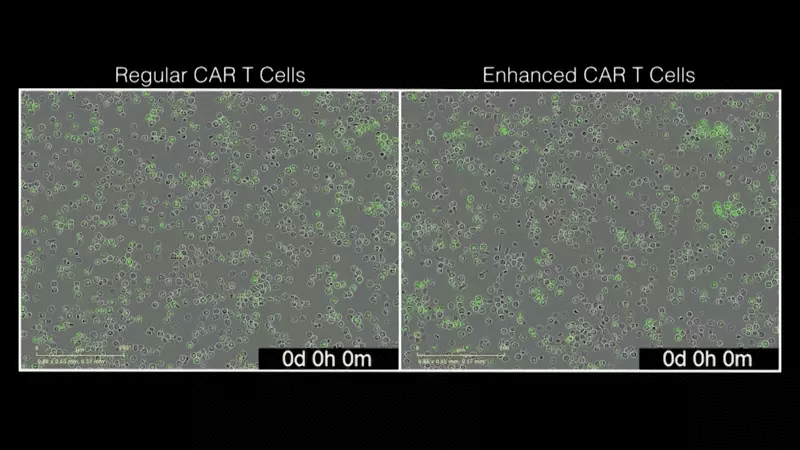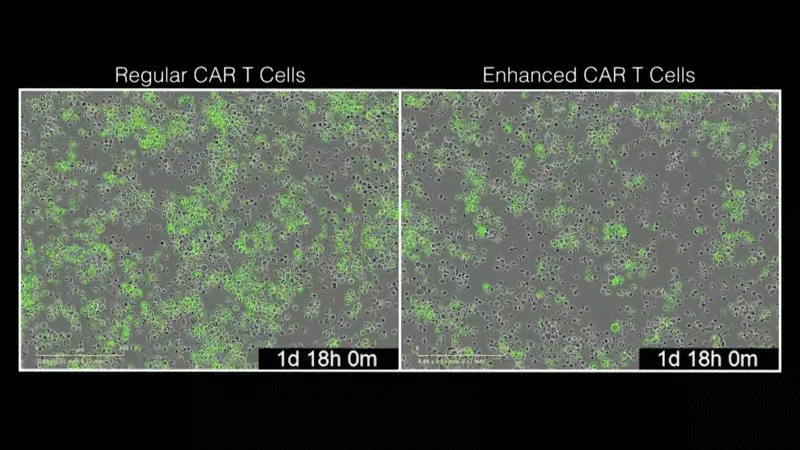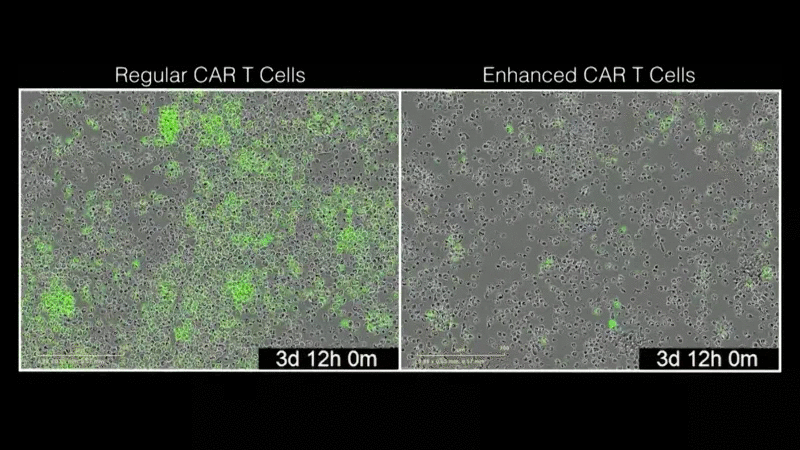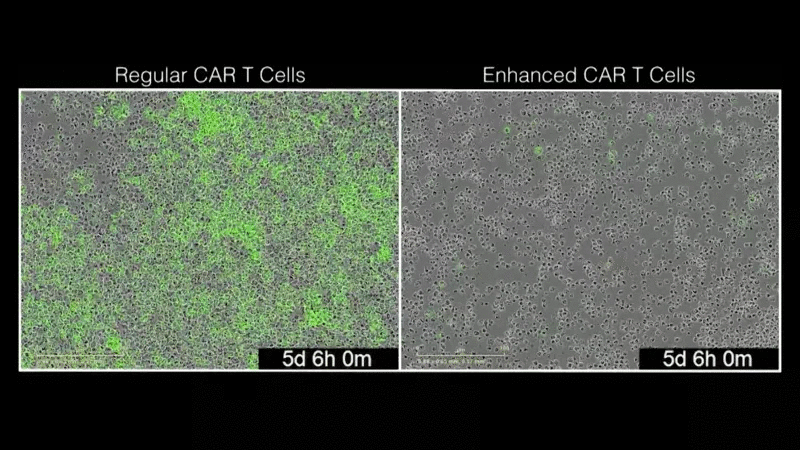
“我们的目标是利用现有的免疫疗法,使其变得更好。我们很惊讶,LTBR如此显著地增强了CAR疗法。这是迈向下一代CAR-T细胞治疗发展的重要一步。”该研究的第一作者Mateusz Legut博士说,他是Sanjana实验室的博士后研究员。研究小组发现,添加LTBR可以重新连接T细胞的基因组,从而触发许多其他增强T细胞功能的基因的表达。该团队通过将基因过表达筛查与单细胞基因组学相结合,能够快速了解LTBR和类似修饰基因的作用。
“最令人兴奋的方面是LTBR和其他高排名基因改善了嵌合抗原受体T细胞和γδ T细胞的抗原特异性应答。如果在体外和临床试验中得到验证,这可能对未来CAR-T细胞治疗淋巴恶性肿瘤和其他癌症具有深远的意义,”该研究的合著者Catherine Diefenbach医学博士说。
Cardiff大学医学院的T细胞和免疫治疗专家Andrew Sewell博士没有参与这项研究,他指出,“T细胞功能增强筛查有很大潜力揭示如何使免疫治疗更成功——尤其是在目前的CAR T细胞治疗效果不佳的实体癌中。”

