生儿育女,需要男女结合。对于哺乳动物来说,这是天经地义的事情。然而,有一群科学家却可以打破这条“铁律”。近日,来自上海交通大学医学院附属仁济医院生殖医学科的魏延昌博士与同事们报告了一项突破性进展:利用新技术,他们让没有受精的小鼠妈妈产下了健康且有正常生殖能力的后代,成功完成单性繁殖!
这项重磅研究,近日刊登在《美国科学院院刊》(PNAS)上。

单性繁殖,也称为孤雌繁殖(parthenogenesis)。这种仅靠雌性“一己之力”就可以产生后代的生殖方式,在整个动物界中其实并不罕见,昆虫、鸟类、爬行动物、两栖动物中有不少例子。
然而,哺乳动物的新生命总是起始于卵细胞与精细胞的结合。究其原因,科学家们发现,与一种叫做“基因组印记”(genomic imprinting)的现象有关。这是指,由父亲或母亲提供的基因,有一些会被贴上“甲基化”的化学标签而失去活性。来自父母双方的基因组凑在一起,产生互补,后代才能正常发育。这也就意味着,单单一方提供的遗传物质,因为一些关键基因无法正确表达,会让胚胎发育或是产后的生长发育受到阻碍。
既然如此,如果能消除或改变“基因组印记”,是不是可以消除生殖方式的障碍?过去几年里有很多科学家以不同的方式做出尝试。比如,同样来自中国的一支研究团队,曾利用干细胞技术与基因编辑技术,通过“抹除”基因组印记,培育出了双亲都是同一性别的小鼠。
学术经纬相关阅读:逆天了!中国科学家造出了只有父亲,没有母亲的小鼠
此次研究中,科学家们靶向甲基化差异进行编辑,通过改写七个关键的基因组印记控制区域,最终实现了只需要单个小鼠的卵母细胞就能产生后代。
这些基因组印记控制区域通过甲基化程度的高低调节了两组关键基因的打开或关闭。研究人员从雌性小鼠身上取出卵母细胞后,用CRISPR基因编辑系统处理细胞,定位到其中一组基因的基因组印记控制区域,通过添加甲基化将其关闭;同时,定位到另一组基因,通过去甲基化将其打开。这样一来,可以分别模拟正常受精卵细胞中来自父亲和母亲的基因组印记,最终使未受精的卵母细胞具有类似于受精卵细胞的特征。
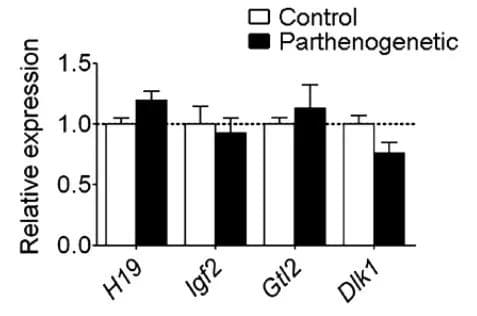 | 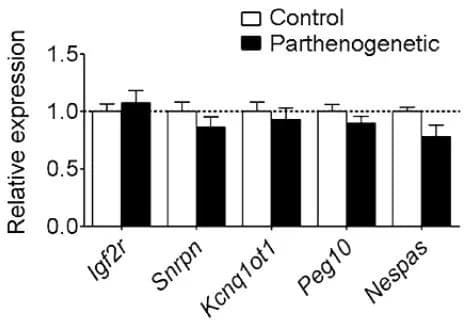 |
经过编辑的卵母细胞在体外发育到早期胚胎阶段后,研究人员将这些单性生殖胚胎植入雌性小鼠子宫,让它们继续在体内发育。研究人员们培育并移植了192例胚胎,有3只小鼠足月诞生。
最终,有一只单性生殖小鼠不仅顺利存活到成年,而且还在成年后通过正常的生殖方式产下后代。

研究人员通过测序验证,幸存的这只小鼠所有经过编辑的基因组印记控制区域都表现出了正确的甲基化模式。而出生后早夭或是未能存活下来的胚胎,七个关键基因组印记控制区域中未能全部编辑成功或是印记丢失。这一分析结果突显了关键基因组印记控制区域在胚胎生长发育中的重要性,也为进一步提高这项技术的成功比例指出了方向。
研究人员在论文最后指出:“哺乳动物单性生殖的成功将为农业、研究和医学开辟许多机会。”

