根据约翰·霍普金斯大学的最新统计,全球累计新冠病例总数已接近4亿,总新冠疾病死亡人数超过570万。尽管多款新冠疫苗已经问世,但在不断出现的新冠变种面前,我们还是需要有更多新型的控制手段,以备不时之需。

今日,顶尖学术期刊《自然》以加速预览的形式,发表了一篇关于抗新冠药物的最新论文。研究人员们筛选了约1.8万种不同的药物,找到了一些具有抗病毒活性的潜在疗法,其中有一些已经得到了监管机构的批准用于新冠治疗,彰显了其筛选方法的可靠性。研究也发现了一类全新的疗法,与已有的抗病毒药物联合使用,有望起到协同效果,更好地治疗新冠疾病。这也给未来的临床开发带来了启示。
在论文中,科学家们指出新冠病毒等RNA病毒使用一种叫做RNA依赖的RNA聚合酶(RdRp)来进行RNA的复制,而一类叫做核苷类似物的药物,则可以干扰这一步骤,使得病毒复制RNA的过程出现终止,或是出现突变,最终抑制病毒的复制。在其它疾病领域,已有不少核苷类似物得到了批准。考虑到RdRp在不同病毒中的结构相对保守,已有的一些核苷类似物可能对新冠病毒也有抑制效力。
为了迅速找到这些潜在的药物,科学家们使用人类呼吸道细胞,进行了小分子化合物库的筛选。这些化合物库包含已获批的药物,也包含正在进行临床开发,或是已知具有抗病毒活性的药物,总共有约18000种。研究人员们先用这些药物处理人类呼吸道细胞,再用新冠病毒进行感染。48个小时后,他们再去定量评估感染的严重程度。
在综合评估对新冠病毒的抑制能力,以及毒性后,研究人员们找到了122个不同的化合物分子。它们分属于不同的类型,其中约13%均为核苷类似物。从中,研究人员们发现了remdesivir与molnupiravir,这正是已经得到全球多个监管机构批准的两款抗新冠病毒疗法,也从侧面验证了其筛选系统的可靠性。
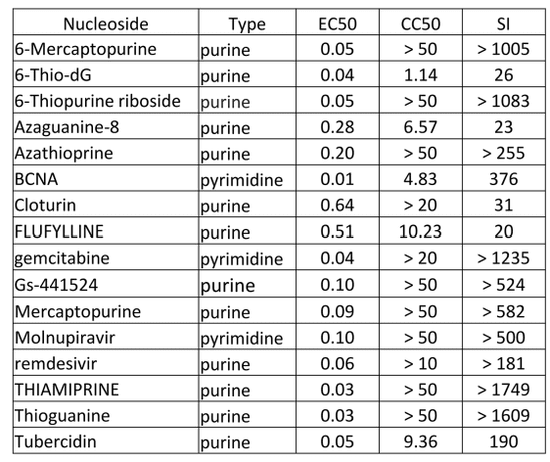
值得一提的是,核苷类似物不仅可以通过模拟核苷来影响DNA或RNA的复制,还可以影响抑制核苷合成所需要的酶,从而抑制核苷的合成。在这项大规模筛选找到的核苷类似物中,就不乏一些具有抑制核苷合成的功能。这些分子在能够发挥抗病毒功效的浓度下,对使用的细胞不具有毒性。此外,不同的分子也具有细胞特异性,比如一种叫做tubercidin的分子在Calu-3(本研究使用的细胞系)、Caco-2和Huh7.5细胞系中有抗病毒活性,而叫做Thioguanine和6-Mercaptopurine的分子则在Calu-3和A549-Ace2细胞系中有活性。
这个发现具有重要的启示,因为同样是核苷类似物,如果作用的通路不同,就可能发挥“一加一大于二”的协同效果。在本研究中,科学家们也通过筛选的方式,找到了三种分子:DHODH抑制剂BAY-2402234与Brequinar,以及UMPS抑制剂pyrazofurin。它们都能够抑制嘧啶的生物合成,且在使用的细胞系中具有较低的毒性。此外,他们也确认这三种分子的功能只是抑制嘧啶合成,因为如果提供额外的胞嘧啶和/或尿嘧啶,这些分子就失去了抑制新冠病毒的作用。
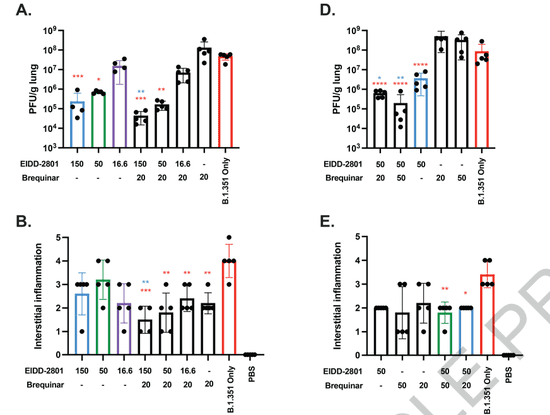
随后,研究人员们发现两种DHODH抑制剂与remdesivir或是molnupiravir联用,均能发挥“惊人的”协同效应。同样,pyrazofurin与remdesivir或是molnupiravir联用,也能出现协同效应。相反,如果只是将remdesivir与molnupiravir联用,则只是效果的简单累加,而没有实现“一加一大于二”。
针对不同的新冠变种(alpha、beta、gamma、delta),研究人员们确认这些抗病毒疗法均能起到疗效。尽管背后的机制不明,但研究人员们指出,如果抑制嘧啶合成,可以更有效的抑制新冠病毒。这或许也启发了未来的新药开发思路,有望在临床上带来全新的疗法。

