2019年秋天,世界开始了现代史上最大的进化生物学实验之一。一种冠状病毒获得了在人类体内生存的能力,而不是一直作为其宿主的蝙蝠和其他哺乳动物。它进一步适应,变得能有效地从一个人传播到另一个人,甚至在身体的防御系统能够对抗它之前进行。
很显然,进化的棋局并没有就此停止,现在,我们已经有一个希腊字母汤的SARS-CoV-2变体来证明这一点。
眼下,来自世界各地的研究人员正在试图更详细地了解该病毒的进化,特别是SARS-CoV-2的突变如何改变其在人类中传播的能力。“今天适应性良好的病毒明天可能会适应不良,因为宿主产生了抗性,然后它必须找出一种新的方式来感染该宿主,”来自加州大学圣地亚哥分校的进化生物学家Justin Meyer说道,“这推动了创新,推动了新颖性。”
尽管不断变化的大流行病所造成的人员伤亡是严峻的,但通过观察病毒在全球范围内的移动而获得的大量科学数据是有启发的。牛津大学大数据研究所的统计遗传学家Luca Ferretti表示:“COVID给了我们一些最美丽的进化实例。”
预测病毒下一步可能会做什么可能永远不可能,但世界各地的病毒学家一直在深入了解SARS-CoV-2的哪些部分最容易进化,哪些关键的蛋白质元素不能改变而不影响其生存。这些信息可能为更好、更持久的疫苗指明了方向。其他研究强调了该病毒可能对用于治疗一些严重的COVID-19患者的单克隆抗体疗法产生抗性的方式。这项工作还指出了特定的突变组合,如果这些突变在病毒群体中普遍存在则可能会迎来大流行病的新阶段,这些突变除了快速传播之外还擅长逃避我们的免疫防御。
科学家们通过利用现代技术重新审视近一个世纪前提出的一个概念--适应度(或自适应)景观--而得以做出这些发现。他们可以使用适应度景观来量化病毒基因组的变化跟其复制和感染新宿主的能力之间的关系。代表这种关系的地形图可以帮助重建病毒的历史,另外,至少还可以潜在地预测其未来。
对于伦敦帝国学院的分子进化生物学家Tobias Warnecke来说,适应度地貌是连接基因型和表型的一种宝贵方式。他指出,通过挖掘它们的定量潜力,科学家们可以提出关于两个突变如何协同影响一个性状的问题以及它们如何受到第三个突变的影响。“以这种方式,你可以通过许多不同的基因型组合来看看这如何影响你感兴趣的东西。”
适应度景观的价值并不限于在基因组或蛋白质的少量变化之间进行比较。现代实验技术也使一种被称为深度突变扫描的策略成为可能,在这种情况下,研究人员进行小规模的自然选择实验并一次性比较数以万计的突变体的适应度价值。这一过程可以揭示出突变之间不可预见的相互作用,这些突变可以帮助或伤害病毒--而且可以确定病毒未来的进化路径,这些路径可能会对人类构成新的威胁。
生存的动态地图
查尔斯·达尔文在《物种起源》中写道,自然选择是“保存有利的个体差异和变异,并破坏那些有害的个体差异和变异”的结果。在那些日子里,在对遗传学和突变的科学理解之前,生物学家只能试图想象一个生物体的小的、可继承的变化会如何影响其繁殖。这个想法只有在美国生物学家Sewall Wright的工作中才得以充分巩固。在其于1932年发表在《Proceedings of the Sixth International Congress of Genetics》上的开创性论文中,他用手绘的图表来说明一个生物体如何在“几乎无限的可能变异领域中移动,而该物种可能在自然选择下通过这些变异”。
Wright指出,将DNA或肽等线性分子的大量可能变体形象化的一种方法是将每种可能性视为空间中的一个独特点。然后,分子的进化相当于初始和最终变体的点之间的路径,沿途则会遇到所有的中间变体的点。
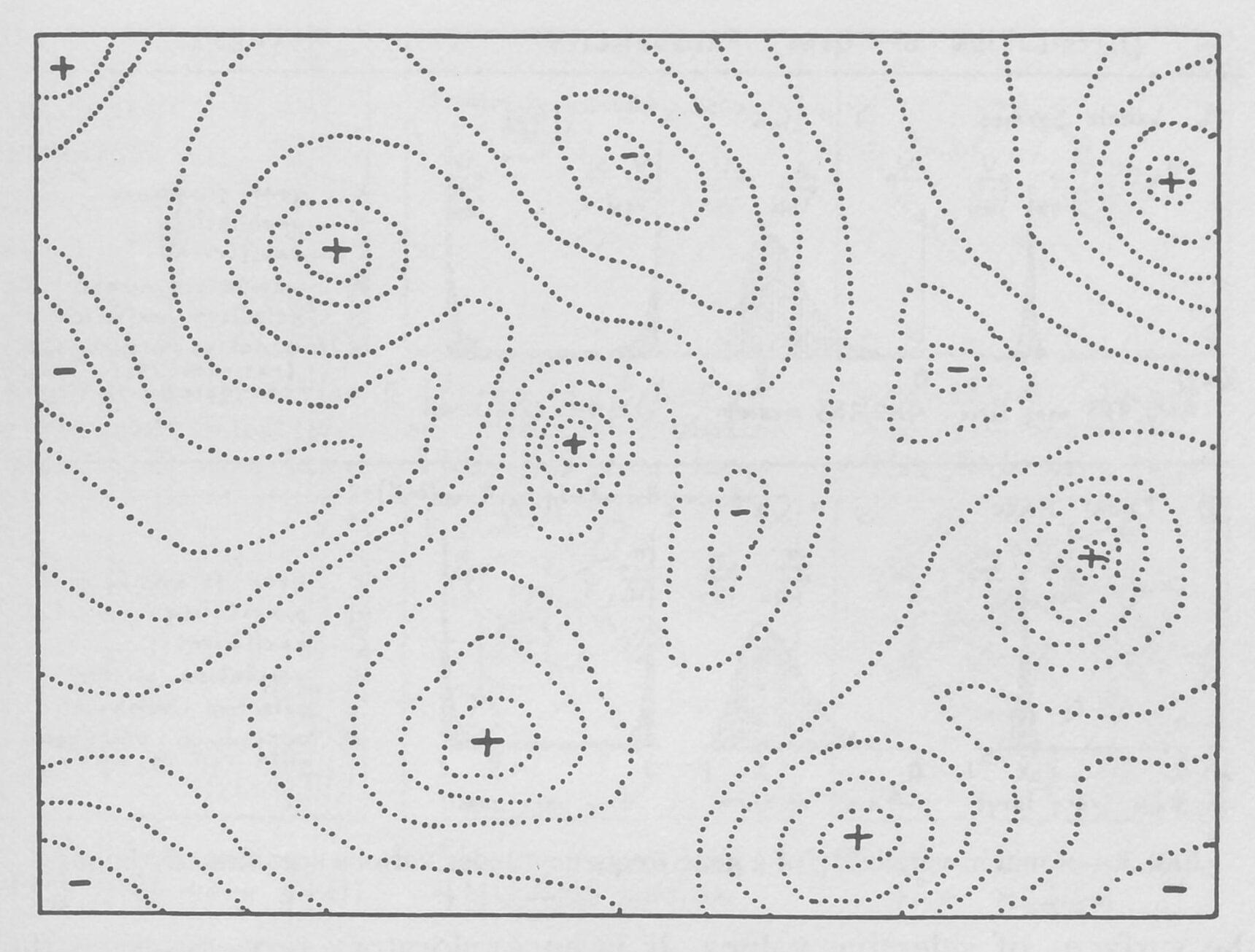
为了帮助理解这些变体的复杂图形和它们之间的进化路径,Wright表明,它们可以被表示为更直观的“适应性景观”,只有两个或三个维度。横轴描绘了DNA(基因型)或物理性状(表型)的变异性--两个变体越相似,它们在平面上就越接近;纵轴则衡量变异对进化适应性的影响。无论是通过增加可存活的后代还是改善蛋白质的功能,提高生物体生存几率的变异都在山峰上栖息,而那些减少生物体生存的变异则在谷底徘徊。
来自密歇根大学医学院的进化生物学家Adam Lauring指出,结果是一个具有独特地形的景观。如果映射出的变体在其对健康的影响方面没有什么不同,那么景观看起来就相当平坦,很像内布拉斯加州。对适应度有很大影响的变异体创造的景观更接近于犹他州布莱斯峡谷的高耸的帽状物。自然选择倾向于山峰上的变体。一个物种的平均基因型或表现型应该通过从一个山峰到下一个山峰来进化,最好是沿着山峰之间的山脊而不是通过山谷。
“如果你移动几英尺你就会掉下来,再爬起来就变得非常困难,”Lauring说道,“可以移动的路径较少。”
“这个理论非常简单明了。你只需要知道你的基因型,然后你测量适应度,你基本上可以预测任何可能发生的事情,”在瑞士伯尔尼大学研究进化动力学的Claudia Bank说道。然而将理论付诸实践是另一回事。
一个复杂的问题是,无论是SARS-CoV-2还是人类的适应度景观都不是静态的。一个让生物体消化新食物但使其生长更慢的突变可能是一个救命稻草,也可能是一个致命的障碍。一个变异体对进化适应性的影响取决于生物体所处的环境。当环境发生变化时,适应度状况也会发生变化。Lauring说道:“不同的变异有不同的影响,而这取决于适应度环境。”
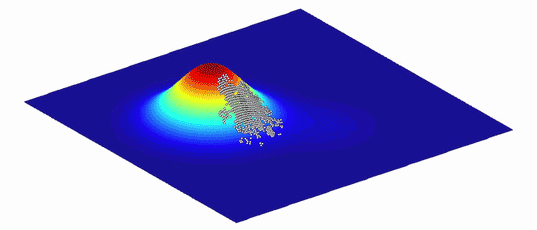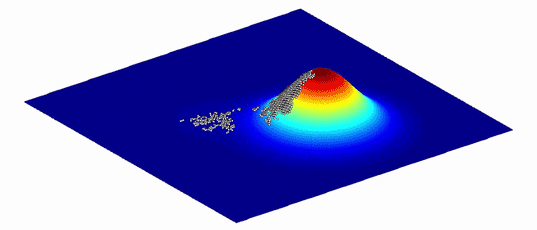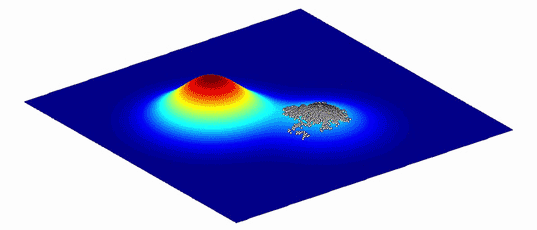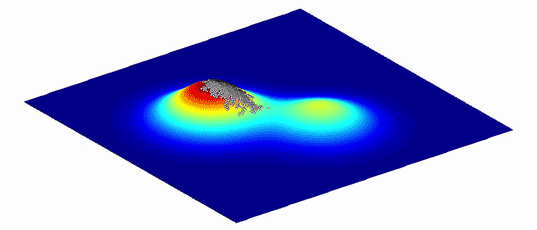
创建适应度景观同时也是一个数学上的挑战。即使是一个长度只有100个氨基酸的小蛋白质也会有20100个可能的变体,这比宇宙中的原子数量还多。很难想象,更不用说计算了,真正的蛋白质适应度景观的复杂地形以及穿越它们的各种路径的可能性。因此,几十年来,适应度景观是概念上的帮助,而不是具体测量的工具。直到最近,随着先进的计算能力和改进的分子生物学技术,科学家们才开始为单个蛋白质和简单的生物体如细菌和病毒制作定量的景观。
细菌和病毒几乎是适应度景观的理想对象。在试管中以数百万或数十亿的数量增长,每个细菌细胞或病毒颗粒都可以从描述适应度景观的巨大变体库中孕育一个突变。它们的生成时间非常短,只有几小时或几天,这也使研究人员能更快地识别新的变异。大多数使用RNA作为其遗传物质的病毒--包括HIV和丙型肝炎病毒(HCV)--也非常容易发生突变,因为复制其基因组的RNA聚合酶并不像DNA聚合酶那样有效地校对副本。
科学家们开始发现的第一件事是,尽管景观很复杂,但生物体往往只受制于少数几个适应度最大值和它们之间有限的路径。2006年《科学》的一篇论文仔细研究了一种叫做β-内酰胺酶的蛋白质,它能使青霉素等抗生素失活。β-内酰胺酶中五个单核苷酸突变的共同作用可以使其抗生素的抗性增加100,000倍。当时在哈佛大学从事进化生物学博士后研究、现在在布朗大学领导一个实验室的Daniel Weinreich和他的同事指出,该基因的进化有可能遵循120条路径来积累所有五个突变。
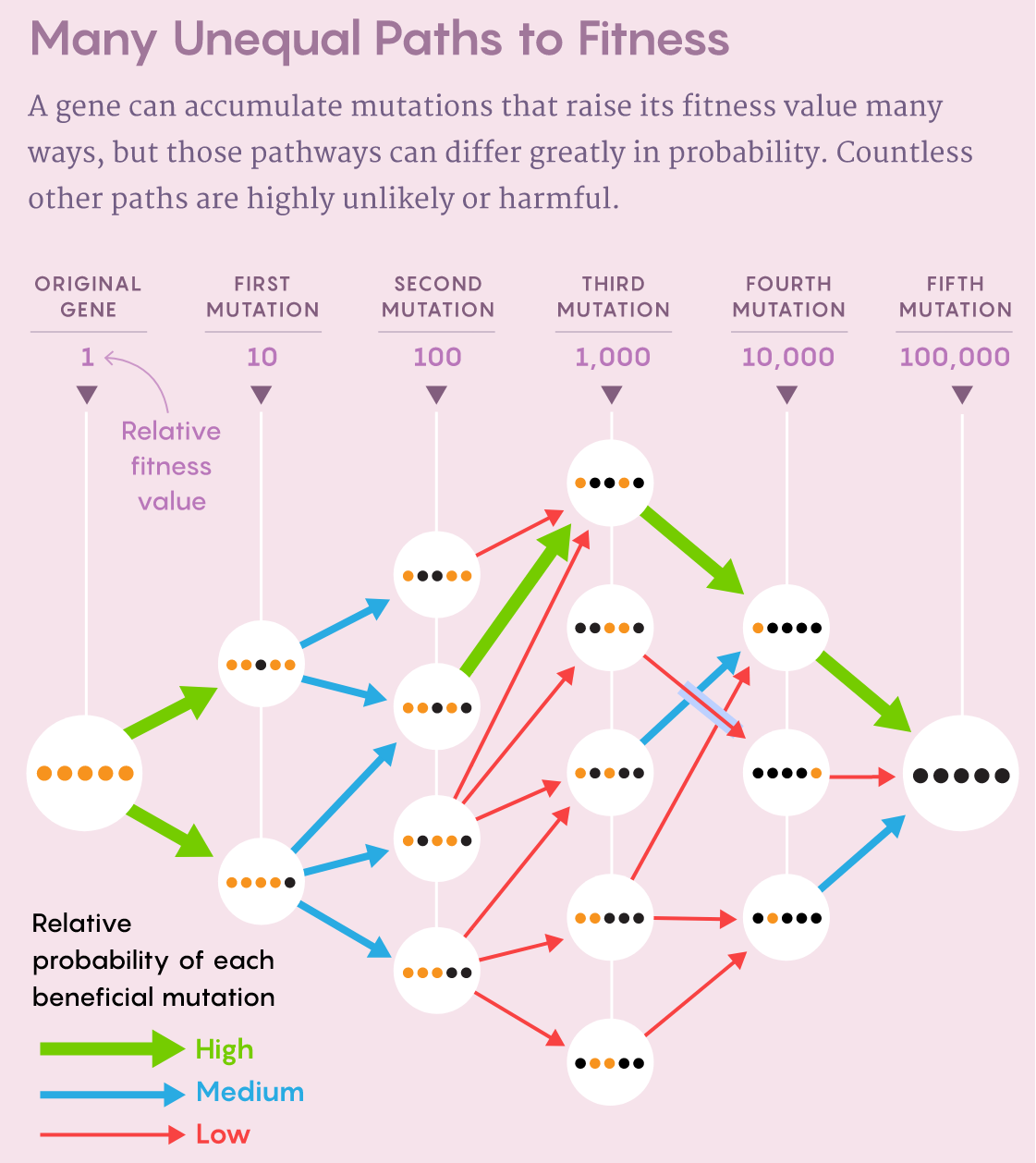
然而,当科学家们在实验室中创造和测试中间变体时,他们发现其中102条路径在自然选择下是不可能的,因为它们产生了有缺陷的或不完整的蛋白质。当他们发现剩下的许多组合未能提高抗生素的抗性时可能性进一步缩小。他们写道:“这意味着,生命的蛋白质带可能在很大程度上是可重复的,甚至是可预测的。”
深度突变扫描
预测即使是最小的病毒或蛋白质的未来进化轨迹需要对其适应性景观有一个详细的了解,而这是很难获得的。历史上,科学家们不得不一次创造一个核苷酸或氨基酸的突变,然后提纯突变的蛋白质并评估其功能。检查几个以上的可能突变往往是不切实际的。
深度突变扫描技术的发展则改变了这一切。这种技术使科学家能一次性产生数以万计的变异体,然后使所有的变异体相互竞争从而确定它们的相对适应性价值。
研究人员首先创建一个可以克隆到培养细胞中的变异基因库。这些基因编码一种蛋白质,其活性跟某些生化功能有关,可以在实验室中进行选择,因此制造这些蛋白质的最合适、最活跃版本的细胞将变得更加丰富,而制造不活跃版本的细胞则消失。通过高通量DNA测序,研究人员可以统计出每个变体的数量以定量测量它在多代中的表现。
伦敦Warnecke实验室的研究员Valerie Soo表示:“这是一种真正强大的用来捕捉突变影响的方法。”
有了易变异的RNA病毒,科学家们甚至不必在实验室里产生变异--易出错的基因组复制机器会引入变异并为他们完成这项工作。数以百万计的病毒拷贝中的每一个都跟它的邻居略有不同,这形成了病毒学家所说的突变体群。
“微生物的繁殖如此迅速,以至于进化每天都在发生,”法国蒙彼利埃MIVEGEC实验室的进化生态学家Samuel Alizon表示,“”实际上可以实时监控进化。”
研究人员发现,这些病毒群中的突变很少被传递给新的宿主,特别是当只需要少量的病毒就能引起感染时。这其中有些纯粹是机会,只是哪个变体在正确的时间出现在正确的地点的问题。加州大学旧金山分校的病毒学家Raul Andino-Pavlovsky指出,但通过勾勒出适应性景观,研究人员可以尝试弄清楚一些变种的传播频率远高于其他变种的原因。
“一种病毒不仅需要能够产生多样性,而且它必须能够容忍这种多样性。如果你是一种病毒,且你能容忍变化,那么你就有可能成为一种适应能力更强的病毒。”


进化生物学家Tyler Starr指出,从概念和数量上来说,实用性景观是描述慢性或持续性感染的病毒如何逃避宿主免疫系统中和它们的反复努力的完美方式。这就是为什么他加入了弗雷德-哈钦森癌症研究中心Jesse Bloom的实验室研究艾滋病毒如何在感染过程中与病人体内的抗体免疫力共同进化。他的目标是了解病毒和免疫系统之间的这种进化军备竞赛是如何产生具有保护性的抗体的,而这可以帮助科学家在开发HIV疫苗时将重点放在病毒中更不可改变的部分。
然而就在Starr刚开始研究艾滋病毒的时候,另一种病毒就抢走了他--以及全世界--的注意力。
比预期的更易变
随着SARS-CoV-2开始在全球蔓延,Starr和Bloom意识到适应度景观为开始研究这种新型病原体提供了一种有用的方法。它给了他们一种方法来弄清楚哪些因素在病毒蛋白中是重要的以及病毒能容忍多少变化。
最初,对SARS-CoV-2进行测序的科学家并没有注意到很多遗传变化。尽管新冠病毒使用一种容易出错的RNA聚合酶来复制它们的遗传物质,但SARS-CoV-2拥有第二种蛋白质作为校对者。因此,研究人员没有想到该病毒会像流感或艾滋病毒那样获得许多突变。
Bloom和Starr知道尖峰蛋白将是新冠病毒中进化压力最大的部分,因为它是免疫系统识别能力最强的部分,也是病毒用来闯入人体细胞的。然而,由于拥有1273个氨基酸,刺突蛋白的规模太大,无法通过适应度景观进行快速评估。因此,Starr决定把重点放在被称为受体结合域的刺突蛋白的一个分支上,它只有几百个氨基酸--这是一个更加棘手的问题。
Starr利用深度突变扫描创造了4000个不同的受体结合域的突变。他评估了它们跟人类ACE2蛋白结合的能力以及被免疫系统识别的能力。如果SARS-CoV-2无法容忍其受体结合域的许多变化,Starr预计将看到免疫识别或ACE2结合功能将受到突变的严重损害。
但这根本不是发生的情况。“受体结合域有很多不同的突变,实际上提高了结合亲和力,”Starr说道,“这看起来是一个真正具有容忍性的结构域,有很大的进化能力。然而,当时的想法是,新冠病毒不会发生抗原性的进化。它们可能会是稳定的。”
虽然受体结合结构域容忍的变化比预期的要多,但并非刺突蛋白的所有部分都是如此。Starr说,刺突蛋白的这些部分因此可能是新疫苗和单克隆抗体的良好目标,因为它们随着时间的推移不太可能发生变异。
当他们于2020年6月首次在biorxiv.org预印本服务器上发布这些结果时,这成为了一个巨大的警钟,Starr说--这是SARS-CoV-2比人们想象的更容易变异的首批迹象之一。现在,Starr和Bloom正在重复他们对阿尔法、贝塔、伽马、德尔塔和奥密克戎变体的深度突变扫描实验以获得关于其受体结合域的类似见解。
Starr、Bloom及其同事还创建了一个受体结合域的所有可能的突变图,这些突变并不会干扰ACE2的结合。他们的工作发表在2021年1月的《科学》上,其确定了该结构域的潜在突变。据了解,这些突变可以逃避单克隆抗体疗法的中和。他们的工作还确定了在一个感染了SARS-CoV-2 150天的免疫力低下的人身上出现的几个突变。当这个人在第145天接受单克隆抗体治疗时,它们已经对市场上的现有产品产生了抗性。对Starr来说,这表明这些治疗性单克隆抗体可能会随着时间的推移而变得不那么有效,无论是在单个病人身上还是随着病毒的变异而变得更加普遍。
此外,正如Starr、Bloom和他们的同事去年夏天在《自然-通讯》上所描述的那样,几种广泛的突变可以分别帮助SARS-CoV-2逃避免疫系统通常针对受体结合域中最有针对性的部分所产生的一些抗体。到目前为止,还没有哪个病毒系进化到拥有所有这三种突变。他们写道:“然而,我们认为这种变异体的出现将是一个令人担忧的发展,应该密切监测。”
2019年底,SARS-CoV-2首次出现的世界跟今天的世界不同。该病毒产生大量自身拷贝并在个人之间传播的能力是其在大流行初期取得成功的关键。然而随着通过疫苗接种和自然获得感染的人数增加,病毒将经历更多逃避免疫反应的压力。Lauring指出,许多变异都是有代价的,SARS-CoV-2也不例外。一个具有减少病毒传播的免疫逃逸变体在2020年初可能不被看好,但现在可能被看好。
“我们是病毒的环境,"Lauring说道,“如果我们改变了,环境就会改变。”

