一项由康奈尔大学威尔医学院和纽约长老会医院研究人员领导的新研究显示,一种被称为先天性淋巴细胞(ILC3s)的免疫细胞亚群可以预防结直肠癌,部分是通过帮助维持免疫系统和肠道微生物之间的健康“对话”。这一发现为治疗这种类型的癌症的新策略打开了大门。
研究人员在《细胞》杂志上发表的研究结果表明,ILC3s在结直肠癌患者中往往会急剧减少并发生功能改变。此外,他们证明,通过实验破坏ILC3s在小鼠中的功能会导致侵略性结肠癌,并大大降低癌症免疫疗法的效果。
结直肠癌是美国第四大最常见的癌症,每年约有15万个新病例,约有5万人死亡。虽然通过结肠镜筛查早期发现这些癌症或癌前息肉非常有效,但晚期结直肠肿瘤的治疗仍然是一个重大挑战,治疗方案有限。肿瘤学家特别关注这些肿瘤对免疫疗法的相对抵抗力--这些疗法通过提高免疫系统攻击恶性细胞的能力对其他一些癌症有很好的效果。
高级作者、胃肠病学和肝脏病学部门的医学微生物学和免疫学副教授、康奈尔大学威尔医学院吉尔-罗伯茨炎症性肠病研究所成员Gregory Sonnenberg博士说:“这些发现为结直肠癌的临床治疗提出了新的可能性,也有助于解释为什么这种类型的癌症常常对免疫疗法没有反应。”
影响免疫疗法抗性的一个因素可能是肠道微生物组,即居住在肠道中的细菌和其他微生物物种群体,它们通常帮助消化,支持各种代谢功能并在调节免疫系统中发挥作用。结直肠癌与慢性肠道炎症和正常微生物组的重大破坏有关。此外,最近的研究表明,患者的微生物组在控制癌症免疫疗法的结果方面发挥着关键作用,并可能解释为什么一些患者的癌症对治疗有或没有良好反应。
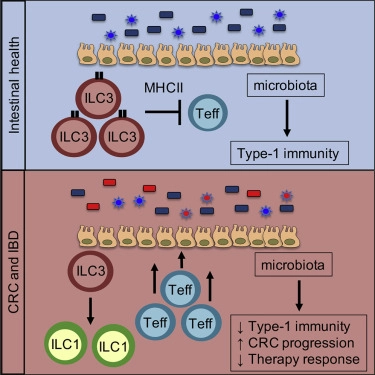
在这项新研究中,Sonnenberg博士及其同事,包括主要作者Jeremy Goc博士(Sonnenberg博士实验室的研究助理),研究了ILC3s的作用,ILC3s居住在肠道中,已知有助于调解免疫系统与肠道微生物之间的关系。
ILC3s细胞通常在维持下层肠道的微生物群和免疫环境之间的健康“对话”中起着关键作用。在与Bartlett家族胃肠道肿瘤学教授、血液学和医学肿瘤学部门胃肠道肿瘤学项目主任、威尔康奈尔医学院Sandra和Edward Meyer癌症中心成员Manish Shah博士的密切合作下,该研究小组分析了人类和小鼠的结直肠癌肿瘤和癌前息肉。他们发现,与健康组织相比,来自癌症组织的ILC3s相对枯竭,并进一步从根本上改变了其功能。
这项研究的共同作者Shah博士说:“这是一个令人兴奋的发现,可能对我们了解控制胃肠道恶性肿瘤的发病机制、进展和治疗反应性的途径具有广泛的意义,”他也是纽约长老会/康奈尔大学威尔医学院实体瘤肿瘤科主任和高级消化护理中心的共同主任。
在肠道内正常ILC3活性的丧失中,作者进一步观察到ILC3s调节一种叫做T细胞的特定免疫细胞亚群的能力被明显破坏了。ILC3s和T细胞之间对话的中断进一步导致了肠道内炎症的上升,随后改变了肠道微生物组。这些肠道微生物的变化反过来诱发了善于对抗肿瘤的T细胞水平的下降。
研究人员表明,这些集体结果对肿瘤的发展有重大影响。在患结肠癌的小鼠中,阻断ILC3信号传导导致异常侵袭性和更具侵略性的肿瘤生长,结果很差。当结肠肿瘤被植入ILC3信号阻断的小鼠体内时,肿瘤对一种名为抗PD-1检查点阻断的癌症免疫疗法的反应相对较差,而植入ILC3信号正常的小鼠体内的同类肿瘤对该疗法反应良好。
最后,在炎症性肠病(IBD)患者的结直肠组织活检中,研究人员发现ILC3相关的异常与结直肠癌患者的异常相似。将IBD患者的微生物移植到小鼠体内会产生抗药性--而移植了健康人类供体的微生物的小鼠对抗PD-1检查点阻断疗法仍然反应良好。
“更好地了解微生物组对癌症发展和治疗反应性的贡献可能会彻底改变病人的管理策略。”Goc博士说:“这项研究阐明了一种由微生物组失调驱动的治疗抗性机制,这种机制直到现在还没有被重视。例如,它表明有一天我们可以对肠道微生物群进行采样,以预测肿瘤的进展和对免疫疗法的反应性--甚至利用健康的微生物群来改善治疗反应性。”
研究人员现在正在努力确定在这方面最有益的肠道细菌种类。这项研究部分得到了癌症研究所的一种新的资助机制的支持。

