根据一项新研究,日本的专家们已经确定了免疫系统长期记忆的一个基本部分,为追求设计更好的疾病疫苗提供了一个有用的新细节,从COVID-19到疟疾等。这项研究已发表在《实验医学杂志》上,揭示了TBK1酶在决定免疫系统记忆B细胞的命运方面的新作用。
免疫系统由许多细胞类型组成,但与东京大学这一研究项目相关的两种类型是称为CD4+滤泡辅助性T细胞的白细胞和B细胞。身体识别出感染后,滤泡辅助性T细胞释放化学信号,使未成熟的B细胞学习并记住要攻击的病原体。这个T-B细胞信号传递和B细胞训练的过程发生在免疫系统器官中一个叫做生发中心的临时细胞结构内,包括脾脏、淋巴结和扁桃体。生发中心内发育的记忆B细胞在病原体第一次感染时就记住了它,然后如果它再次进入人们的身体,成熟的、训练有素的记忆B细胞就会在病原体繁殖之前诱导产生抗体来攻击它,使人们不会第二次感到不适。
来自东京大学医学科学研究所的项目副教授Michelle S. J. Lee是该研究的第一作者,他说:“接种疫苗的一个目标是产生高质量的记忆B细胞,以产生持久的抗体。”
“在设计长效免疫的疫苗时,有许多因素需要考虑,所以我们不应该只关注生殖中心。但如果你没有一个功能性的生殖中心,那么你将非常容易受到再感染,”Lee说。
然而,人们被蚊子叮咬并被疟疾寄生虫重新感染的次数是没有限制的。不知何故,疟疾寄生虫逃脱了记忆B细胞。尽管儿童比成人更有可能死于疟疾,但有些人尽管以前有过任何数量的疟疾感染,也会变得病情严重。寄生虫的这种防止和逃避有效B细胞的能力是使疟疾成为一种有趣的病原体的原因,Cevayir Coban教授领导东京大学医学科学研究所的疟疾免疫学部门,他是与Lee和大阪大学的合作者一起撰写该研究论文的最后一位作者。
“我们想了解自然免疫反应的基本原理。无论我们做什么,都应该以最终使疟疾患者受益为目标,”Coban说。“COVID-19大流行使全球关注传染病并对疫苗设计产生兴趣,因此我们有机会重新关注像疟疾这样被忽视的疾病。”
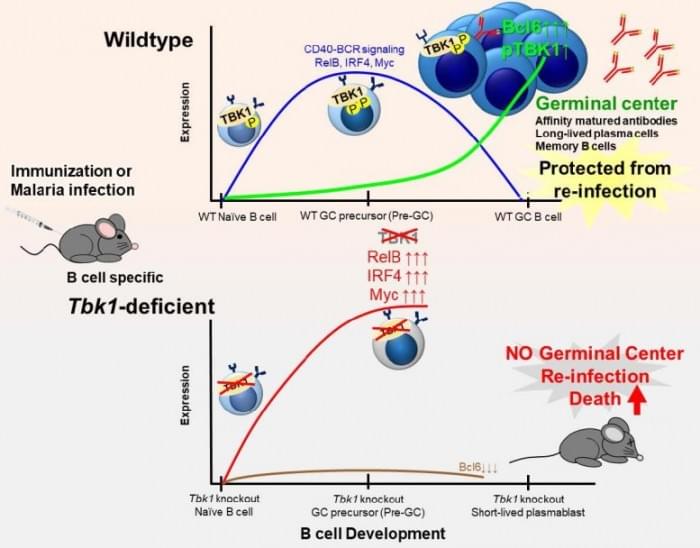
多年来,科学界已经确定了分子TBK1的广泛作用,这种酶可以通过添加化学标签改变基因或其他蛋白质的活性,其过程称为磷酸化。TBK1在抗病毒免疫中具有众所周知的作用。然而,没有研究小组将TBK1与B细胞命运和生发中心联系起来。
研究人员对小鼠进行了基因改造,这些小鼠的TBK1基因只在特定类型的细胞中没有功能,主要是B细胞或CD4+T细胞。这种细胞类型特异性的TBK1基因敲除使研究人员更清楚地了解一个有许多工作的基因在身体的不同细胞中的作用。Coban、Lee和他们的同事用疟疾寄生虫感染了这些改良小鼠和健康成年小鼠,观察它们的健康状况,然后检查它们的脾脏和淋巴结样本。
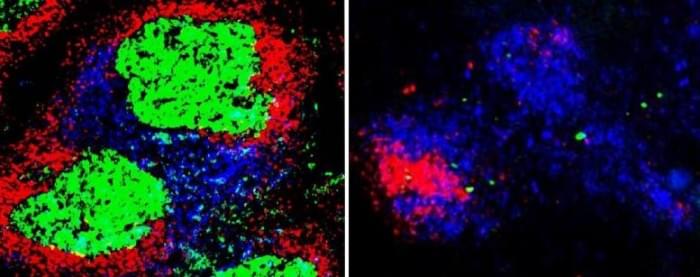
显微镜图像显示,生发中心只在B细胞中具有功能性TBK1的小鼠中形成。B细胞中没有TBK1的小鼠更容易死亡,并且比正常的同龄小鼠更早死于疟疾感染。其他实验显示,少数在B细胞中没有TBK1的小鼠在疟疾中存活下来,能够使用其他类型的免疫反应,但它们可以重新感染。
然而,仅从CD4+滤泡辅助T细胞中删除TBK1对生发中心或小鼠在疟疾感染中的表现没有影响。
进一步的分析证实,如果没有TBK1,与正常的未成熟B细胞相比,未成熟B细胞中的许多蛋白质有异常的磷酸化。对于不同的基因,异常的磷酸化可以导致活性的异常增加或减少。研究人员怀疑,在B细胞中,TBK1的活性作为某些基因的关闭开关,基本上关闭了将B细胞困在不成熟状态的基因。
Lee说:“这是第一次显示TBK1在B细胞中对形成生发中心和产生高质量的成熟抗体至关重要。”
研究人员希望,最终随着对免疫系统剩余奥秘的更多基本知识的了解,未来的疫苗可以被设计成产生更持久的免疫力,有可能不需要多剂量的疫苗。然而,疫苗设计总是会因为每种病原体及其变异版本的独特品质而变得复杂,尤其是像SARS-CoV-2(导致COVID-19的病毒)这样快速演变的病原体。
Coban说:“目前,我们至少可以说,为产生持久的保护性免疫力而定制的有效疫苗不应降低B细胞中的TBK1活性。”

