声动力疗法利用超声波与药物结合,在肿瘤部位释放有害的活性氧(ROS)。然而,这种治疗方法并不十分有效,因为癌细胞可以激活抗氧化剂防御系统来对抗它。根据发表在《ACS Central Science 》杂志上的一项研究,科学家用CRISPR/Cas9基因编辑突破了这些防御系统,使声动力疗法能够有效地缩小小鼠肝癌模型中的肿瘤。
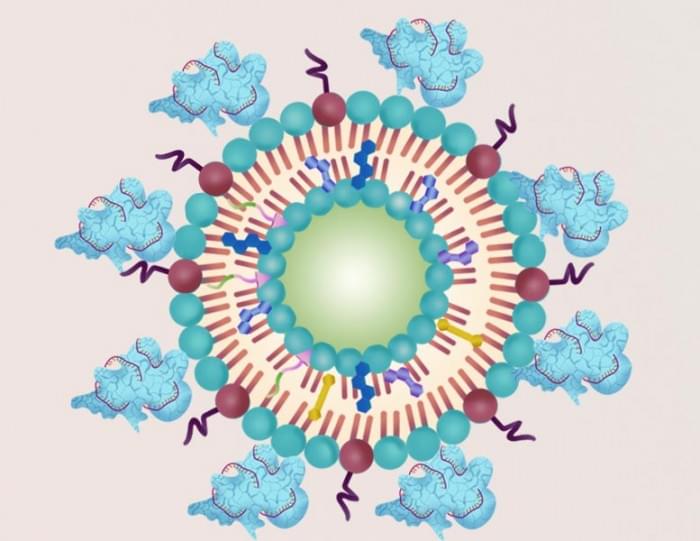
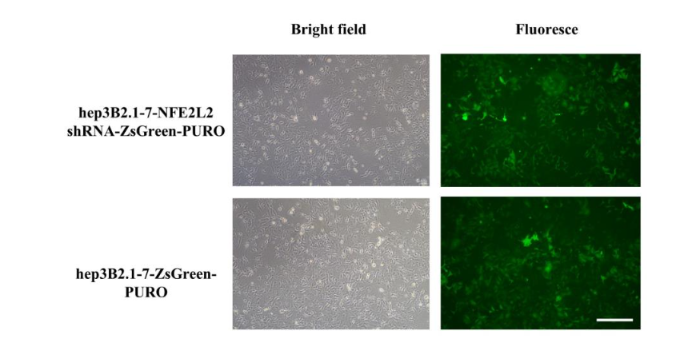
肝细胞癌是最常见的肝癌形式,预后很差,通过切除部分肝脏或移植健康肝脏的手术治疗不适合于疾病较晚期的患者。由于超声波可以渗透到组织深处,因此超声疗法可以成为治疗肝细胞癌的一种有效、非侵入性的方法。但目前,癌细胞可以通过激活一种名为核因子红细胞2相关因子2(NFE2L2)的基因迅速克服治疗,该基因部署了细胞的解毒和抗氧化酶防御功能。CRISPR/Cas9基因编辑技术已被用于在实验室中敲除基因表达。因此,冯伟、徐辉雄、陈宇(音译)及其同事想知道他们是否能通过使用这种技术减少NFE2L2的表达来提高超声疗法的有效性。
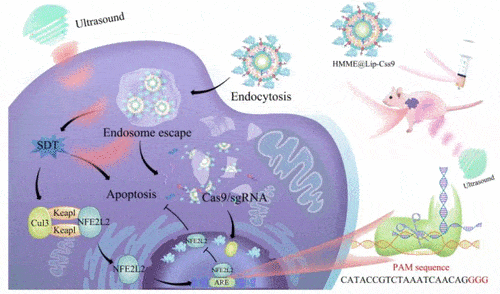
作为第一步,研究人员将CRISPR/Cas9系统和一种ROS前体分子封装在脂质纳米颗粒中。然后,他们在培养皿中用纳米粒子处理肝癌细胞。脂质纳米颗粒被细胞的溶酶体所吸收。超声波处理引起了ROS的形成,它使溶酶体破裂,允许CRISPR/Cas9系统进入细胞核并敲除NFE2L2基因表达。ROS还破坏了其他细胞成分。结果,与没有进行NFE2L2基因编辑的情况相比,有更多的癌细胞在超声疗法中死亡。
接下来,该团队将纳米粒子疗法注入植入人类肝细胞癌肿瘤的小鼠体内。在纳米粒子和超声联合治疗15天后,小鼠身上的所有肿瘤都消失了,而且没有再出现。单纯用超声治疗的小鼠的肿瘤比未治疗的小鼠少,但加入CRISPR/Cas9系统后,治疗的效果明显提高。研究人员表示,由于基因编辑只发生在超声照射下的肿瘤组织中,它不会导致健康组织的基因突变。

