创建用于精准医疗的纳米级计算机,长期以来一直是许多科学家和医疗机构的梦想。现在,美国宾夕法尼亚州立大学研究人员首次研制出一种纳米“计算机”,可控制参与细胞运动和癌症转移的特定蛋白质的功能。这项发表在16日《自然·通讯》上的研究,为构建用于癌症和其他疾病的复杂设备铺平了道路。
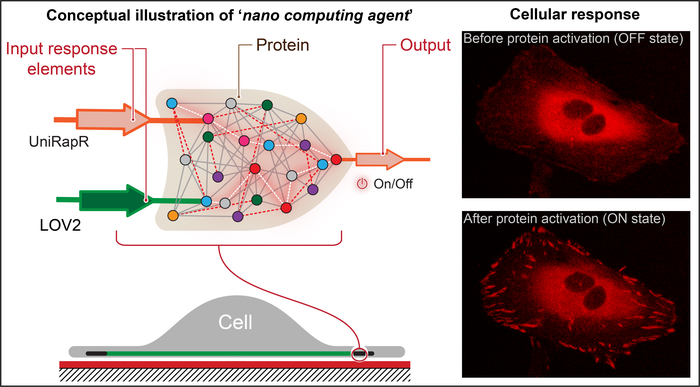
宾夕法尼亚州立大学医学院尼古莱·多霍利安教授及其同事创造了一个类似晶体管的“逻辑门”,可执行计算操作,由多个输入控制一个输出。
多霍利安称,这个逻辑门是一个重要的里程碑,因为它展示了在蛋白质中嵌入条件去操作并控制其功能的能力。这将给更深入地了解人类生物学和疾病,以及精准疗法的开发带来可能性。
逻辑门包括两个传感器域,旨在响应两个输入——光和药物雷帕霉素。研究团队瞄准了蛋白质焦点黏附激酶(FAK),因为它涉及细胞黏附和运动,这是转移性癌症发展的初始步骤。
研究人员首先在编码FAK基因中引入一个名为uniRapr的雷帕霉素敏感域,该域之前由实验室设计和研究过。然后,研究人员引入对光敏感的域LOV2。对两个域进行优化后,研究人员将它们组合成一个最终的逻辑门设计。
研究团队将修改后的基因插入HeLa癌细胞,并使用共聚焦显微镜在体外观察细胞。他们分别研究了每个输入对细胞行为的影响,以及组合输入的综合影响。
研究发现,他们不仅可以使用光和雷帕霉素快速激活FAK,而且这种激活导致细胞内部发生变化,从而增强了它们的黏附能力,最终降低了运动性。
研究人员称,这是第一次证明可在活细胞内构建一种可控制细胞行为的功能性纳米“计算机”。

