近日,顶尖学术期刊《自然》发表了一项临床前研究,为帕金森病晚期患者打开了一扇通向新疗法的大门。帕金森病是仅次于阿尔茨海默病的第二常见的神经退行性疾病,影响着数百万人的健康。过去几十年的研究指出,帕金森病患者的大脑中,释放多巴胺的神经元不断丢失,导致这些神经细胞调节的运动功能被破坏,由此出现动作迟缓、僵硬、难以控制的震颤等运动障碍症状。
左旋多巴(levodopa)是目前常用的一种药物,用以替代多巴胺,帮助帕金森病患者减轻症状。可是,随着时间推移,左旋多巴变得不那么有效,使晚期帕金森病患者的治疗格外困难。
在这项新研究中,美国西北大学(Northwestern University)的科研人员揭示了帕金森病导致运动障碍的新机制,并基于新机制的发现设计了一项基因疗法,有助于提高左旋多巴对晚期帕金森病的疗效。

在以往的研究中,人们发现大脑中一小块被称为黑质(substantia nigra)的区域,其中释放多巴胺的神经元是在帕金森病中率先受损的神经元。在这些神经元中,研究人员还注意到了线粒体损伤这一特征。
线粒体相当于细胞的发电厂,是能量生产至关重要的一种细胞器。然而,线粒体损伤是帕金森病的成因还是结果,长期存在争议。在神经科学家James Surmeier教授看来,厘清这个问题,对于开发有效的疗法非常关键。如果证明线粒体损伤是疾病的成因,那么设法保持线粒体的功能,有望减缓或阻止帕金森病的进展。
为了回答上述争议,Surmeier教授的研究团队采用先进的遗传学工具,构建了一种新的基因工程小鼠,通过干扰多巴胺能神经元中的线粒体复合物I功能,使这些神经元的线粒体代谢出现问题。由于“发电厂”停工,这些细胞缺少足够的能量,最终会耗竭死亡。
然而研究人员发现,在线粒体受到损伤后,这些神经元出乎意料地在相对长的时间内保持完整。起初,这些神经元延伸到相邻脑区纹状体(striatum)的轴突减少多巴胺释放。纹状体失去多巴胺一直被认为是导致帕金森病运动障碍的唯一原因,然而实验表明,仅仅是纹状体减少多巴胺后,小鼠虽然会发生精细运动的障碍,但还不足以发生帕金森病相关的运动缺陷。
研究人员观察到,小鼠的这些神经元实际上还通过胞体和树突在黑质部位释放多巴胺,维持着特定的运动功能。一直到几个月后,神经细胞向黑质释放的多巴胺也越来越少,最终,轴突退化,细胞慢慢死亡。与此同时,这些小鼠表现出了人类晚期帕金森病中典型的运动障碍。
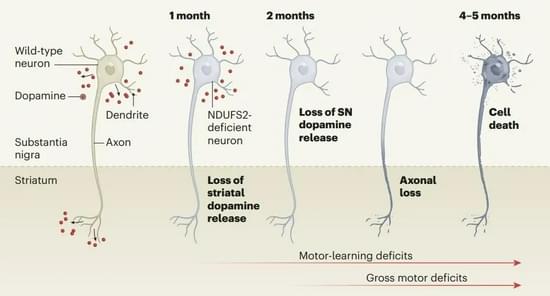
根据上述实验结果,研究人员总结了他们的两项重要发现:线粒体功能受损足以导致帕金森病的发展,并且黑质失去释放多巴胺的功能是发生运动障碍的关键。
这些新发现为科学家们提供了一个新的治疗目标:在黑质中补充多巴胺。研究人员设计了一种靶向黑质的基因疗法,使那里的细胞能够把左旋多巴转换为可利用的多巴胺。在小鼠中开展的概念性验证实验表明,这种疗法有效提高了左旋多巴在帕金森病晚期阶段的治疗作用。
Surmeier教授评论说,他们希望基于线粒体障碍建立的帕金森病新模型,可以帮助他们开发出新的检测方法,提前5到10年诊断出帕金森病患者,从而尽早开始治疗,最终帮助患者改变疾病进展。

