一些研究已经发现,新冠病毒的Delta变体的传染性是以前的变体的两倍以上。然而,究竟是什么促使Delta变体能够如此迅速地传播,这一点还不清楚。现在,一种新的实验室策略使得快速和安全地研究SARS-CoV-2变体的突变效果成为可能,它提供了一个答案:Delta中一个鲜为人知的突变使病毒能够将更多的遗传密码塞入宿主细胞,从而提高了每个受感染细胞将病毒传播给另一个细胞的机会。
马里兰大学巴尔的摩分校的结构生物学家Michael Summers表示,周四发表在《科学》上的这一发现是“一件大事”--不仅仅是因为它有助于解释Delta变体的破坏。他说,由诺贝尔奖得主、加州大学伯克利分校的Jennifer Doudna和她的同事开发的这个新系统是了解当前SARS-CoV-2变体和探索未来变体如何影响大流行的有力工具。他表示:“她开发的系统允许你查看任何变异及其对病毒复制的关键部分的影响。......现在可以由更多的科学家以一种更容易的方式进行研究。”
分析新冠病毒基因组中的突变如何影响其活动的研究人员集中在刺突蛋白上。这项研究需要高水平的生物安全设施--探测单个突变的最佳工具是所谓的"假病毒",即由不同的病毒(通常是慢病毒)制成的构建体,可以在其表面表达一种冠状病毒蛋白。但是慢病毒只表达刺突蛋白,而不是SARS-CoV-2的其他三种结构蛋白。
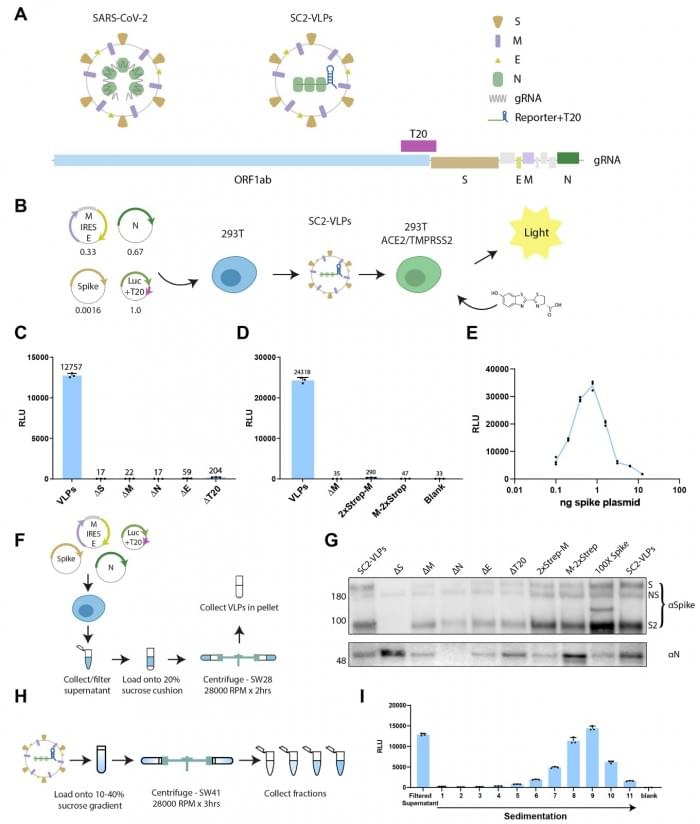
Doudna和她的团队通过调整被称为病毒样颗粒(VLPs)的实验室构建物制成了这个新工具,VLPs包含所有病毒的结构蛋白,但缺乏其基因组。从外面看,SARS-CoV-2病毒样颗粒与成熟的病毒完全一样。它可以在实验室中与细胞结合并侵入它们。但由于它被剥夺了病毒的RNA基因组,它不能“劫持”一个细胞的“机器”来复制和冲出宿主细胞来感染更多的细胞。“它是一张单程票。它不会传播,”洛克菲勒大学的分子病毒学家 Charles Rice,说。
Doudna和她的同事,包括共同第一作者Melanie Ott,一位病毒学家和Gladstone病毒学研究所所长,为VLPs系统增加了一项新的创新。他们插入了一段信使RNA(mRNA),使被VLPs入侵的细胞发亮并发光。细胞在被VLPs感染后发出的光越亮,说明VLPs成功传递的mRNA越多。
接下来,研究人员用各种突变对VLPs的蛋白质进行了调整。其中一个是R203M,这是一个在Delta变体中发现的突变,它改变了核衣壳,一种藏在病毒内部包装其RNA基因组的蛋白质。核衣壳蛋白是病毒复制中的一个核心角色,其作用包括稳定和释放病毒的遗传物质。它包含一个突变热点:在大多数研究的样本中,每个SARS-CoV-2变体都有一个7个氨基酸的突变。R203M是这个热点中的一个突变。
这项工作“揭示了一个惊喜,”Doudna说。根据VLPs的发光强度,“在Delta的核衣壳蛋白中发现的一个氨基酸变化使颗粒的mRNA比原始病毒多10倍!”感染了携带Alpha和Gamma变体中发现的N型突变的VLPs的细胞分别发出了7.5倍和4.2倍的光芒。
科学家们接下来在适当的实验室生物安全条件下测试了一种真正的冠状病毒,该病毒被设计成包括R203M突变。在实验室中侵入肺部细胞后,这种变异病毒产生的传染性病毒是原始SARS-CoV-2病毒株的51倍。
在感染新冠病毒的人中,一个细胞产生的病毒颗粒中只有很小的一部分能够真正感染另一个细胞,部分原因是许多病毒颗粒缺乏部分或全部病毒RNA基因组。因此,使病毒更有效地将RNA放入宿主细胞内的突变可以提高产生的感染性颗粒的数量。

