美国利哈伊大学和洛桑大学的一个多学科科学家团队发现并描述了裂殖酵母细胞获得其管状形状的新机制。在洛桑大学马丁实验室的实验生物学家所进行的研究中利用光来激活转基因裂殖酵母细胞内的进程,该实验室由教员Sophie Martin领导。
团队成员在进行此类实验时注意到,某种蛋白质被引入细胞后,会从细胞生长区域移位。因此,他们联系了Dimitrios Vavylonis,他领导着利哈伊大学物理系的Vavylonis小组,以找出原因。
理论物理学家Vavylonis说:"我们接着做了一个计算模拟,将细胞膜'生长'与蛋白质运动结合起来,并对我们与他们讨论后考虑的其他一些假设进行建模。"
这种多学科合作结合了建模和实验来描述一个以前不为人知的生物过程。这些团队发现并描述了一个简单的酵母细胞用来获得其形状的新机制。他们在最近一期《科学进展》杂志上发表的一篇名为"通过分泌物诱导的质膜流动实现细胞图案化"的论文中描述了这些结果。
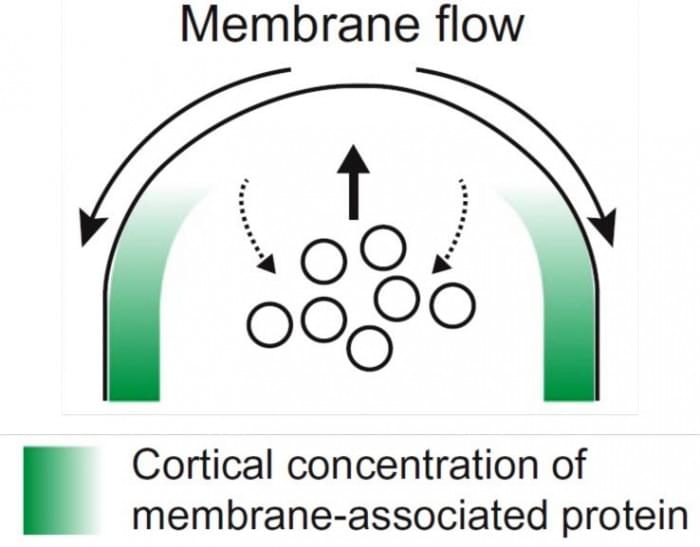
图片描述了膜流动对细胞膜相关蛋白分布的影响。具有低流动性的蛋白质(绿色)与流动相耦合,并从分泌区被耗尽。
Vavylonis说,当细胞移动或生长时,它们必须向这些生长区域添加新的膜。膜的输送过程被称为外渗。细胞还必须将这种膜输送到一个特定的位置,以保持一种叫做"极化"的方向感,或者以一种协调的方式生长。
"我们证明了这些过程是耦合的:局部过量的外泌作用导致一些附着在膜上的蛋白质从生长区域移动('流动'),"Vavylonis说。"这些移开的蛋白质标志着非生长细胞区域,从而建立了一个自我维持的模式,这就产生了这些酵母细胞的管状形状"。
这是第一次发现这种细胞模式化的机制:细胞在其表面获得空间不均匀性的过程。实验结果经过分析后确认他们在模拟中注意到的蛋白质分布与从活细胞实验中收集到的数据相符。
该团队说,这项工作可能对研究与细胞生长和膜交通有关的过程的研究人员特别感兴趣,如神经生物学家和研究癌细胞过程的人。
"我们的工作表明,生物系统中的模式通常不是静态的,"Rutkowski说。"模式通过涉及连续流动和周转的物理过程建立起来。"
"我们能够为通过膜流动的模式化模型提供支持,"Vavylonis说。"最后,小组能够利用这些知识来设计其形状可由光控制的细胞。"

