据英国《自然》杂志近日发表的一项癌症学研究,美国科学家团队描述了通过限制热量“饿死”癌细胞的最新线索——饮食模式抑制胰腺癌小鼠模型肿瘤生长的独特机制。研究人员表示,这一发现的目的并不是推荐饮食,而是真正了解潜在的生物学机制,其描述了热量限制饮食如何抑制癌细胞生长,并为未来新药的研发提供了方向。
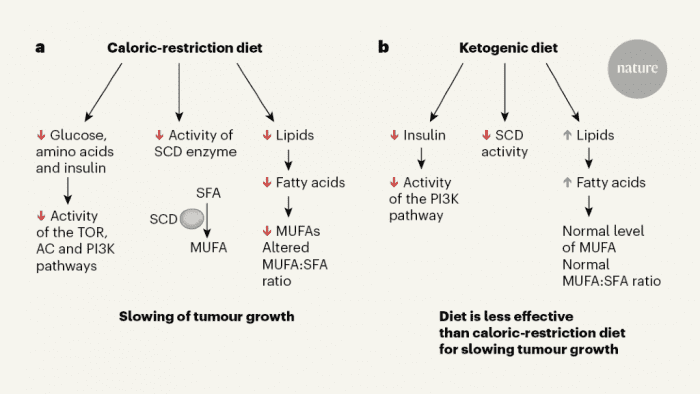
热量限制和生酮饮食等低血糖指数饮食干预,被认为能改变肿瘤生长——能让血糖水平和胰岛素水平的峰值控制在最低,该效应与一些动物模型的肿瘤生长受到抑制有关。但是,与这类饮食相关的其他代谢变化是否会影响肿瘤生长,一直有待研究。此次的最新分析表明,限制热量能通过改变肿瘤的血脂水平限制肿瘤生长。
美国麻省理工科赫综合癌症研究所科学家马休·凡达·海登和哈佛大学医学院丹娜—法伯癌症研究中心的科研人员合作,分析了热量限制和生酮饮食对胰腺癌小鼠模型的影响。实验发现,正是热量限制而非生酮饮食能降低血浆和肿瘤的血脂水平,还会降低癌症用来适应低血脂环境的一种酶的活性,这会打破不饱和脂肪和饱和脂肪的平衡,从而使得肿瘤生长显著减慢。虽然生酮饮食也会破坏这种酶的活性,但生酮饮食会同时提供大量的脂肪,使血脂增多,从而将不饱和脂肪与饱和脂肪的比例维持在对肿瘤生长有利的水平。
除了小鼠实验外,研究团队还分析了1165名胰腺癌患者的饮食模式与生存时间之间的关系。初步的发现显示,脂肪含量高、碳水化合物含量低的饮食可能与患者生存时间更长有关。
但研究人员也指出,低血糖指数饮食并不适合所有癌症患者,这种饮食有时很难坚持和耐受,体重下降也可能限制治疗方案的选择。他们认为,进一步研究饮食会如何影响干预肿瘤生长的代谢变化,或能指导如何在已有的癌症治疗策略中加入模拟这类作用的饮食或疗法,同时开发新药以抑制这种酶的活性。

