2021年3月,刚刚从寒冬中复苏的美国马里兰州,又遭遇了新一轮的新冠疫情增长。对于在这里的美国国立卫生研究院(NIH)工作的传染病专家Veronique Nussenblatt医生来说,头疼的不仅是再次上涨的新增病例曲线,还有面前的病人。
▎药明康德内容团队编辑
这名女性患者今年47岁,躺在病床上的她不时发出咳嗽声,呼吸短促。新冠检测结果表明,她的体内有大量新冠病毒。但与周围的其他新冠肺炎患者不同的是,这位病人并非近期才遭受感染:她的症状已经持续了300多天,是已知遭受感染时间最长的新冠患者。近日,《科学》网站报道了这个罕见的案例,研究论文也已公开于预印本平台(尚未经同行评议)。在接近一年的时间内,病毒在人体发生了哪些变化?从她身上,我们能找到怎样的病毒演化线索?

一
2020年5月,Nussenblatt医生就见过这位患者了。在那之前大约10天,病人出现了发烧、头疼、咳嗽、鼻塞等症状。随着症状的持续,她来到了NIH的临床中心,诊断结果是新冠肺炎。而在查看了患者的既往病史后,Nussenblatt医生意识到病人的情况有些特殊:她不仅是一位2型糖尿病患者,还是一位癌症康复者。
3年前,患有弥漫性大B细胞淋巴瘤的她接受了CAR-T疗法的治疗,这种新兴疗法利用经过改造的T细胞识别癌细胞表面的抗原,成功清除了她的淋巴瘤。美中不足的是,这种激进的疗法也让她的B细胞发育遭遇障碍。对于这类缺乏足够B细胞的免疫低下人群,普通的感染也可能带来更严重的威胁。
好在,这位新冠患者的病情没有那么严重。经过一个月的恢复期血浆和免疫球蛋白治疗,患者出院了。不过她并没有完全康复,还伴随着低烧、间断性咳嗽,并且需要辅助供氧。之后的几个月,她定期接受新冠检测,结果总是在阴性与弱阳性之间摇摆。由于症状较为轻微,因此从新冠检测的结果来看,弱阳性更可能是由无法存活的病毒片段导致的。毕竟对大多数人来说,新冠病毒的RNA在感染几个月后仍然有可能被检测到,但活病毒在出现症状10天后一般就检测不出来了。
就这样,患者在阴性与阳性之间反复,症状也时有时无。直到今年3月,她的呼吸道症状明显加重。她的C反应蛋白水平上升,这种血浆中的急性蛋白在身体受到感染时大量出现;同时,新冠病毒载量也显著增加。于是,她又一次因新冠肺炎住进了NIH的病房。
此时,瑞德西韦(remdesivir)已经获得FDA的批准,用于治疗新冠肺炎。于是Nussenblatt医生使用了10日疗程的瑞德西韦,辅以高滴度的恢复期血浆治疗。很快,患者的病情明显好转了。
二
这时,Nussenblatt医生和同事无需再过度担忧这位患者的安危,于是他们将重心转移到了科学研究上。他们相信,在这位令他们困惑的患者体内,一定隐藏着更多关于新冠病毒的线索。
首先要明确的是,患者是在冬季康复之后再次遭受了新冠病毒感染,还是说,她体内的病毒一直存在、根本没有被彻底清除?
要回答这个问题,对患者体内病毒的基因测序必不可少。领导这项工作的是NIH的分子病毒学家Elodie Ghedin博士和计算生物学家Allison Roder博士。治疗团队仍然保留着患者首次就诊时的病毒样本,因此她们得以分别对去年5月及今年3月的病毒进行全基因组测序。结果显示,时隔300多天的两组病毒属于同一株,也就是说,病毒从未离开过这位患者。
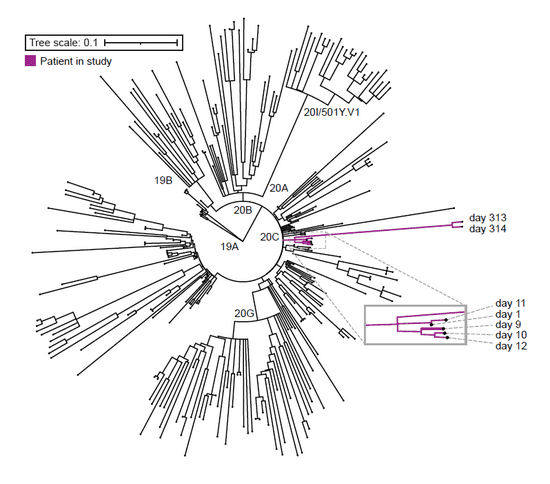
前面我们提到,新冠病毒在大多数患者体内生存时间很有限。但这位患者属于免疫低下人群,她自身的免疫系统不足以在初次感染时杀灭病毒。于是,低载量的病毒在体内若隐若现,潜伏了10个月,直至再次暴发。
类似的情况此前也有过报道。去年12月,《新英格兰医学杂志》的一篇文章就报道了一位45岁的免疫低下者的病例,新冠病毒在他体内存活了5个月,直至最终导致他死亡。而本文的这位患者更是携带新冠病毒超过300天,这也是已知感染新冠病毒时间最长的患者。
三
通过这位患者,我们看到的是新冠病毒在人体内演化的情景。在接近1年的演化过程中,病毒经历了哪些突变?这些突变对病毒的特征、传播能力产生了怎样的影响?
通过病毒基因序列的对比,研究团队发现了两处有意思的基因缺失。其中一处位于编码刺突蛋白的RNA上,导致刺突蛋白中特定的N端结构域丢失。我们知道,刺突蛋白是新冠病毒用于与宿主细胞结合的位点,而N端结构域的缺失使得一些特定抗体失效。免疫低下人群N端结构域缺失的原因尚不明确,但之前,剑桥大学流行病学家Ravindra Gupta教授就在研究中发现,接受(富含抗体的)恢复期血浆治疗的免疫低下宿主容易出现此类突变,因此对中和抗体的敏感性下降。而本文中患者的经历,为这一现象提供了新的证据。
在Gupta教授看来,这一现象提醒我们,对于免疫低下新冠患者的治疗需要格外谨慎。例如,我们还不清楚,目前使用的单克隆抗体疗法是否同样会加速病毒在这类患者体内的演化。因此,尽可能避免免疫低下人群遭受感染十分关键。这不仅是为了保护他们的生命安全,也是为了避免新型突变的诞生——Gupta教授之前就提出,首先在英国出现并成为全球主要毒株的新冠病毒阿尔法突变株,最初可能就是在免疫低下者体内出现的。
对于NIH团队来说,与刺突蛋白有关的突变固然重要,但他们更感兴趣的是另一处与刺突蛋白无关的突变:497个核苷酸丢失,编码辅助蛋白ORF7b和ORF8的区域被完全删除。这是首次在免疫低下者体内,发现如此大规模的基因缺失。
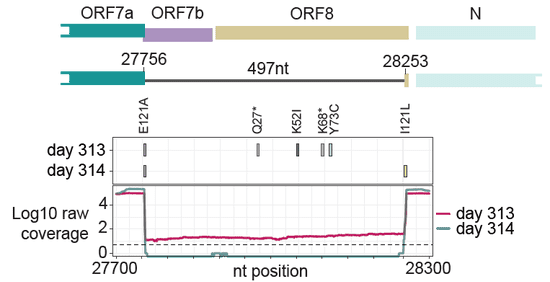
尽管并非位于刺突蛋白上,但在病毒入侵人体的过程中,ORF8蛋白同样起到重要作用。例如今年6月,中山大学团队的一项研究就发现,ORF8蛋白能诱发免疫逃逸。而本文患者编码ORF8蛋白基因的缺失,可能是自然选择的结果:新冠病毒在入侵免疫低下的患者时,根本不需要ORF8蛋白来躲避免疫系统的攻击;相反,缺少ORF8蛋白的病毒复制速度更快,在竞争中更有优势——这正是本文研究团队在患者的病毒样本中观察到的趋势。
这一现象也提醒我们:新冠病毒在一些免疫低下患者体内的长期演化,还可能产生其他有利于病毒传播的突变,因此慢性新冠肺炎患者体内病毒的变化需要格外引起警惕。
四
但这显然不是Nussenblatt医生的这位患者需要担心的问题,她漫长而波折的新冠故事还是迎来了令人欣慰的结局。今年3月接受了11天的住院治疗后,她的肺功能得到改善,血液中C反应蛋白明显减少。最终,从首次就医的那天算起,她遭受新冠病毒感染的时间定格在335天——自那时起,她的多次新冠检测结果均为阴性,后遗症也逐渐消退。
而对于Nussenblatt医生和其他研究者来说,一条充满吸引力的崭新研究道路已经铺开。新冠病毒不断突变带来的威胁让我们始终被笼罩在乌云之下,而从这类特殊患者身上寻觅的病毒演化线索,或许将让我们拨云见日,找到理解、对抗病毒突变的方向。

