
1. 3月31日,美国FDA对Abiomed公司生产的Impella心脏泵发出一级召回,该产品已导致129人重伤,其中49人死亡,66000多件产品存在安全隐患。本次召回涉及2021年10月10日到2023年10月10日间包括Impella 2.5、Impella 5.0等6个型号在内的产品。该人工心脏泵导管在手术过程中可能会刺穿心脏左心室壁,导致左心室穿孔、离壁破裂、高血压供血不足以及死亡等严重不良后果。这次召回已是该公司在过去十五个月时间内第四次召回这款产品。
2. 本次召回的Impella 2.5心脏泵曾于2013年引进到中国,但此次召回涉及的是2021年10月10日以后的产品,国内这款产品从2017年后注册已失效。有数据显示河南有医院已做过六例该心脏泵辅助装置手术,但这款产品定价高昂,可能影响其在国内的广泛使用。
3. 召回Impella心脏泵不代表要打开心脏取出,Impella 2.5、Impella 5.0等系列心脏泵一般经皮介入放置,只会在体内停留4-14天不等,因此召回心脏泵只代表2021年10月10日到2023年10月10日期间生产的产品不能再继续使用。尽管召回级别严重,但本次心脏泵是某个批次的问题,而不是整体设计上的问题,Abiomed通过“发布召回”提醒注意潜在风险,而非下架该产品。

全世界最小的人工心脏出事了?FDA不到十五个月,就四次召回,已致49人死亡129人受伤,涉及六万多件产品召回
3月31日,美国FDA发出一款心脏泵最高级别警报。对于阿比奥梅德公司(Abiomed)生产的Impella心脏泵发出一级召回,也即最高级别召回。 据悉,心脏泵能够在医疗过程中或严重心脏病发作后对心室中的血液泵送提供短期支持。FDA表示,召回这款心脏泵的原因是,其泵导管在手术过程中可能会刺穿心脏左心室壁,并导致严重不良后果。包括左心室穿孔、离壁破裂、高血压供血不足以及死亡。数据显示,该产品已导致129人重伤,其中49人死亡,66000多件产品存在安全隐患。
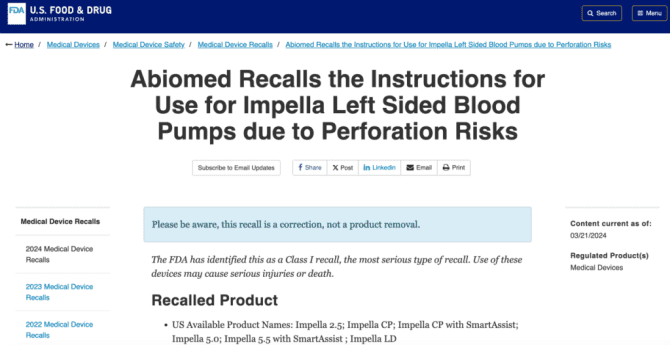
涉事公司Abiomed公司拥有目前全球唯一获得美国FDA认证的介入式人工心脏——Impella,被称为“世界上最小的人工心脏”。至今在全球范围内,已有23万多名患者接受了Impella系列产品治疗。
此次召回的心脏泵共涉及6个型号,具体包括Impella 2.5、Impella 5.0、Impella LD、带Smart Assist功能的Impella 5.5、Impella CP以及带Smart Assist功能的Impella CP。此次召回涉及2021年10月10日到2023年10月10日、除RP(RP属于右心装置,其他产品都属于左室辅助装置)外的所有产品。 美国境内共有66390件产品被召回,2.6万件产品则在美国境外各国与地区被召回,其中涉及中国台湾省与香港特区。
据了解,这已是这家公司在过去不到十五个月时间内,第四次召回这款产品了。 而在过去的2023年一年内,就有三款产品被召回。
去年4月,因泄漏清洗液,该公司对Impella 5.5心脏泵进行了部分召回。6月,因凝血高出标准,对RP Flex心脏泵(右心装置)进行了召回。同月,因Impella心脏泵与经导管主动脉瓣置换(TAVR)支架之间可能存在相互作用问题,出现了四起与此相关的死亡。7月,对Impella心脏泵召回,原因是器械损伤。据悉,在2021年10月发布的一份技术公告中,Abiomed曾向医生披露了插入设备期间心脏穿孔的风险。但并未向FDA报告。
据媒体报道,这四次召回的Impella产品,均未涉及中国。事实真相如何?这些Impella心脏如何召回,难道要“打开心脏取出”?

美国此次召回的产品中有一款与中国获批准的一样,是否波及中国?河南有医院曾报道做过六例
据《CC情报局》查询,美国Abiomed公司生产Impella 2.5心脏泵曾于2013年引进到中国,但2017年注册到期后并未重新注册。事发后,媒体报道,此次美国召回的六款产品均未涉及。但事实究竟如何?

《CC情报局》查询FDA发布的召回通知详情,发现这次召回的六款产品中,也同样有Impella 2.5,但此次召回涉及2021年10月10日以后的产品,国内这款产品从2017年后注册已失效。
那么这款Impella 2.5在国内应用情况如何?据媒体报道,2019年7月,阜外华中心血管病医院高传玉教授团队已经做了国内第三例Impella 2.5心脏辅助装置。高教授在2018年12月17日,做了河南省首例经股动脉置入Impella 2.5心脏辅助装置手术。

其后,2023年1月的《灌注》杂志曾发表过一篇《Outcome of Impella 2.5 use in patients undergoing Percutaneous Coronary Intervention in Henan, China: a case series》(中国河南省接受经皮冠状动脉介入治疗的患者使用 Impella 2.5的结果:病例系列),共报道了这家医院进行的六例接受左心室辅助装置(LVAD,Impella 2.5)的病例,其中两名接受手术的患者死亡。
另有数据显示,2014年9月至11月,4名患者在阜外医院接受了Impella 2.5植入。
这款产品在国内上市后,究竟应用了多少例,目前并无确切数据。
据了解,这款产品定价高昂,可能影响了其广泛使用。北京安贞医院心外科主任医师张海波在接受媒体采访时称:“这款产品在国外有近20年的应用历史,也曾在中国上市过。因其价格高达一二十万,且操作较为复杂,在国内并未得到推广,临床应用相对较少。”


召回Impella心脏泵要打开心脏取出吗?这次召回并不意味着下架,也不会回收产品,仅只是发布警告?
Impella心脏泵召回事件发生后,很多人觉得召回难道是“打开心脏取回”?但其实这是误解。事实可能与你想的不一样。
Impella心脏泵主要用于心衰患者,特别是在冠心病患者做冠脉支架时可以起到“保护”作用。另一类是用于晚期心衰、急性心梗或爆发性心肌炎导致心源性休克后,需要临时性地辅助心脏泵血功能,以维持血流稳定、保护心肌,属于过渡性措施。具体而言,就是Impella心脏泵可以通过股动脉穿刺进到心脏内,通过里面很小的一个泵将血液抽出来,再打到主动脉里去,有效减轻心脏的负担。
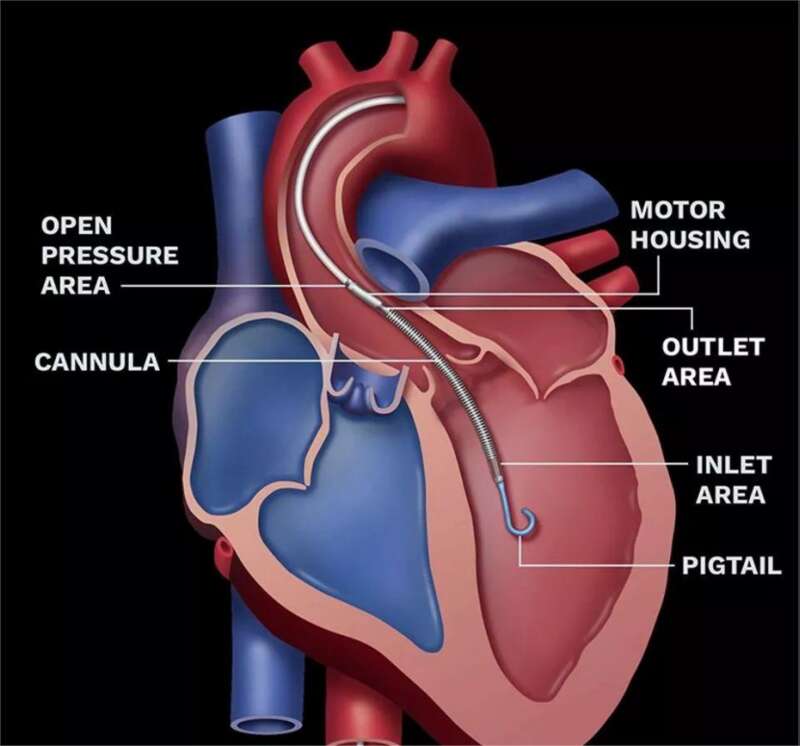
所以这只是一种短期机械循环辅助装置。 据一位化名为“兔狲窝子”的心内科医生在接受采访时称: “Impella 2.5和Impella CP两款产品,一般经皮介入放置,均不超过4天。Impella 5.0、Impella LD、带Smart Assist功能的Impella 5.5的产品,通过外科手术放置时间不超过14天。” 所以,已经放进去的就放进去了,置入后4-14天内会取出来。 还没放进去的在2021年10月10日到2023年10月10日期间生产的产品不能再继续使用。
虽然这款系列产品导致了49人死亡、上百人重伤,但这次召回并不意味着这款产品将要下架。尽管召回级别严重,但Abiomed公司并未实际回收产品,而是通过“发布召回”举措来提醒医疗人员注意潜在风险,并强调产品无需回收或替换。FDA也强调,这次的产品召回只是产品修正,并不意味着下架。
3月底Abiomed公司召回其6个型号的Impella心脏泵,这次是历史上最大规模的召回。主要措施是更换使用说明书、新增关于心室穿孔风险的5条警告而已。据业内人士称,Impella设备相对常见的不良反应是容易在心室内贴壁,造成引流不畅,而穿破心脏等并发症相对少见,召回所做的是进行技术修正与改良,而非否定这类器械的临床应用价值。所以应该是这款产品某个批次的问题,而不是整体设计上的问题。
随着心脏泵随着使用者越来越多,存在问题也开始逐步暴露。需要强生(于2022年收购了Abiomed)去给医生做更多培训以及进行技术升级,毕竟Impella潜在市场是非常庞大的。
相信经过多次的召回改进,这款“全世界最小的人工心脏”,将会被改进得更为安全有效。

▎ 脱口秀演员王十七透露,自已因心衰安装了中国自主研发的第四代全磁悬浮人工心脏。这款产品由苏州同心医疗研制,于2021年获批上市。
据了解,中国约有1370万心衰患者,每年能匹配到心脏移植的患者仅有600多例。供体非常稀缺,对于人工心脏的需求量极大。
国内现在研究Impella国产化器械的公司仍处于实验阶段。截止目前中国已有三家公司生产的人工心脏(均为植入式左心室辅助系统)获批上市,但价格昂贵。据“医械云3.0”数据显示,重庆永仁的植入式左心室辅助系统参考价格为99.8万元,接近百万的天价。

