本文来自微信公众号:医药魔方Info(ID:yiyaomofanginfo),作者:不加盐,原文标题:《刚刚,先声药业3CL新冠药物获批上市》,题图来自:视觉中国
1月29日,国家药监局附条件批准先声药业先诺欣(先诺特韦片/利托那韦片组合包装),用于治疗轻中度新型冠状病毒(SARS-CoV-2)感染成人患者。与先诺欣同时获批的,还有上海旺实生物医药科技有限公司申报的1类创新药氢溴酸氘瑞米德韦片(商品名称:民得维),也就是之前上了《新英格兰医学杂志》的VV116。
SARS-CoV-2是一种单正链的RNA病毒,在宿主细胞的帮助下,其遗传物质RNA首先翻译表达出两条多聚蛋白前体,然后多聚蛋白前体在3CL蛋白酶等的作用下发生分子内的切割产生多个非结构蛋白。非结构蛋白参与了病毒亚基因RNA和四个结构蛋白(E蛋白、M蛋白、S蛋白和N蛋白)的产生,进而完成子代病毒的繁衍与释放。由于3CL蛋白酶在病毒的生命周期中起到了至关重要的作用,且人体内没有同源蛋白,故是新冠药物开发的理想靶点。
先诺欣是一款口服小分子抗新冠病毒创新药,其中先诺特韦(SIM0417)针对SARS-CoV-2病毒复制必须的3CL蛋白酶,与低剂量利托那韦联用有助于减缓先诺特韦在体内的代谢或分解,提高抗病毒效果。在临床前动物试验中,先诺欣显示出高效、广谱抗新冠病毒活性,未发现遗传学毒性。此外,先诺欣复方中的利托那韦将由歌礼制药供应(见:《歌礼与先声就“利托那韦片”达成合作协议》)。
2021年11月17日,先声药业与中国科学院上海药物研究所、武汉病毒研究所订立技术转让合同,获得先诺特韦在全球开发、生产及商业化的独家权利。
2022年3月28日,先诺特韦首次获批临床,用于治疗新冠感染,成为首款获批临床的国产3CL蛋白酶抑制剂。5月13日,先诺特韦第2项适应症的临床试验再次获批,用于曾暴露于新冠检测阳性感染者的密接人群的暴露后预防治疗。
8月19日,一项评估先诺欣治疗轻中度COVID-19成年感染者的有效性和安全性的多中心、随机、双盲、安慰剂对照的II/III期临床研究完成首例患者入组,12月16日即完成全部1208例患者入组。
该研究是第一个针对中国人群感染奥密克戎毒株的大样本临床试验,也是国内外第一个达成以“咳嗽、鼻塞流涕、咽痛、发热、头痛、肌肉或全身痛等11个症状持续恢复(至0分)”为主要终点的III期注册临床研究。
目前,全球在研3CL蛋白酶抑制剂共64款,辉瑞Paxlovid、盐野义ensitrelvir和先声药业先诺欣获批上市。从布局3CL蛋白酶的国内药企来看,先声药业是进展最快的一家,歌礼制药、众生睿创和广生堂等公司紧随其后。
国产新冠药研究进展一览:
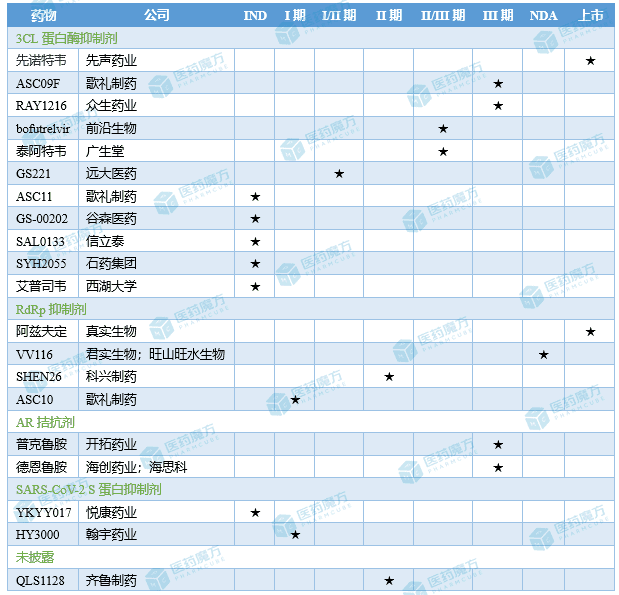
今年1月初,Paxlovid因报价过高在本次医保谈判中流标。祝贺先诺欣、民得维获批上市,也期待今年有更多价格亲民的新冠药物上市,为国人提供对抗新冠的有力武器。
本文来自微信公众号:医药魔方Info(ID:yiyaomofanginfo),作者:不加盐

