本文来自微信公众号:易凯资本(ID:China-eCapital2000),作者:张骁 、卫玲波 、杨冰,编辑:郭邦晖 、吴靖 、高大伟,题图来自:视觉中国
核心观点
1. 2021年以来,国家在医疗服务、药械、医疗保障、上市监管等多个领域均出台了大量新法规和新政策,且对医疗医药行业重点监管领域进行了严格执法。在国家药品带量采购常态化、医保谈判“双通道”、药物研发以临床价值为导向等多项政策驱动和引导下,国内医药企业逐渐向创新驱动型转变。
2. 2021年是中国创新药成果频出的一年,泽璟生物、亚盛医药、康方生物、腾盛博药等多家生物医药企业迎来首款商业化新药。国内获批药物的种类和覆盖的适应症也逐渐多样化,首款中国本土企业自主研发的ADC药物、两款CAR-T细胞疗法药物、首款新冠中和抗体联合疗法相继上市,中国多家Biotech公司也纷纷开始实现规模收入。在接下来的几年中,我们还将见证AI医药行业、细胞疗法、ADC、合成生物学等多种高技术赛道开始大规模实现商业化应用。
3. 无论是A股、港股、美股二级市场,2021年生物医药公司的股市表现都是一波三折,科创板中有近21家生物医药企业的全年股价下跌,美股上市的中概股公司因为监管政策而极具不稳定性,而港股上市的生物医药企业则破发不止。二级市场中生物医药企业估值持续回调,引发了一级市场对生物医药行业的悲观预期,势必会对2022年生物医药行业一级市场融资带来巨大影响。
4. 2022年资本重点关注赛道:基因治疗、核酸药物、细胞疗法、双抗、ADC、上下游原料、合成生物学。
一、2021年发生了哪些重要变化?
1. 国内医药和生物科技市场的利润总额同比增长77.9%
国家统计局2月发布的数据显示,2021年中国医药制造业的营业收入为29288.5亿人民币,同比增长20.1%。与此同时,我国医药制造业2021年的利润增势也非常强劲,2021年医药制造业实现利润总额6271.4亿人民币,同比增长77.9%。根据国家统计局的解读,医药制造业的强劲增长主要是受国内外疫苗需求量较大、企业产销两旺等因素驱动。
值得注意的是,疫苗公司的盈利能力大幅提升。以万泰生物和智飞生物为例,2021年万泰生物实现营收57.50亿人民币,同比增长144.25%,净利润20.16亿人民币,同比增长197.83%,其净利润增长的主要原因是二价宫颈癌疫苗等需求的增长。2021年智飞生物营收306.37亿人民币,同比增长超100%,总利润101.97亿人民币,同比增长208.88%。
2. 本土药企加速国际化布局
2021年,受全球疫情影响,国内医药行业的大额海外并购交易量大幅减少,但是跨境的License-in和License-out交易依然保持极其火热的态势。
2021年,License-in模式下的第一批产品已经进入NDA乃至上市阶段,通过License-in国外临床后期的创新药,在国内开展桥接临床试验或参与国际多中心临床试验,可以大幅度缩短开发周期,加速新药进入中国市场。在中国2021年的NDA产品中,License-in产品有24款,占比达到31%,已成为中国后期新药的重要组成部分。
易凯资本根据公开信息统计,在2021年间,中国药企的License-in交易总数约有130多起。其中,再鼎医药以6起总计价值超16.8亿美元的交易位列榜首。
(1) License-in
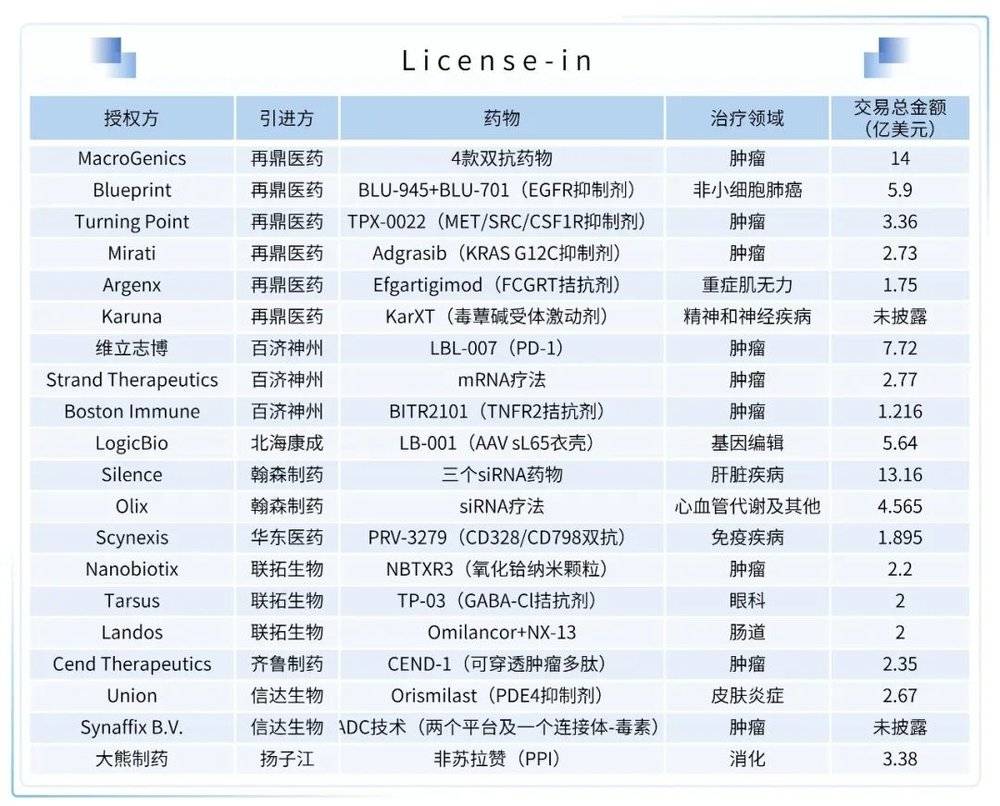
再鼎医药与创新抗体生物制药公司MacroGenics就有四个肿瘤双抗的项目达成合作和许可协议。根据协议,MacroGenics将从再鼎医药获得2500万美元预付款和3000万美元的股权投资。此外,MacroGenics将有资格获得高达14亿美元的潜在开发、注册和商业化里程碑付款。值得注意的是,再鼎医药通过与MacroGenics达成潜在总价值超14亿美元的交易,继续深入其在抗体领域的商业化布局。
翰森制药与Silence Therapeutics签订独家许可合作协议,双方将利用后者的独家mRNAi GOLDTM平台,合作开发针对三个靶点的siRNA。Silence Therapeutics将从翰森制药获得1600万美元的预付款,并在达到额外的开发、监管和商业里程碑后有资格获得高达13亿美元的付款。Silence Therapeutics也将获得翰森制药产品净销售额约10%-15%区间的特许权使用费。
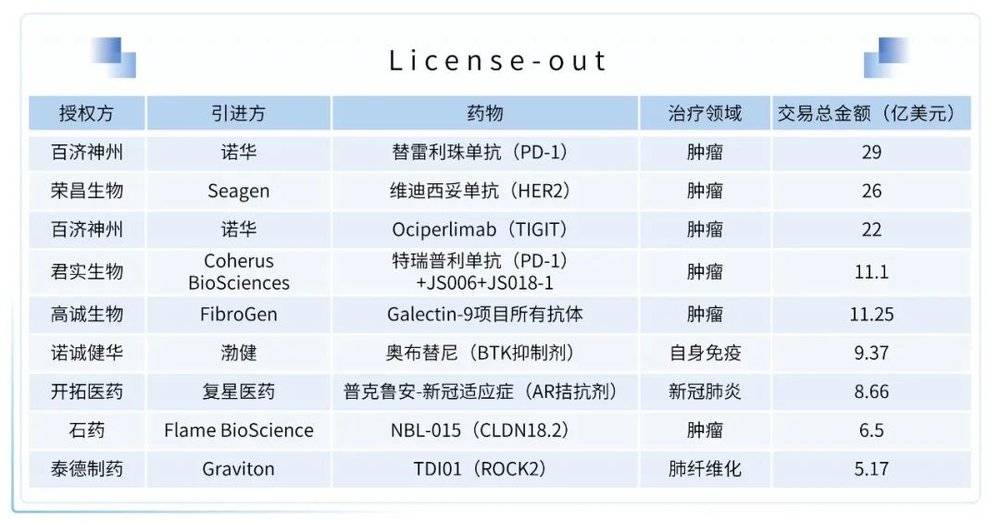
(2)License-out
2021年,国内药企共发生30起License-out交易,交易总金额超133亿美元,涵盖了自身免疫、肿瘤、新冠、肺纤维化等多个疾病领域。其中肿瘤领域占比最大,约为80%。值得注意的交易包括,荣昌生物与Seagen关于维迪西妥单抗达成交易总金额达26亿美元的合作,百济神州以29亿美元的交易总金额将替雷利珠单抗授权给诺华,诺诚健华与渤健就BTK抑制剂奥布替尼达成总交易金额9.38亿美元的许可及合作协议。
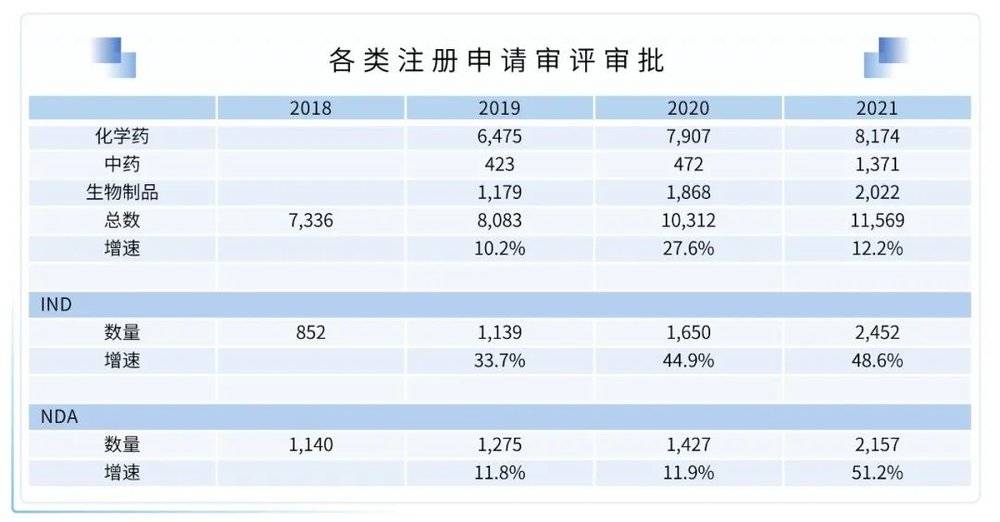
(1)NMPA批准新药数量创下历史新高
2021年,NMPA共批准83款新药。其中国产新药51款,进口新药32款。罗氏和百济神州获批上市的药物最多,均为4款。恒瑞、辉瑞、基石药业、康希诺、武田等五家药企均获批上市3款药物。
罗氏的4款分别为:玛巴洛沙韦,适应症为流感患者;萨特利珠单抗,适应症为AQP4抗体阳性视神经脊髓炎谱系疾病;利司扑兰口服溶液用散,适应症为脊髓性肌萎缩症患者;以及奥妥珠单抗,适应症为滤泡性淋巴瘤。
百济神州的4款分别为:注射用司妥昔单抗,适应症为特发性多中心MCD成人患者(罕见病);达妥昔单抗,适应症为12月龄及以上的高危神经母细胞瘤患者;帕米帕利胶囊,适应症为卵巢癌、输卵管癌或腹膜癌患者;以及卡非佐米,是安进和百济神州合作开发的注射用药,适应症为多发性骨髓瘤。
多家企业迎来企业的首款商业化新药:
艾力斯医药开发的三代EGFR-TKI伏美替尼;
泽璟生物开发的首个国产肝癌一线靶向药多纳非尼;
德琪医药选择性核输出蛋白(SINE)抑制剂塞利尼索;
真实生物开发的首个双靶点抗HIV-1药物阿兹夫定;
盟科药业历经十二年开发的新一代噁唑烷酮类抗菌药康替唑胺;
亚盛医药的三代BCR-ABL TKI奥雷巴替尼;
腾盛博药/清华大学/深圳市第三人民医院联合开发的新冠中和抗体鸡尾酒疗法安巴韦单抗/罗米司韦单抗;
誉衡生物开发的抗PD-1抗体赛帕利单抗;
华昊中天埃博霉素类抗癌药优替德隆等。
值得注意的是,2021年获批药物的种类逐渐多样化。荣昌生物的注射用维迪西妥单抗获批上市,这也是我国首款上市的自主研发ADC药物;复星凯特的阿基仑赛注射液获批上市,这是首个在国内获批的CAR-T疗法。
(2)2021年医保谈判情况总结、带量采购规则和情况总结
2021年的医保谈判中,共有117种药品被纳入谈判范围,最终94种药品(目录外67种,目录内27种)谈判成功,总体成功率80.34%。2021年目录外的67种药品中有66个是近五年内上市的药品,占比高达99%,其中27个创新药实现“当年上市当年入保”。而且本次进入谈判的23个中国重大创新药,22个都被纳入医保目录。
67种目录外药品均通过谈判的方式进入医保目录,平均降价61.71%,药品覆盖艾滋病、丙肝、慢性鼻炎、抗感染、造影剂、麻醉、糖尿病、乙肝、罕见病、肿瘤、高血压、抗焦虑、阿尔茨海默症等多个疾病领域。其中备受关注的产品包括治疗罕见病5qSMA的诺西那生钠注射液、阿尔茨海默症用药甘露特纳胶囊、红斑狼疮国产新药泰它西普注射液、乌司奴单抗注射液、依奇珠单抗注射液等。
本次谈判共有7款罕见病药物成功纳入目录,足以显示药监局对于罕见病领域的重视,其中渤健、武田、辉瑞均有2个药物进入医保,安进1个品种。备受关注的渤健用于治疗5qSMA的诺西那生钠注射液,谈判后价格从原始价格每瓶人民币53680元下降到33000元(原价近人民币70万元/针)。
此外,在肿瘤领域备受关注的PD-1抗体品类中,并无外资药企的PD1抗体进入医保目录,而国产PD-1抗体则大获全胜,目前信达(2个新增,共4个适应症)、君实(2个新增,共3个适应症)、百济神州(3个新增,共5个适应症)、恒瑞(4个适应症)均进入2021年的医保目录中。未来国内PD-1抗体的市场竞争势必会发生一些变化。
6. 前沿技术加速医药行业推陈出新
(1)AI医药行业迎来价值兑现期,各大药企动作频频
近年来,AI技术不断取得突破,深度学习算法的不断突破和算力的大幅提升,让我们愈发感受到AI的震撼力量。以蛋白质结构预测为例,AlphaFold2已经预测出超过35万种蛋白质结构,涵盖了98.5%的人类蛋白质组以及20种生物的蛋白质。
放眼全球,全球TOP20药企均在AI领域有大量布局。诺华、辉瑞、GSK、阿斯利康、赛诺菲、复星医药等大批国内外企业纷纷试水AI研发新药,以加速新药研发的速率、提升研发成功率。包括腾讯、阿里、百度等国内IT巨头近两年也在AI制药领域“动作频频”。
2021年12月7日,罗氏子公司基因泰克宣布与Recursion达成合作,罗氏将通过Recursion的操作系统赋能药物发现,在神经科学的关键领域及肿瘤适应症中更快速地确定新的靶点和先进药物。
Recursion将获得1.5亿美元的预付款,并有资格获得额外基于绩效的研究里程碑付款。若双方启动的近40个项目均成功开发及商业化,Recursion将有可能获得超120亿美元的收益。
2022年1月7日,赛诺菲与Exscientia共同宣布,双方达成合作开发协议,将利用Exscientia端到端的AI驱动平台整合真实患者数据,共同开发15个肿瘤和免疫领域新型小分子创新药物。根据协议,Exscientia将获得1亿美元预付款和总额约52亿美元的潜在研究、转化、临床开发、监管和商业里程碑付款。
2022年1月11日复星医药与英矽智能共同宣布达成合作协议,在全球范围内共同推进多个靶点的AI药物研发。这项战略合作包括针对四个指定靶点的以人工智能驱动的药物研发合作,以及双方对于英矽智能QPCTL项目的共同开发合作。根据协议,英矽智能将获得1300万美元的首付款及里程碑式付款,并分享QPCTL项目的商业化利润。
此外,复星医药将向英矽智能提供股权投资。令人瞩目的是,2月17日,在宣布合作仅仅1个月的时间内,英矽智能就宣布和复星医药战略的合作达到了第一个重要里程碑,复星医药已利用英矽智能自主研发的人工智能平台,提名了靶向QPCTL的临床前候选化合物用于创新的肿瘤免疫治疗。
各大药企积极布局AI医药领域,AI制药行业内各类商业模式“百花齐放”,涵盖软件平台服务、CRO、Biotech等多种模式。这些AI制药企业都在进行不同的尝试以解决当前AI制药行业面临的数据痛点问题以及推进AI制药产品管线向前发展。
但是目前AI制药行业推进较为靠前的大部分产品管线都是由AI制药企业自身在主要推进,药企在AI领域动作略显迟缓。如果未来AI药物管线能在临床阶段取得一定成果,我们可以期待下一波AI药物的浪潮。
7. 不同角色的新玩家聚焦中国创新,重构医药行业
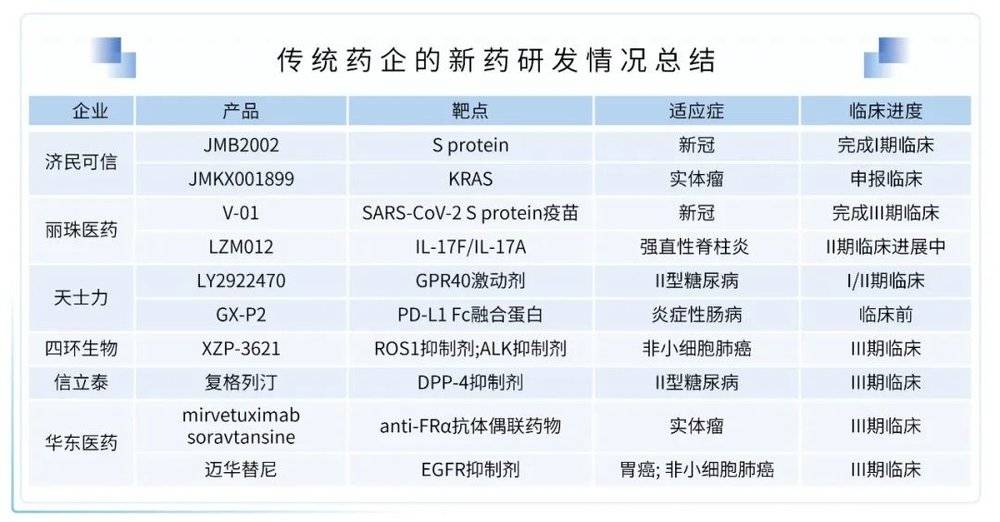
(1)传统药企的新药研发情况总结
随着政策的引导和资本市场的筛选,中国医药行业已经转型成创新驱动型行业。传统药企长期以来一直是医药行业的主力军,目前面临国内集采常态化、创新药优先审评审批、医药研发以临床需求为驱动等多重挑战,逐渐向创新药方向进行转型。
(2)2021年,国内各大药企集体布局一级市场投资领域
恒瑞医药:宣布子公司完成私募基金管理人登记;
泰格医药:出资近100亿元,参与设立泰鲲基金,目前泰格医药投资的生物医药企业已经超过300家;
贝达药业:投资浙江时迈药业,以加速公司在抗体药物领域的布局;
复星医药:增资杏脉科技,助力其研发投入、市场推广及日常运营;联合设立私募股权投资基金,挖掘生物医药和医疗健康领域早期标的;
此外包括科兴、百济神州、信达生物等药企也积极试水一级市场投资领域。
(3)TMT领域玩家深入布局医药领域投资
2021年,一些聚焦于科技领域的公司和基金,如阿里健康、字节跳动、高榕资本、源码资本等机构也纷纷布局医药领域。
据不完全统计,高榕资本2021全年共投资包括艾博生物、因明生物、未知君在内的10余个医药项目,源码资本共投资了微脉、恩和生物、硅基仿生、健海科技、剂泰医药、星药科技、无疆科技、宇道生物等多家医疗公司,字节跳动投资了水木未来、迪赢生物等多个生物医药项目。
8. 生物医药企业上市集体踩下“刹车”
(1)科创板
2021年受政策影响,科创板的创新药板块集体踩了刹车。
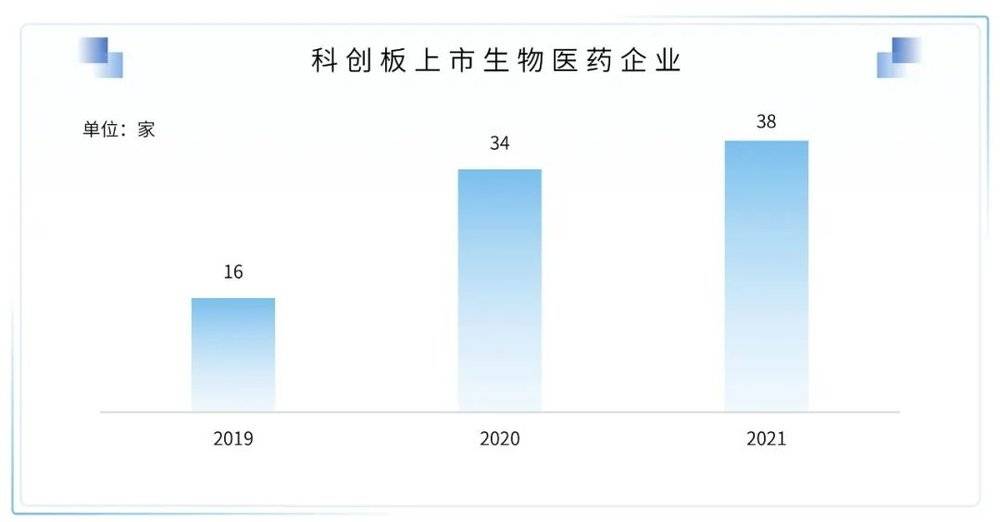
2021年科创板医药企业上市数量创下新高但增速放缓,2019年有16家生物医药企业登陆科创板,2020年有34家,2021年则达到38家。
12月15日,百济神州在科创板挂牌上市,募资金额人民币222亿元,创中国药企IPO募资新纪录。市值已超千亿的百济神州成为首家在纳斯达克、港股、A股同步上市的医药企业。
2021年下半年,5家医药企业包括成大生物、迪哲医药、百济神州、南模生物等均遭遇了首日破发的情况。此外,科创板中有近21家生物医药企业的全年股价下跌,包括前沿生物、微芯生物、奥泰生物、泽璟制药、康希诺、汇宇制药、君实生物、百奥泰、复旦张江、百济神州等,其中圣湘生物跌幅最大,高达48%。而与之相对比的是,对国家医药政策相对免疫的CXO、上游原材料、创新器械等领域仍饱受投资人青睐,走势仍保持强劲。CXO企业阳光诺和、皓元医药、美迪西分别实现涨幅350%、285%、213%;上游原材料纳微科技、键凯科技分别涨幅904%、213%。
(2)港股
无论是创新药企,还是医疗器械企业,今年港股股市表现都是一波三折。
2021年共有34家药企成功赴港上市,其中21家医疗保健设备和服务类企业、13家药品与生物科技类企业,合计募资约722亿港元。其中有20家18A医药公司,募资额超20亿港元的有昭衍新药、凯莱英、和黄医药、康诺亚等15家药企。受益于港交所的18A上市新规,上市公司数量最多的子板块为生物药,其次为化药。其中市值占比最高的子版块为CDMO、生物药和化药。整体看来,CRO/CDMO和医疗服务板块表现较好,而互联网医疗板块和医疗器械版块表现相对较弱。此外,港股的千亿市值公司数量也在快速增长,目前已有超过10家大陆生物医药公司市值在千亿港元以上。
2021年港股上市药企破发不止,在今年34家赴港上市的药企中,有24家均跌破发行价,比例高达70%。2021年港股上市药企近一半企业出现首日破发情况,其中,北海康成-B、先瑞达医疗-B、心玮医疗-B这三家公司当日跌幅均超20%。
(3)纳斯达克
由于中美贸易战和监管风波,2021年于NASDAQ成功上市的公司仅有5家,包括亘喜生物、拓臻生物、天演药业、康乃德生物、大自然药业,上市至今股价跌幅均超过60%。2021年下半年由于日益加剧的中美监管风波,整个美股市场只有一家中国企业成功上市。
二、2021年市场中发生的重要交易
2021年全球生物医药领域的投融资事件共1274项,较2020年有大幅增长,增长约34.1%。2021年全球医药领域投融资金额约3774.3亿人民币,同比增长34.4%。总体而言,自2021年新冠疫情对市场的影响回落后,全球生物医药市场的投融资体量仍然持续走高,证明全球资本市场仍对生物医药领域保持较为乐观的态度和持续关注。
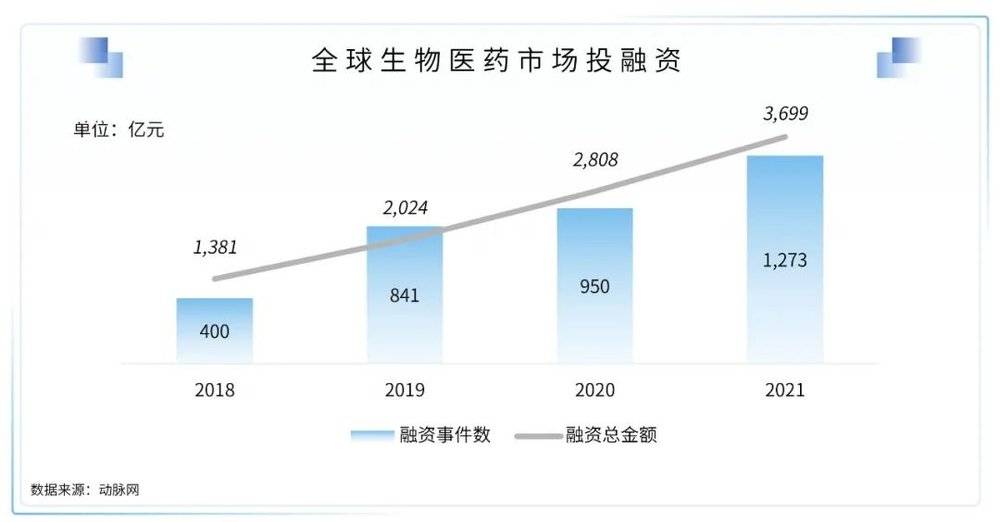
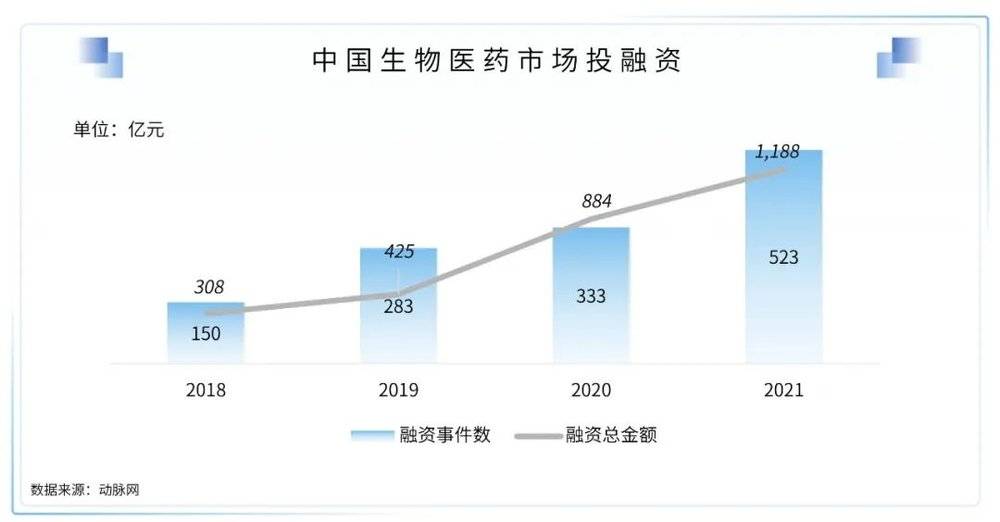
2020年在疫情影响下,国内生物医药领域的融资总金额同比增长107.6%。2021年,国内生物医药领域的投融资数量和总金额依旧保持高速增长,融资事件共523项,同比增长57.1%;融资总金额共计1188.75亿人民币,较2020年增长34.5%。
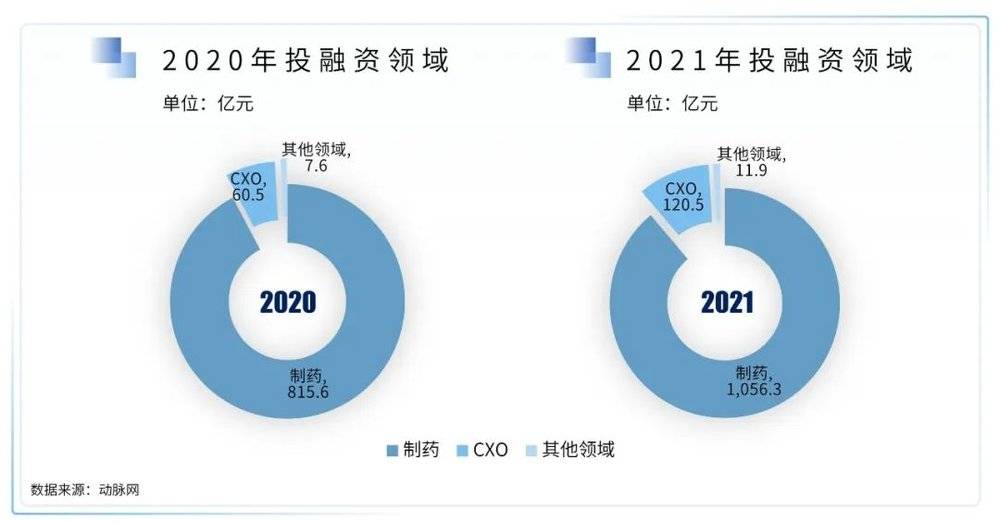
国内生物医药领域的投融资长期以药物领域为核心,而最新的趋势表明,CRO/CDMO的热度在2020年有一定程度的增长,目前CXO领域的投融资总金额占2021年投融资总金额的10%。
2021年,国内生物医药领域一、二级市场均发生了多起大额融资事件,其中,一级市场交易中共有37家企业的单笔融资金额超过了人民币5亿元。
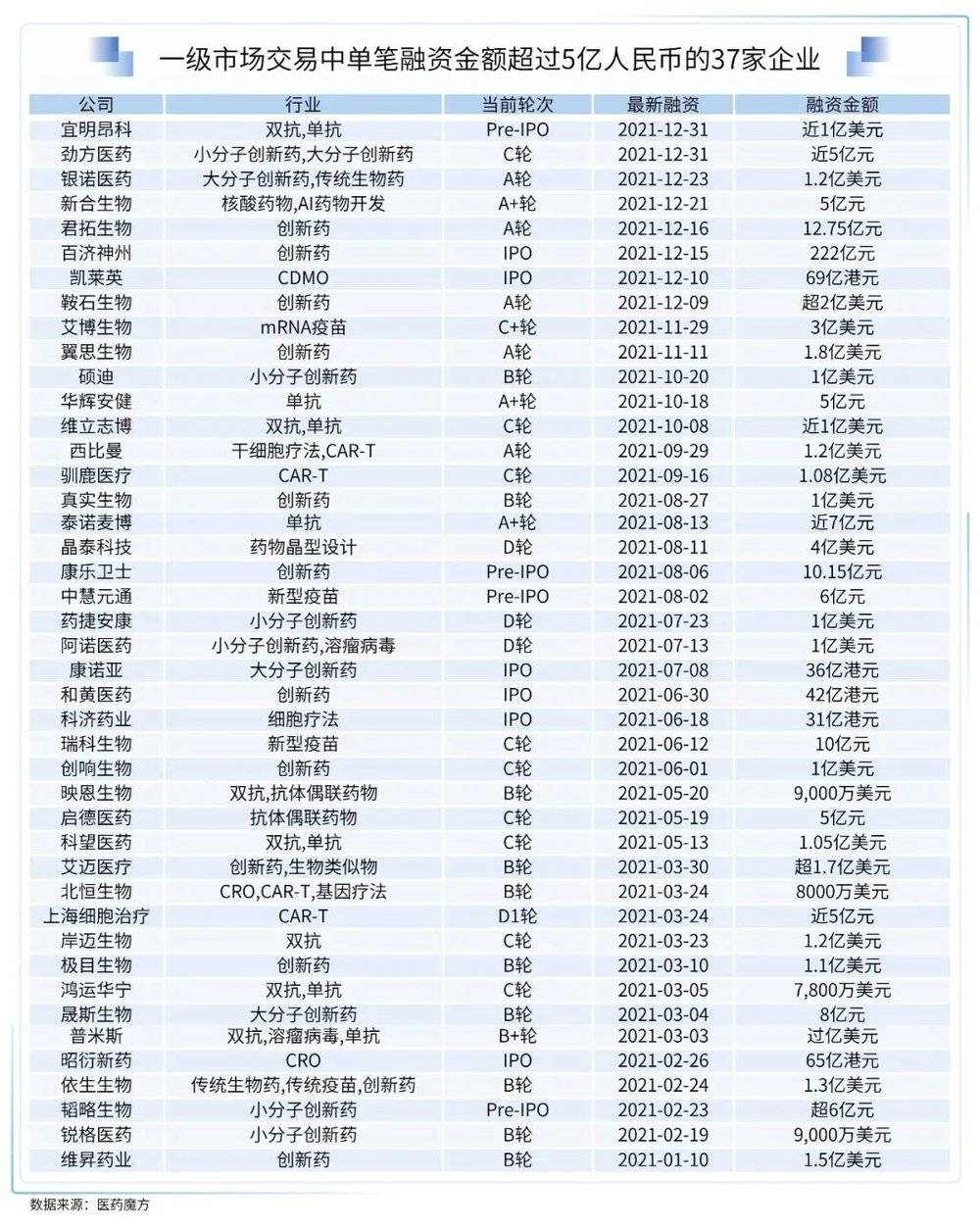
艾博生物
2021年累计完成3轮融资:4月完成人民币6亿元B轮融资,8月完成7.2亿美元C轮融资,11月又完成3亿美元C+轮融资,累计融资超11亿美元,位居全球生物技术融资之首。
晶泰科技
8月份完成D轮融资,融资金额达4亿美元,此次融资距离3亿美元C轮融资还不到1年,1年内超7亿美元的融资额度也刷新了AI医药行业的融资纪录。
三、 2022年最重要的投资主题及市场预判
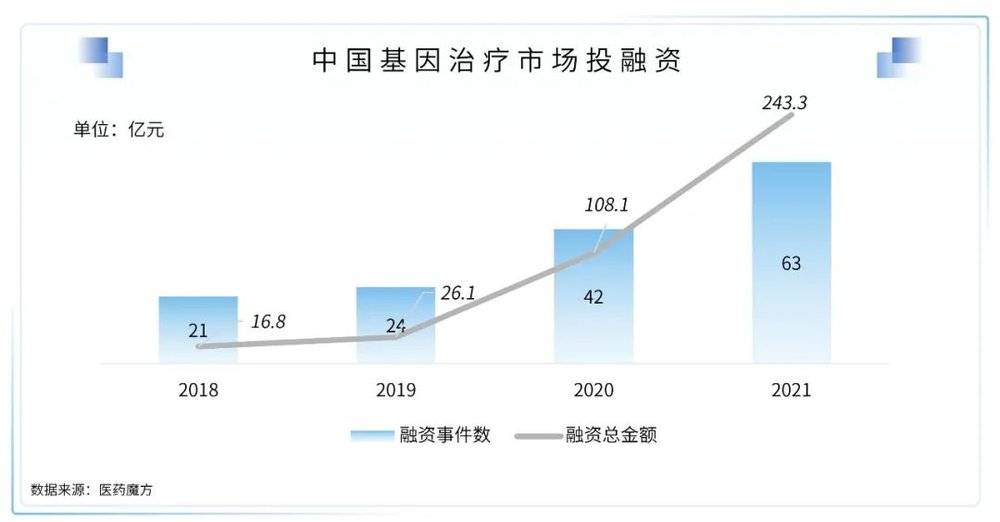
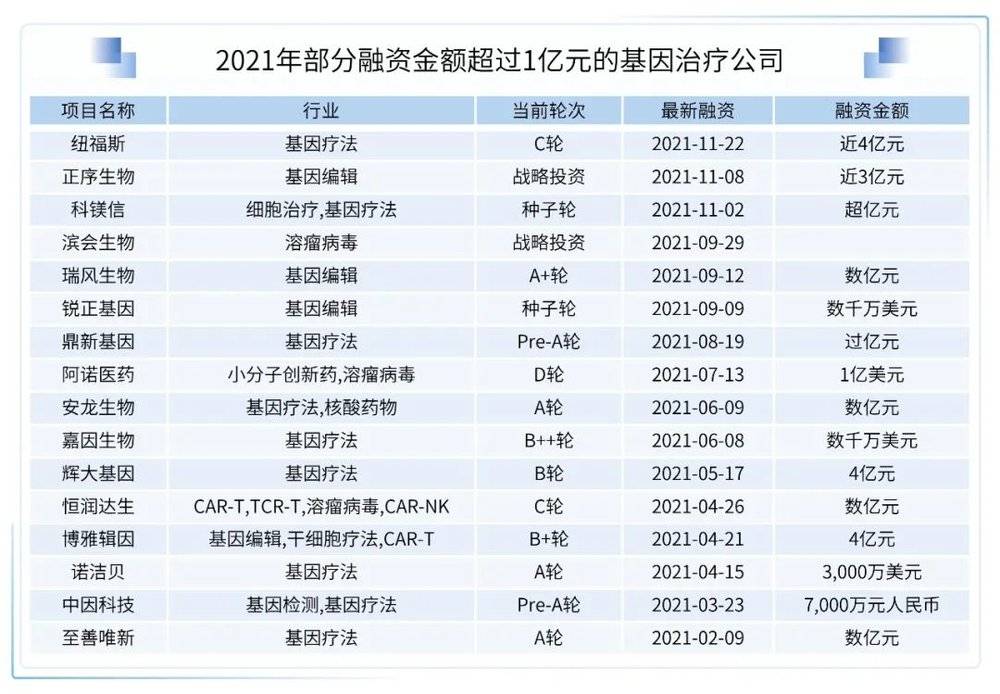
1. 基因治疗从实验室大步走向产业化
基因治疗包含基因疗法、溶瘤病毒、基因编辑等多个领域,随着基因治疗多款产品上市,并在遗传性罕见病领域取得了突破性进展,近两年基因治疗的投资热度有了明显的上升。已上市基因疗法产品的销量逐渐进入增长期,基因疗法Zolgensma的2021年销售收入达到13.51亿美元,同比增长47%,成功迈入“10亿美元俱乐部”,未来还有巨大的增长潜力。
MNCs继续大力布局基因治疗领域:武田与Poseida Therapeutics签订了研究合作和独家许可协议,共同开发非病毒体内基因治疗项目,交易潜在总价值36亿美元。Selecta Biosciences宣布已与武田达成一项战略许可协议,基于Selecta专有的免疫耐受技术平台ImmTOR实现重复给药,为溶酶体贮积症领域的两个适应症开发下一代基因疗法,Selecta有权在合作期间收到一笔未公开的预付款,和高达11.24亿美元的未来额外付款。Selecta也有资格获得未来商业销售的分级特许权使用费。Genevant Sciences与武田宣布达成一项全球合作和许可协议,利用Genevant的专有脂质纳米颗粒(LNP)技术平台,开发新型非病毒载体基因疗法,治疗罕见肝脏疾病,Genevant将有资格获得高达3.03亿美元的前期和潜在里程碑付款,与未来产品销售的特许权使用费。
丹纳赫宣布与生物技术公司Aldevron签订最终协议,以96亿美元现金收购Aldevron,加码基因治疗领域。
诺华宣布与英国眼科基因疗法公司Gyroscope Therapeutics达成协议,收购后者的已发行股份,首付款8亿美元,潜在里程金7亿美元,交易总额15亿美元。
艾伯维于2021年9月以高达17.5亿美元购买AAV项目RGX-314,RGX-314是一种潜在的一次性基因疗法,用于治疗湿性年龄相关性黄斑变性 (wAMD)、糖尿病性视网膜病变 (DR) 和其他慢性视网膜疾病。艾伯维将向REGENXBIO支付 3.7 亿美元的预付款,REGENXBIO有可能获得高达13.8 亿美元的额外开发、监管和商业里程碑。
目前,超过70%的核酸治疗临床试验使用某种形式的病毒载体,包括逆转录病毒、慢病毒、腺病毒和腺相关的病毒。这些载体的早期临床试验发现了一些问题,如免疫学(包括过敏)反应,脱靶效应,以及不加选择地整合到基因组中导致白血病等癌症的发生。对于需要长期表达相关基因治疗蛋白的遗传性酶缺乏症或癌症患者,病毒载体可能具有优势。然而在临床应用中,如果只需要或保证短期基因表达的临床应用,核酸通过非病毒载体进行传递,特别是基于化学的载体,如阳离子脂质、阳离子聚合物,或脂质纳米颗粒,可以提供更有利的风险/效益比。
载体本身的安全性,涵盖免疫原性、细胞毒性等风险层面,这将直接影响给药后的安全性以及后续多次给药的可能性。
载体本身的荷载能力有待提高。AAV是基因治疗的主流载体,但其基因荷载能力<4.5kb,限制了大基因片段的递送。
递送效率尚不理想,这一点在LNP 递送RNA疗法上更为明显。
2. 核酸药物产业空前繁荣,多种核酸平台技术逐渐进入市场
新冠疫情加速了RNA药物的上市,随着递送技术的发展和RNA药物形式的多样化发展,核酸药物已经开启繁荣发展的时代,也被称为继化学药、抗体药后的第三代药物。核酸药物包括mRNA、反义寡核苷酸、环形RNA、非编码RNA、核酶、脱氧核酶、小干扰RNA(siRNA)和微小RNA(miRNA)等多种形式。目前全球已有14款核酸药物获批,2种mRNA疫苗获得FDA的紧急使用授权,此外有众多核酸药物在临床试验中,预计随着核酸药物技术的不断改进和对遗传调控的深入理解,未来核酸药物会有更加长足的发展,并在传染病以外的疾病领域也会有所突破。2021年,国内资本市场也继续深化对核酸药物的布局,投融资事件有了大幅的增长。
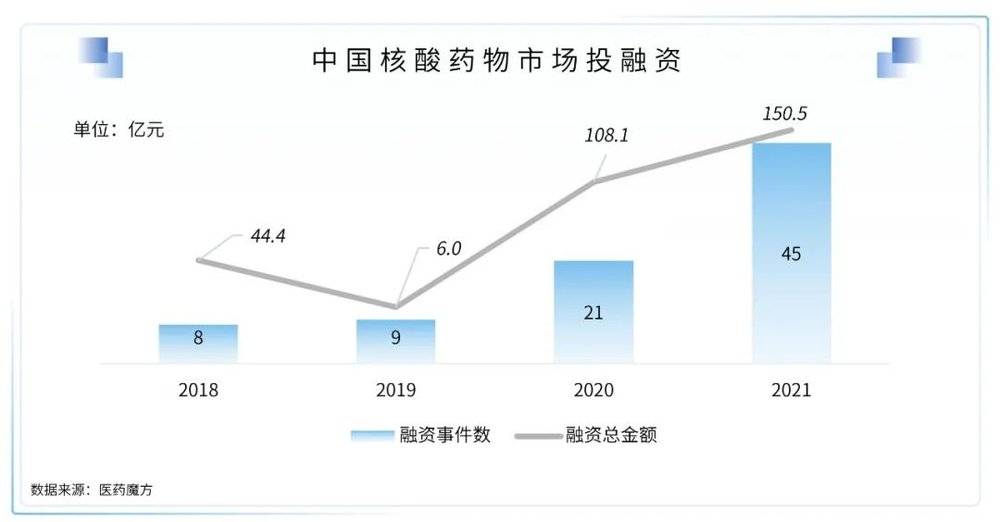
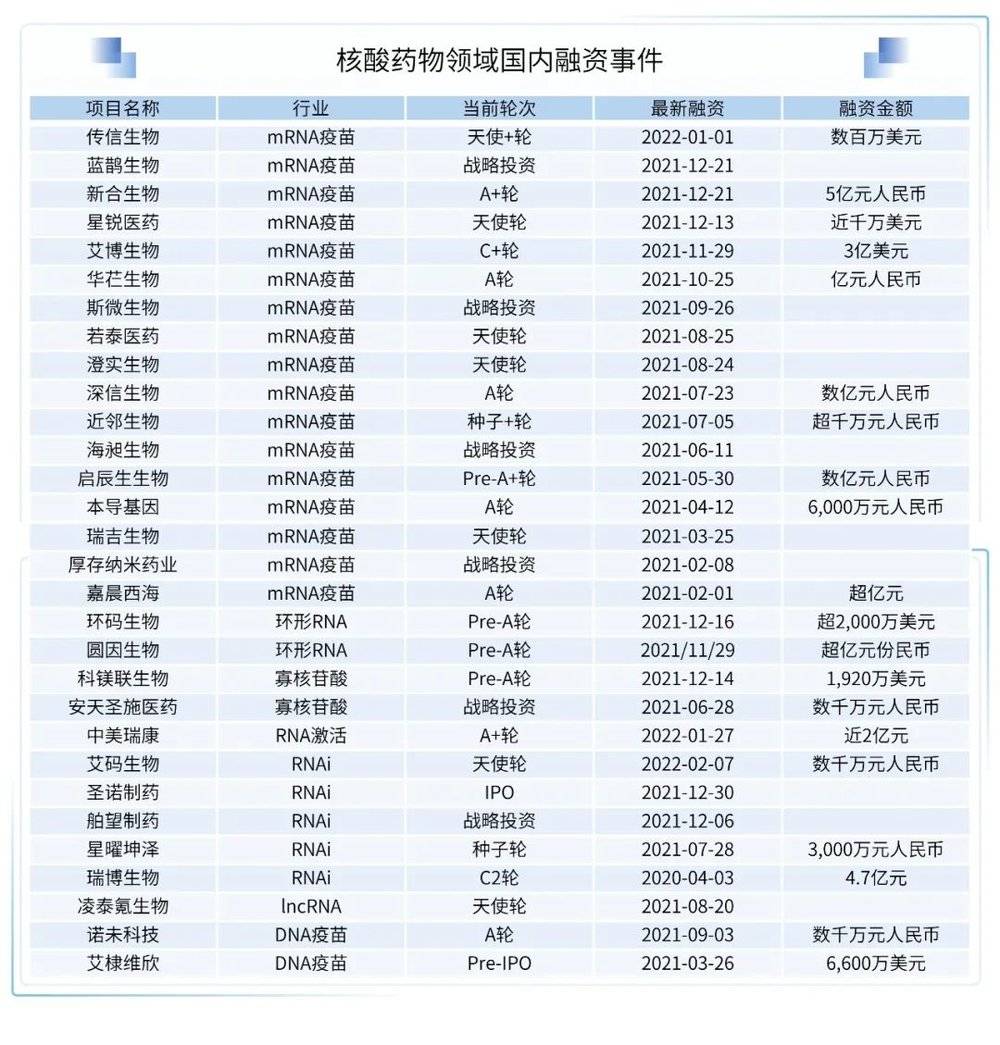
(1)RNA干扰
目前全球已获批上市的RNAi药物有4款,主要专注于遗传性罕见病领域。分别是治疗遗传性转甲状腺素蛋白淀粉样变性多发性神经病的ONPATTRO(Patisiran)、治疗急性肝卟啉症的GIVLAARI(Givosiran)、治疗原发性高草酸尿症的OXLUMO(lumasiran)、治疗低密度脂蛋白胆固醇的Leqvio(Inclisiran)。随着多款RNAi药物获批上市,以及RNAi递送系统技术的突破,国际领先的制药公司对RNAi疗法的累计投资由2017年85亿美元增至2020年的350亿美元,三年增加300%,RNAi疗法越来越受重视。
肿瘤学的RNAi疗法虽处于早期阶段,但是未来随着首个RNAi肿瘤药物的获批上市,癌症治疗必会开启新的篇章。圣诺医药是首家在肿瘤学RNAi治疗领域取得积极IIa期临床结果的公司,研发管线专注于肿瘤与纤维化适应症领域。领先产品STP705由两种靶向TGF-β1及COX-2 mRNA的siRNA核苷酸组成,已经获得FDA的孤儿药认证,并开展了国际多中心II期临床试验。2021年12月30日圣诺医药登陆港交所,也成为了国内RNAi领域的第一家上市公司,上市首日收涨逾18%。
此外,同样专注于小核酸药物的国内药企还有瑞博生物,研发管线包括多款小核酸药物,适应症涵盖糖尿病、肿瘤、眼科、心血管疾病等。2021年瑞博生物主动终止了在科创板的上市申请。
(2)RNA激活
RNA激活与RNA干扰相对,是利用小的RNA片段来靶向和上调内源基因的转录,从而恢复蛋白质天然功能的一类疗法。2021年,由RNA激活领域的开创者李龙承博士创办的中美瑞康完成了人民币1.1亿元的A轮融资(2022年1月27日,中美瑞康宣布完成近人民币2亿元的A+轮融资)。
(3)环状RNA
环状RNA(circRNA)是2021年RNA疗法领域冉冉升起的新星,环状 RNA是一种广泛存在于真核生物中的共价封闭生物大分子,具有组织特异性和细胞特异性的表达模式,其生成受到了各种顺式作用元件与反式作用因子的调控。circRNA 含量丰富,它们通过作为 microRNA 调节蛋白质翻译或通过自身翻译来行使重要的生物学功能。在RNA治疗中,相比于线性RNA,circRNA 具有更强的稳定性,其独特的结构可以抵御核酸外切酶的降解,并在通过纳米脂质颗粒包装进入人体时具有更高的热稳定性,同时也发展了高效成熟的体内体外快速合成技术。因此,circRNA 具有极强的药物开发潜能,它可以作为疫苗稳定持续地表达抗原,也可以作为药物表达治疗性蛋白。
2021年,Flagship Pioneering等顶尖机构的深度参与也为环状RNA增加了曝光度。国外由Flagship孵化的Laronde在2021年共获得了4.9亿美元的融资,将环状RNA疗法引入了更多人的视野。2021年2月,Orna Therapeutics完成了8000万美元的A轮融资。
而在国内,2021年有两家环状RNA疗法公司宣布完成了融资,分别为圆因生物和环码生物。
圆因生物是由北京大学魏文胜教授于2021年4月创办的环状RNA公司,专注于环状RNA疫苗和新型疗法开发,2021年11 月 29 日,圆因生物宣布了完成超亿元 Pre-A 轮融资。2021年3月,魏文胜教授团队在预印本平台bioRxiv 上发表题为:Circular RNA Vaccines against SARS-CoV-2 and Emerging Variants的研究论文。该研究报告了一种编码新冠病毒刺突蛋白三聚体受体结合域(RBD)的环状RNA疫苗,circRNA-RBD疫苗可以通过体外转录快速生成,且不需要核苷酸修饰,具有高度稳定性。研究团队通过LNP封装的circRNA-RBD疫苗成功诱导了强有力的持续中和抗体,且该疫苗具有很强的热稳定性,室温下储存2周时间,依然不影响表达。更重要的是,研究团队利用编码RBD变体(K417N-E484K-501Y)的环状RNA疫苗成功在小鼠体内诱导产生有效中和Beta变异株的抗体,表明环状RNA疫苗在抗击新冠变种病毒上具有十分良好的应用前景。这也是全球范围内第一次有关于环状RNA新冠疫苗的报道。
(4)其他新兴RNA疗法
除了环状RNA疗法,2021年RNA疗法领域还有多种其他新技术涌现,比如:
tRNA疗法
tRNA作为新兴技术,未来很有潜力在无义突变介导的遗传病领域取得进展,tRNA疗法通过借助抑制性tRNA可以使得体内的截断蛋白质转变为全长蛋白质。2021年,多家tRNA疗法公司涌现,并在早期即获得了大额融资。2021年7月,Shape Therapeutics 完成B轮融资1.12亿美元,其核心技术之一为RNAskip,主要是反密码子工程性的抑制性转运RNA(anticodon-engineered suppressor tRNAs ,ACE-tRNAs);ReCode Therapeutics B轮融资8000万美元;由Flagship Pioneering推出的Alltrna,种子轮即融资5000万美元。
自扩增/自复制RNA疗法
Ziphius Vaccines A轮融资2930万欧元,Replicate A轮融资4000万美元,国内拥有自复制RNA技术的嘉晨西海A轮融资超人民币亿元。
调节性RNA疗法
CAMP4 Therapeutics融资4500万美元。
非编码RNA疗法
Cardior Pharmaceuticals B轮融资7600万美元。
未来随着越来越多种类型的核酸药物涌现出来,相信核酸药物会得到持续的关注,并在临床上取得长足进展。
3. 细胞疗法百花齐放
2021年两款细胞疗法重磅产品在国内上市,分别为复星凯特的靶向CD19的CAR-T细胞治疗疗法Yescarta(又称阿基仑赛注射液,商品名:奕凯达)、药明巨诺的靶向CD19的CAR-T产品瑞基奥仑赛注射液(relma-cel,商品名:倍诺达),也被认为是开启了国内细胞疗法的元年。但是与全球获批的32款细胞疗法产品相比,国内的细胞疗法依然有非常大的空间。此外,目前的细胞疗法仍有需要克服的多重挑战,包括高达百万的售价、制备周期、潜在的细胞因子风暴副作用和神经毒性等问题。而不断涌现的CAR-NK、通用型细胞疗法、肝细胞疗法等新技术势必为细胞疗法带来新一代的解决方案。
(1)CAR-NK具有极大的临床潜力
近年来,作为一种独特的天然免疫中的抗肿瘤、抗感染效应细胞,NK细胞作为免疫治疗的有力工具进入了人们的视线。CAR-NK是通过基因工程手段修饰使其表达CAR,将识别靶细胞表面抗原的抗体(或受体)与激活NK细胞所需要的信号分子链接,增强NK细胞对靶细胞的特异性杀伤。相较于CAR-T等细胞疗法,CAR-NK具有多重优势,首先是具有更广泛的肿瘤杀伤途径,如执行细胞脱粒、激活凋亡途径和介导抗体依赖性细胞毒性作用(ADCC);其次是CAR-NK不分泌IL-1、IL-6等炎症型细胞因子,不会诱发细胞因子风暴效应;此外,CAR-NK对实体瘤治疗具有明显优势,目前对于CAR-NK的研究也主要聚焦在实体瘤领域。但是目前CAR-NK仍有存活时间短、杀伤效果不足等多重问题,此外CAR-NK领域内的临床试验大多聚集在临床I/II期,需要更多的临床疗效结果来验证CAR-NK的有效性。
(2)多家药企积极开发CAR-NK疗法
2021年1月28日,Artiva Biotherapeutics宣布与默沙东签订全球独家合作和许可协议,利用其现货型同种异体NK细胞制造平台及专有的CAR-NK技术,开发针对实体瘤相关抗原的新型CAR-NK细胞疗法。根据协议条款,合作最初包括两个CAR-NK项目,第三个项目待选。Artiva将获得前两个项目的3000万美元预付款,如果默沙东行使第三个项目的选择权,Artiva还将获得1500万美元的额外付款。Artiva也有资格获得每个项目高达6.12亿美元的开发和商业里程碑付款。
2021年6月17日,吉利德科学子公司Kite与Shoreline宣布了一项战略合作,为一系列血液系统恶性肿瘤开发新的同种异体候选产品。合作将首先集中在CAR-NK靶点上,根据协议条款,Shoreline将获得预付款,并有资格获得总额超过23亿美元的额外付款,以及基于实现某些开发和商业里程碑的特许权使用费。
2021年6月9日,百济神州宣布与Shoreline达成合作协议,利用Shoreline的iPSC-NK细胞技术和百济神州针对不同恶性肿瘤的研究和临床开发能力,开发并商业化一系列基于NK的细胞疗法。根据协议条款,Shoreline将从百济神州获得4500万美元的预付现金,并有资格根据某些开发、监管和商业里程碑的成就获得额外的研发资金、里程碑付款和特许权使用费。
2022年1月,Century与百时美施贵宝(BMS)达成一项总额超30亿美元的研究合作和许可协议,以联合开发和商业化iPSC衍生的同种异体细胞疗法,计划用于治疗血液系统恶性肿瘤和实体瘤。
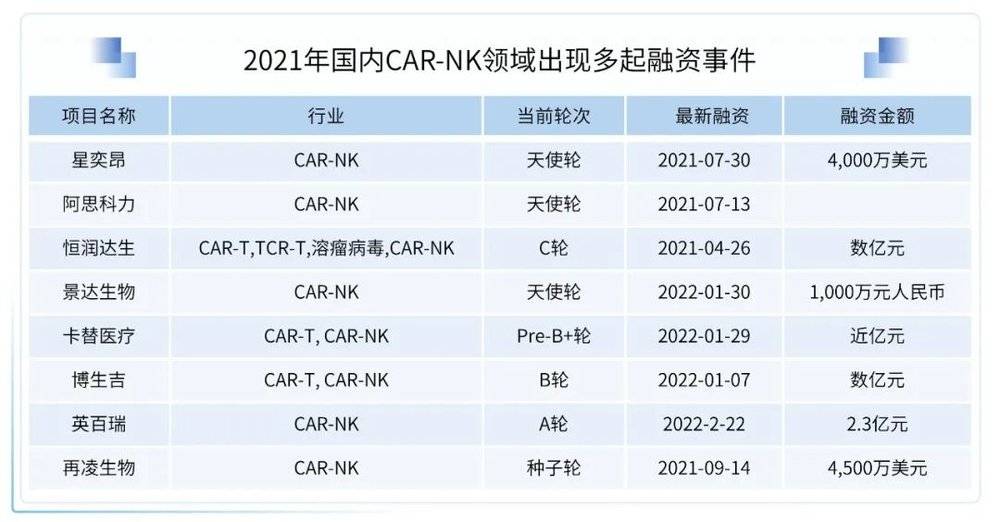
(3)2021年国内CAR-NK领域出现多起融资事件
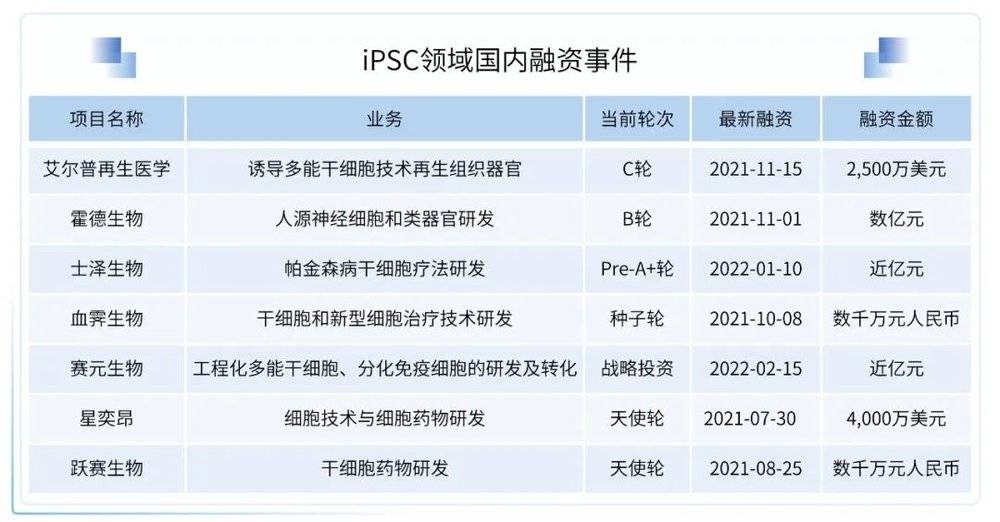
iPSC研发加速,临床应用价值亟待验证
以iPSC为核心的再生医学具有极大的应用价值和发展潜力。2021年,全球范围内对iPSC研究的关注加速;iPSC在心脏疾病、神经性疾病、眼科疾病、肿瘤领域、代谢疾病等多个领域的应用广受看好,尤其是工程化iPSC来源的免疫细胞疗法正在成为肿瘤治疗热潮。使用iPSCs体外进行的细胞疗法具有细胞容易制备、可微创获取大量细胞、规避伦理风险等优点,目前已经有大量探索iPSCs在神经系统疾病、视黄斑病变、心力衰竭、肿瘤免疫疗法(iNK-CAR、iT-CAR等)等方面应用前景的研究。
2021年,iPSC领域备受关注:
1月,中国国家药品监督管理局药品审评中心受理呈诺医学德针对大动脉粥样硬化型急性缺血性脑卒中的iPSC来源细胞药物产品ALF201,即通过诱导多能干细胞(iPSC)定向诱导分化得到的异体内皮祖细胞(Endothelial Progenitor Cells,EPCs)注射液的临床试验申请。ALF201是中国首个即将进入临床的iPSC技术衍生的功能细胞药物产品。
3月,由中盛溯源牵头起草的中国细胞生物学会《人诱导多能干细胞》团体标准在京发布,并于4月9日开始实施。这是我国首个人iPSC的产品标准,为人iPSC的生产和质量控制明确了最低要求,填补了国内空白。
6月,诺和诺德与Heartseed合作授权开发关于心血管疾病的iPSC细胞疗法,最高5.98亿美元的付款,包括5500万美元的预付款和里程碑付款;Shoreline Biosciences和百济神州宣布达成全球独家战略合作,未来将结合Shoreline Biosciences的iPSC NK细胞技术与百济神州的临床前研发和临床开发能力,开发并商业化一系列基于NK细胞疗法的产品组合,用于治疗各类恶性肿瘤;吉利德公司与Shoreline Biosciences宣布建立战略合作伙伴关系,Shoreline Biosciences将收到一笔预付款,并将有资格获得总额超23亿美元的开发、商业化里程碑付款和特许权使用费用。
8月,加科思药业与美国生物科技公司Hebecell达成战略合作,加科思将与Hebecell在全球共同开发新一代iPSC-NK细胞疗法。Hebecell建立了一个高效、稳定、可再生的3D-iPSC生产平台,支持大规模生产用于肿瘤及其他疗法的iPSC-NK细胞。
11月,Fate在ASH上公布了FT516和FT596产品的临床I期数据,进一步验证了管线的安全性、有效性,并且初步展示了FT516和FT596疗效的持久性。
12月,艾尔普再生医学自主研发的人iPSC来源心肌细胞注射液(受理号:CXSL2101489)获得药品审评中心的受理。
目前在全球范围内,iPSC领域尚无细胞疗法上市,均处于临床阶段或临床前发现阶段,未来还有巨大的发展空间。尤其是iPSC分化细胞在神经疾病、眼科疾病、心脏疾病进行细胞替代治疗的实际临床效果其实尚未得到完全验证,预期iPSC可能会在肿瘤细胞治疗领域有较快的进展和突破,随之而来对于iPSC在其他疾病领域的应用价值也会逐步得到验证。而iPSC领域在国内正处于起步阶段,未来预计iPSC和肿瘤细胞治疗领域会受到持续关注。
通用细胞疗法
传统细胞疗法产品需要面临价格昂贵、制备周期长等多重挑战,使用通用或同种异体供体“现货型”CAR-T细胞,允许通过一次制造运行来治疗多个患者,细胞来源于供体或iPSC,可以有效地降低成本。此外,使用通用型细胞疗法产品可以达到立即输注,患者不需要等待白细胞分离、CAR表达、QC/QA等流程,大幅度减少患者等待时间。
近年来,基因编辑技术的快速发展使得对细胞进行各种遗传修饰成为可能,也为新一代细胞疗法的研究开发提供了有利工具。例如常见的通过基因编辑技术(CRISPR/Cas9、TALEN、ZNF等)敲除异体来源CAR-T细胞上的TCR与HLA I以解决潜在的GVHD和HVGR问题。
2021年12月29日,北恒生物自主研发的CTA101 UCAR-T(通用型CAR-T)细胞注射液产品新药临床试验申请获受理,该产品是药审中心受理的首项“现货型”异体来源的CAR-T产品,具有重要意义。CTA101细胞注射液是北恒生物自主研发的国内首个基于CRISPR基因编辑技术的免疫细胞治疗产品,是国内第一个 UCAR-T创新药,属治疗用生物制品1类新药,主要针对CD19和/或CD22阳性成人复发/难治急性淋巴白血病。
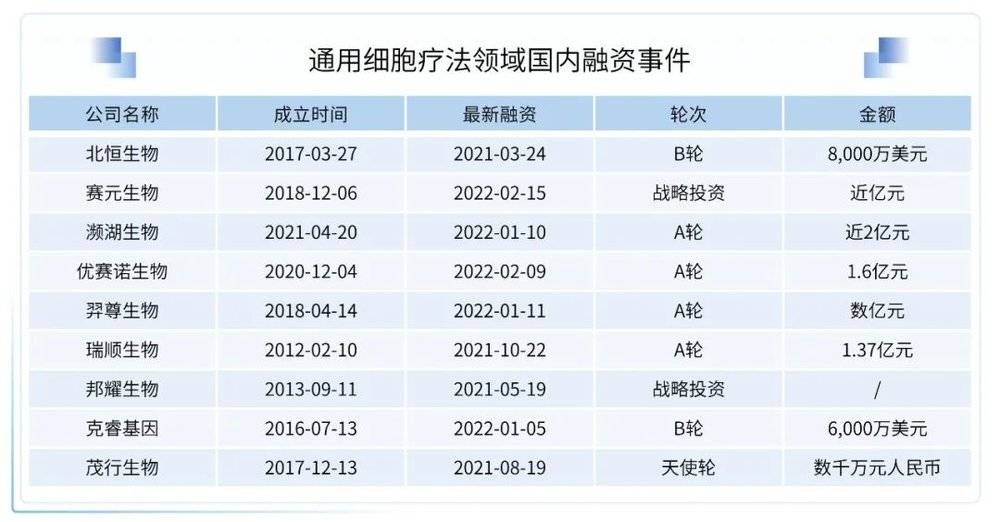
UCAR-T细胞应用于细胞治疗还存在许多亟待解决的问题,这些问题主要来自基因编辑技术及CAR-T技术两方面。其中基因编辑技术本身的安全性问题是限制其用于临床治疗的最重要原因,需要在未来的研究中,不断提高基因编辑技术的精确度,降低其脱靶效应。未来拥有核心基因编辑技术的企业可以更好地开发通用型细胞疗法。
四、2022年投资热点预测
1. 双抗时代已来,2022可能是国内双抗元年
2009年全球首款双抗药物Removab获批上市,历经十余年发展,放眼全球至今仅有5款药物上市,充分证明了研发门槛之高。鉴于双抗技术的不断进步,2021年双抗药物似乎迎来久违的春天,成为了又一大热门风口。
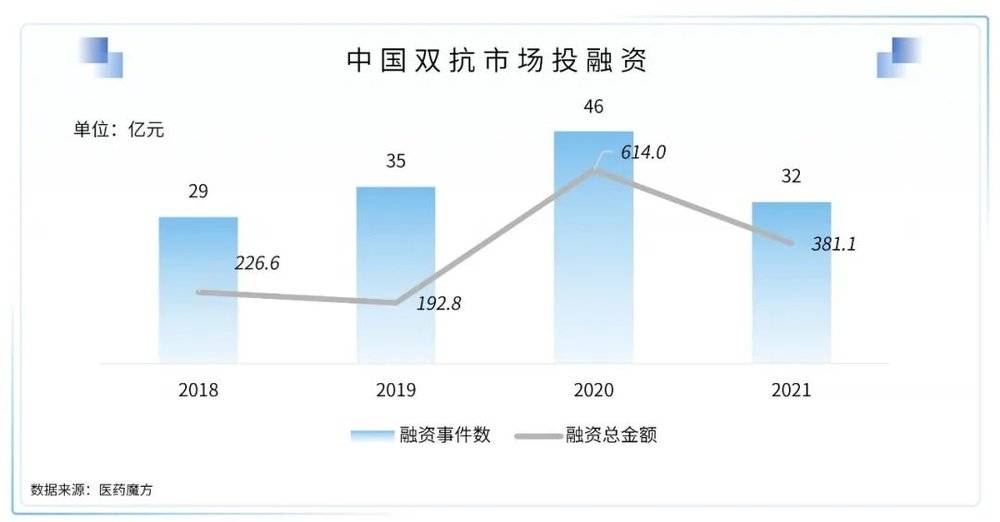
2021年至今迎来了第四款药物——强生的EGFR/C-MET双抗Rybrevant和第五款药物——基因泰克德的VEGF/Ang2双抗Faricimab。Rybrevant是一种全人EGFR-间质表皮转化因子(MET)双特异性抗体,5月被FDA批准用于治疗在接受含铂化疗失败后病情进展、EGFR基因外显子20插入突变阳性的转移性非小细胞肺癌成人患者。Faricimab为VEGF/Ang2双抗,用于治疗湿性年龄相关性黄斑变性(AMD)和糖尿病性黄斑水肿(DME),也是罗氏上市的第二款双抗药物。此外,今年还有多款双抗提交上市申请,也有多款药物取得积极的临床结果,充分证明了双抗药物的临床优势。
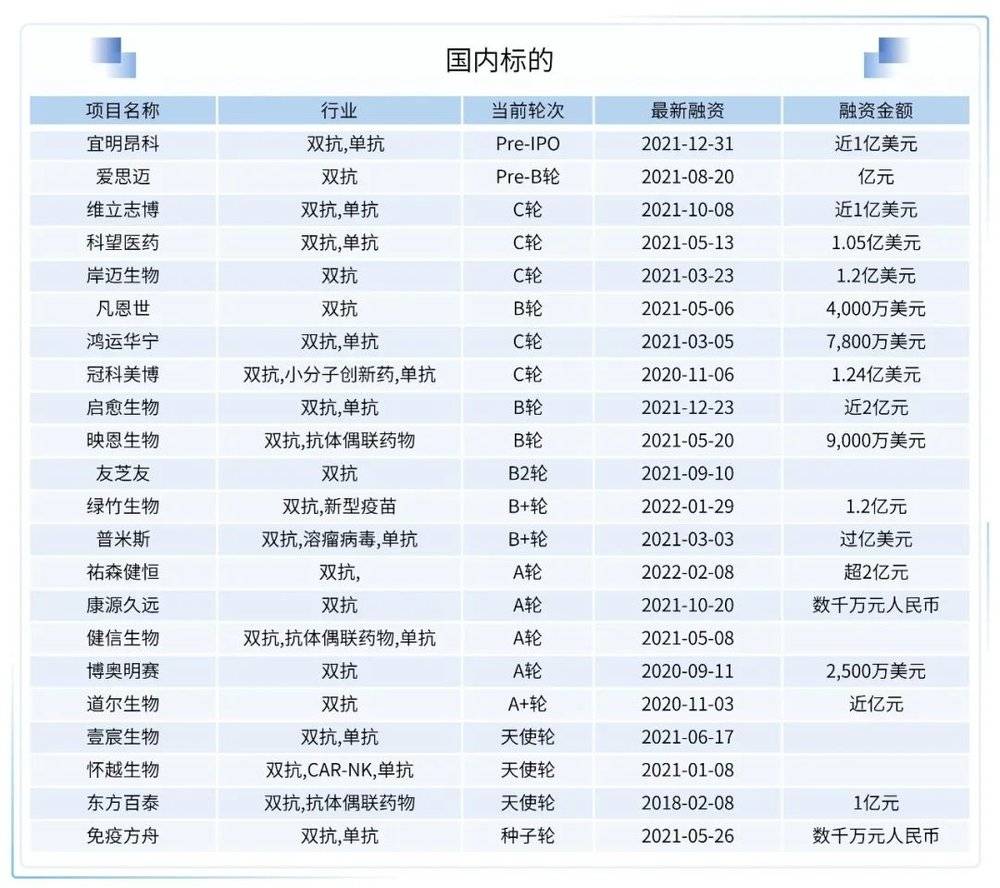
国内信达生物、荣昌生物等多家药企也加入了双抗领域的研发竞争大军,逐渐加深其双抗管线的布局,国内也有多款双抗药物值得关注。
康宁杰瑞的KN046
KN046是一款PD-L1/CTLA-4靶向双特异性抗体,其创新设计包括:采用机制不同的CTLA-4与PD-L1单域抗体融合组成;可靶向富集于PD-L1高表达的肿瘤微环境及清除抑制肿瘤免疫的调节性T细胞(Treg)。
已公布的KN046联合白蛋白结合型紫杉醇治疗转移性三阴性乳腺癌(mTNBC)患者的1b/2期期临床研究结果显示:KN046与白蛋白结合型紫杉醇联合用药具有良好的耐受性和疗效,尤其是在PD-L1阳性mTNBC患者中,在无进展生存期(PFS)和总生存期(OS)方面显示出潜在的具有临床意义的获益。
百济神州的HER2双抗
百济神州引进的HER2双特异性抗体注射用ZW25拟纳入突破性治疗品种,拟定适应症为:单药治疗既往接受系统化疗失败的HER2阳性的局部晚期不可切除或转移性胆道癌(BTC)。公开资料显示,ZW25是百济神州以超4亿美元从Zymeworks引进的两款HER2靶向疗法之一,目前已在中国进入3期临床研究阶段。
在双抗接连取得研发突破,且形成了全球超550个项目同步在研的竞争浪潮的同时,三抗、多抗的研发序幕也已拉开。据医药魔方NextPharma数据库显示,目前全球有近50款三抗及多抗候选分子在研,其中三成以上的项目已处于临床开发阶段。
2021国内外药企深入布局双抗行业
1月,礼来旗下Loxo Oncology与Merus N.V.签署一项研究合作和独家许可协议,将利用Merus专有的Biclonics®平台以及Loxo Oncology科学合理药物设计专业知识,研究和开发多达3种CD3结合T细胞重定向双特异性抗体疗法。
2月,华东医药全资子公司杭州中美华东制药有限公司与Provention Bio签署战略合作协议,引进双特异性抗体PRV-3279用于治疗系统性红斑狼疮以及预防或降低基因治疗的免疫原性这两项适应症在大中华区的独家临床开发及商业化权益。PRV-3279是一种针对B细胞表面蛋白CD32B和CD79B的人源化双抗。
4月,吉凯基因与天境生物达成全球合作,基于吉凯基因开发的单克隆抗体和天境生物选择的抗体,开发多种双特异性抗体(BsAb)并进行商业化推广。
5月,BMS和Agenus签署15.6亿美元的许可协议,引入后者双特异性抗体项目AGEN1777。AGEN1777靶向TIGIT以及另一个未公开的靶点。
6月,MacroGenics与再鼎医药达成一项独家合作和许可协议,再鼎医药将预付5500万美元(2500万美元现金和3000万美元股本)获得MacroGenics四种双特异性抗体的亚洲和全球权益。
8月,康宁杰瑞与石药集团全资附属公司津曼特生物就康宁杰瑞自主研发的抗HER2双特异性抗体KN026签订了在中国内地的开发及商业化授权协议,总交易金额为人民币10亿元,以及两位数的分层销售提成。
10月,强生旗下的杨森制药与F-star Therapeutics达成一项许可和合作协议。F-star授予杨森一项全球范围内的独家许可,利用F-star专有的天然抗体Fc区替换(Fcab)和四价双特异性抗体(mAb2)平台,研究、开发和商业化多达5种针对杨森选定治疗靶点的新型双特异性抗体。
10月,Xencor与强生旗下的杨森制药达成一项全球独家合作和许可协议,以开发和商业化CD20 X CD3双特异性抗体plamotamab,和一款通过与CD28共刺激受体结合,有条件激活T细胞的新型双特异性抗体。
未来双抗药物很有希望引领癌症治疗的突破,双抗药物的暴露时间在体内大大延长,使免疫细胞和靶细胞之间持久相互作用,也能有效地对这两个重要信号进行双重调节。此外,双抗在新冠领域的应用也非常值得期待。2021年9月发表于Nature的研究结果显示针对SARS-CoV-2的人类多克隆抗体可以对不同SARS-CoV-2变种持续有效,因此新冠多抗药物有潜力对未来的新冠病毒大流行起到保护作用。
2. 上下游原料
生物医药领域的工业化生产阶段分为上游生产阶段和下游生产阶段。上游生产阶段主要是指细胞培养,下游生产阶段主要是纯化、灌装。涉及试剂原料、耗材(细胞培养基、色谱填料/层析介质、过滤产品),生产仪器设备(生物反应器、后包装设备)等。
目前细胞培养基是生物药生产的最关键原材料之一,培养基属于相对比较核心的技术,并且成本相对较高,基于国产培养基的价格优势,未来国内的培养基应该可以实现国产化。色谱填料/层析介质/层析柱等药物分离纯化过程直接关系到药品质量,技术难度较大,往往是生产环节的主要瓶颈和成本所在。在单克隆抗体生产中,下游分离纯化环节成本即占据整个生产成本的65%以上,过滤产品(滤膜/滤芯/膜包)是常见的分离纯化方法,试剂原料包括抗原、抗体、酶等,尤其在酶细胞裂解、去除杂质等工艺上发挥重要作用,包括mRNA加帽和线性化的技术都是由酶来完成的。生物反应器分为不锈钢和一次性两种,2021年国内一次性生物反应器总计有人民币40亿元,基本上每年增速在20%~30%。
2021年6月23日,国内纯化填料的龙头企业纳微科技在科创板上市,目前市值超人民币300亿元。
随着我国生物医药市场的迅速发展,CDMO加快关键设备和耗材的国产化是必然趋势,未来生物医药的上下游原料领域势必会继续增长。
3. 抗体偶联药物进入了黄金时代
ADC由抗体、Linker和细胞毒性分子三者组成,兼具特异性抗体的靶向能力、高选择性、稳定性与负载药物的高效抗癌潜力,具有极高的杀伤能力。2009年Mylotarg(gemtuzumab ozogamicin)是FDA批准的第一个ADC药物。经过十余年发展,目前全球范围内共有14款ADC药物上市,而国内共有4款药物上市。
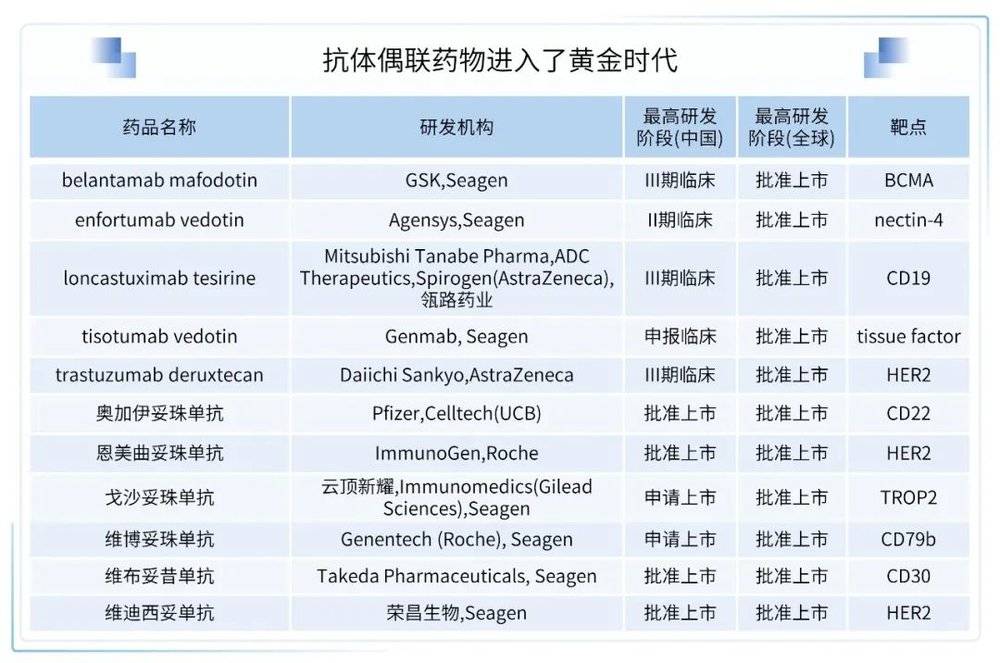
目前,国内已经批准4款ADCs,其中1款国产,3款进口。辉瑞的“注射用伊珠单抗奥唑米星”由CD22靶向单抗inotuzumab与细胞毒制剂卡奇霉素偶联而成,适应症为成人复发或难治性前体B细胞急性淋巴细胞性白血病;罗氏的恩美曲妥珠单抗(ado-trastuzumab emtansine,Kadcyla)是由抗 HER2 靶向药物曲妥珠单抗与抑制微管聚集的化疗药物美坦新(DM1)通过硫醚连接子连接而成的ADC;武田的维布妥昔单抗(Brentuximab vedotin,Adcetris)是由CD30靶向的单克隆抗体Brentuximab、微管破坏剂MMAE和一种蛋白酶敏感的交联剂组成,主要适应症为霍奇金淋巴瘤、原发性皮肤间变性大细胞淋巴瘤、系统性间变性大细胞淋巴瘤等;纬迪西妥单抗是荣昌生物自主研发的一款ADC,由人源化HER2抗体和毒素载荷一甲基澳瑞他汀E(MMAE)通过可被组织蛋白酶剪切的连接子彼此偶连而成的,2021年6月在国内被NMPA批准用于治疗至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者。
在国内,ADC药物市场还有较大发展空间。以荣昌生物为例,根据荣昌生物2022年2月18日在上交所提交的招股书披露,预计2022年维迪西妥单抗的销量可以达到4亿元。自维迪西妥单抗上市以来,国内ADC药物逐渐进入到了收获期,在ADC领域内也持续诞生了多起投融资事件。
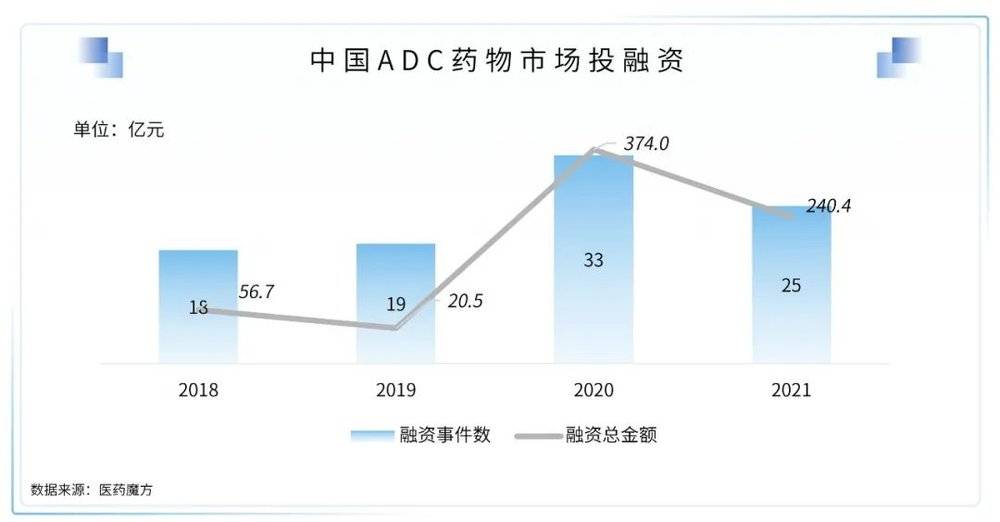
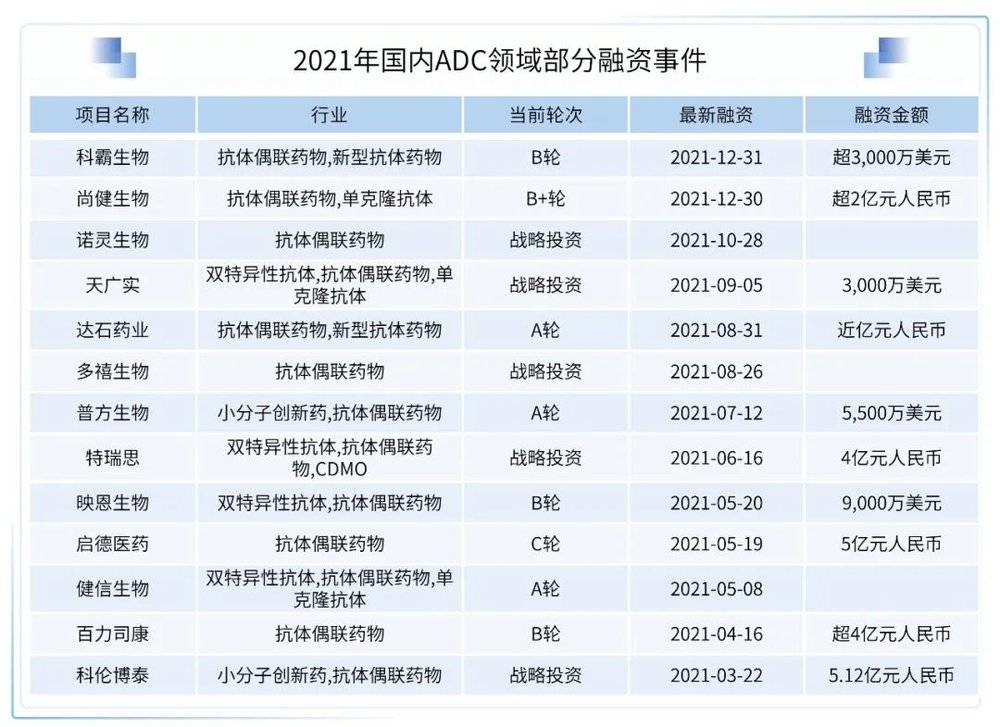
在国内鼓励药企自主创新和加快引进符合临床未满足需求药品的政策环境下,未来ADC药物会更多地占据中国市场,ADC领域的优质标的也会持续受到资本市场关注。
4. 合成生物学迎来高光时刻,应用落地且备受市场认可
根据美国合成生物学媒体SynBioBeta发布的2021年合成生物学投融资报告披露,2021年是有史以来合成生物学融资规模最大的一年,放眼全球的合成生物学公司,总共筹集了将近180亿美元。
(1)2021年,多家合成生物学头部公司在美国上市
美国合成生物学公司AbSci(NASDAQ:ABSI)在纳斯达克上市,发行价为每股16美元,发行1250万股,募资总额为2亿美元。AbSci创立于2011年,总部位于美国华盛顿州Vancouver,为蛋白质和生物制剂的发现和开发提供了平台。
合成生物独角兽公司Zymergen登陆纳斯达克,该公司在首次公开募股(IPO)中以每股31美元的价格出售了 1613 万股,筹集了超过5亿美元的资金,目前,Zymergen的市值约为37亿美元。
合成生物学平台型公司Ginkgo Bioworks于2021年9月登陆纽交所。根据上市协议,Ginkgo Bioworks估值为150亿美元,SPAC上市后新公司的估值达到175亿美元。上市后,Ginkgo的市值曾一度飙升至292亿美元。
PHA制造商DaniMer Scientific在NASDAQ上市,其成立于2004年,致力于通过使用生物聚合物材料,为全球对传统塑料的依赖性提供可生物降解且可持续的解决方案。Danimer的标志性聚合物Nodax PHA(聚羟基烷酸酯)是一种100%可生物降解、可再生和可持续的塑料,使用菜籽油作为主要原料生产。
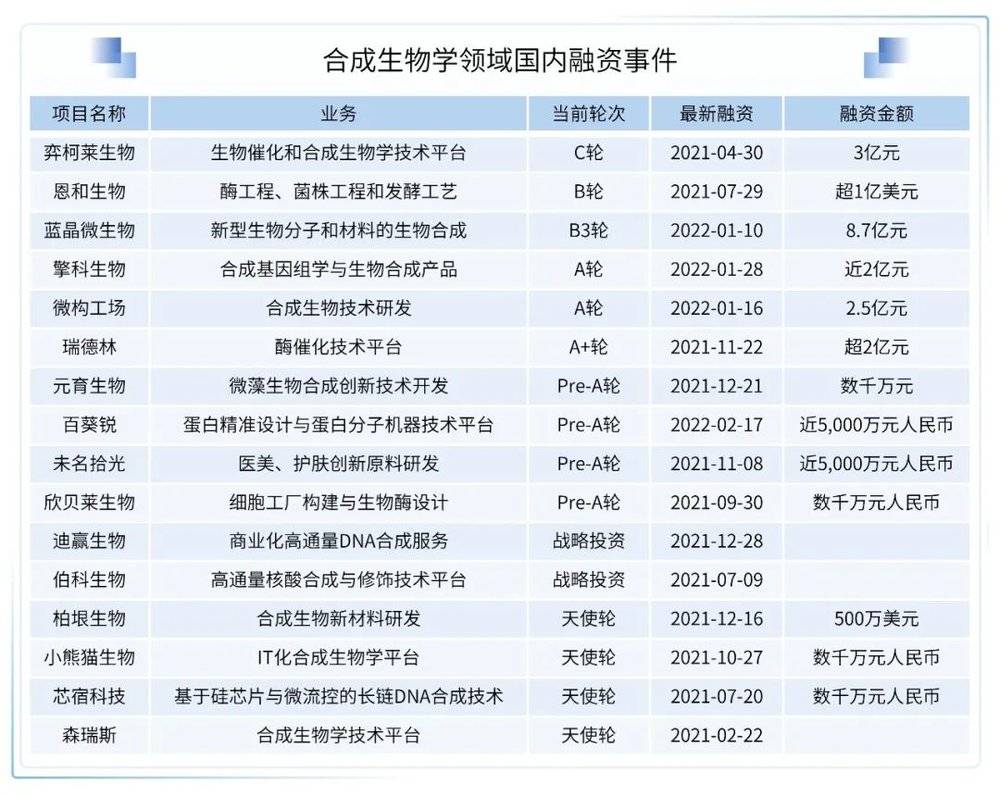
(2) 放眼国内,合成生物学在2021年也是各大投资机构的主要投资主题之一
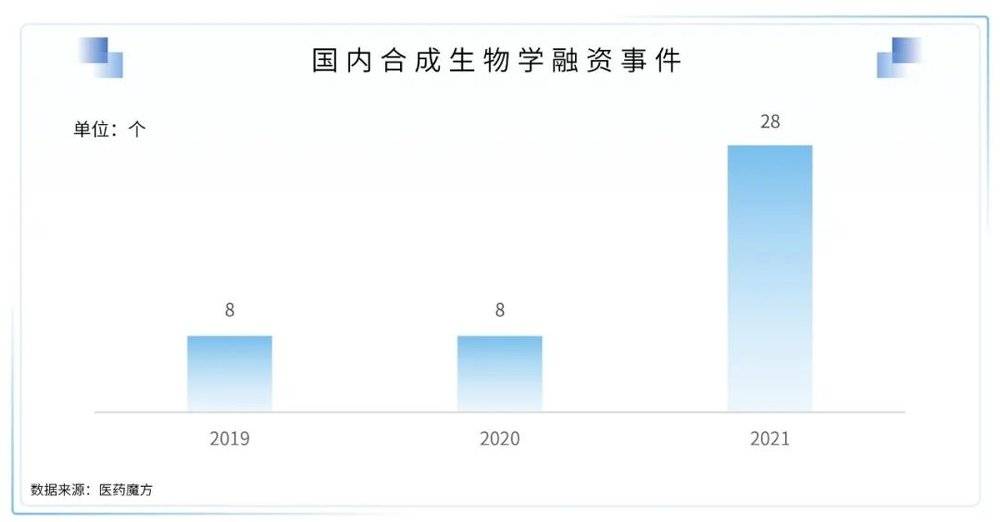
合成生物学公司蓝晶微生物(Bluepha)宣布完成B3轮融资:2021年,合成生物学公司蓝晶微生物(Bluepha)短短一年间完成总额达人民币15亿元的B系列融资,资金将会用于生物可降解材料PHA规模化生产设施的建设运营、工业4.0×合成生物学研发平台Synbio OS的开发部署,以及再生医学材料与工程益生菌等新产品管线的研发落地。
合成生物学新锐恩和生物(Bota Bio)完成超过1亿美元的B轮融资:Bota Bio成立于2019年,核心技术团队均拥有工业生物技术研发和产业化经验,完整覆盖生物计算、菌株工程和生产工艺等各个技术模块。借助本轮融资,Bota Bio将继续拓展全球业务,进一步完善Bota Freeway和高精度发酵平台以及中试工厂的搭建,扩大消费品、食品、营养品和医药等产品管线的开发。
弈柯莱生物完成近人民币3亿元C轮融资并进入科创板上市辅导期:弈柯莱生物成立于2015年4月,一家拥有先进的酶工程技术和基因工程技术的高科技企业,主要从事生物催化和合成生物学方法的研究和开发。本轮融资将主要用于公司在合成生物学产品上的研发以及推进在重庆新生产基地的建设,新一轮融资的注入将进一步加强弈柯莱生物在生物智造领域的领先实力。
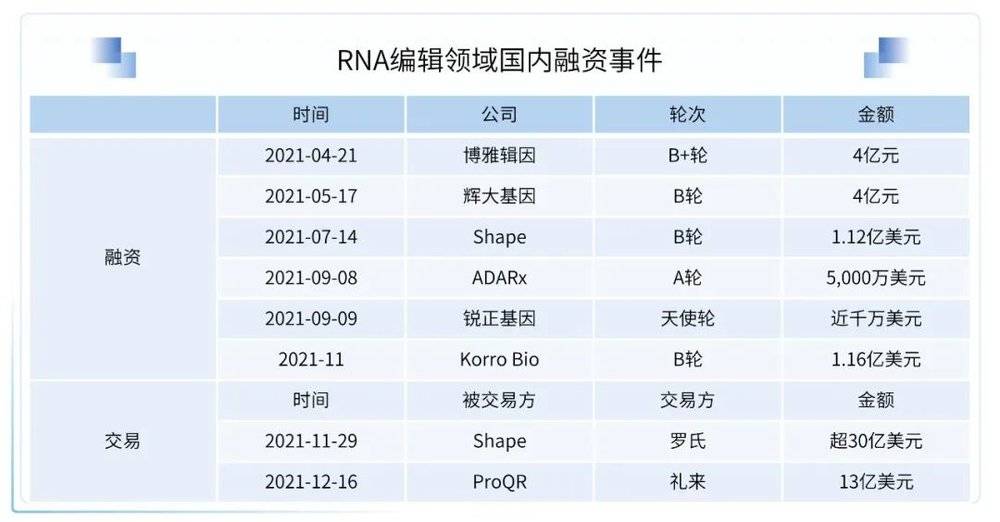
与基因组编辑相比,RNA编辑所产生的改变并不是永久性的,因为其不会影响机体的基因组序列,而且能够按照序列特异性的方式来完成。因此,从治疗的目的来看,RNA的编辑比基因组编辑更加可取,如今大量研究正在试图通过人工RNA编辑来修饰转录物的遗传密码,从而实现对遗传性疾病的治疗。
本文来自微信公众号:易凯资本(ID:China-eCapital2000),作者:张骁 、卫玲波 、杨冰,编辑:郭邦晖 、吴靖 、高大伟

