本文来自微信公众号:果壳 (ID:Guokr42),作者:代天医、黎小球,编辑:odette,原文标题:《猪心脏移植第一人去世,术后存活2个月》,头图来自:pixabay
根据美国马里兰大学医学中心的报道,全球首位接受猪心脏移植的患者在术后两个月去世。
1月7日接受移植后,患者在几周内没有出现排斥现象,但几天前病情恶化,最终于当地时间3月8日去世,确切原因尚不明确。
一、两个月,不是结束而是开始
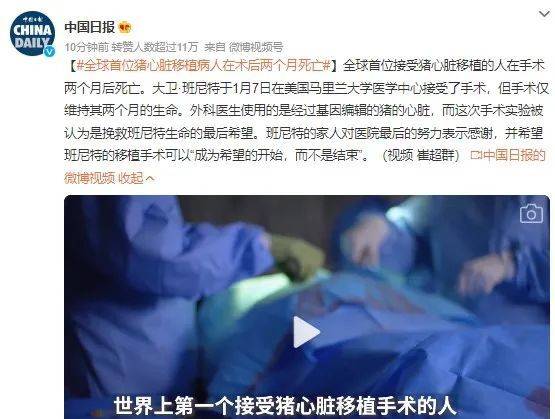
接受移植手术的是一位叫做大卫·贝内特(David Bennett)的57岁男性,他患有终末期心脏病,不符合人体心脏移植手术以及使用心脏辅助装置的条件。于是,接受异种移植成了贝内特活下去的唯一希望,根据马里兰大学医学院提供的一份声明,他在手术前一天说:“要么死,要么做移植手术。我想活下去。”
美国食品药品监督管理局(FDA)于去年 12 月 31 日批准了该手术的紧急授权——当患者的生命安全受到威胁、又没有其他选择时可以使用。手术中使用的基因编辑猪来自于弗吉尼亚州的一家医药公司Revivicor,特别之处在于,该猪经过多种基因编辑。
手术在当地时间今年1月7日进行,用时7小时。3天后,医生表示贝内特状况良好,这表明基因编辑动物的心脏可以在人体内发挥作用并且没有立即引起排斥反应。
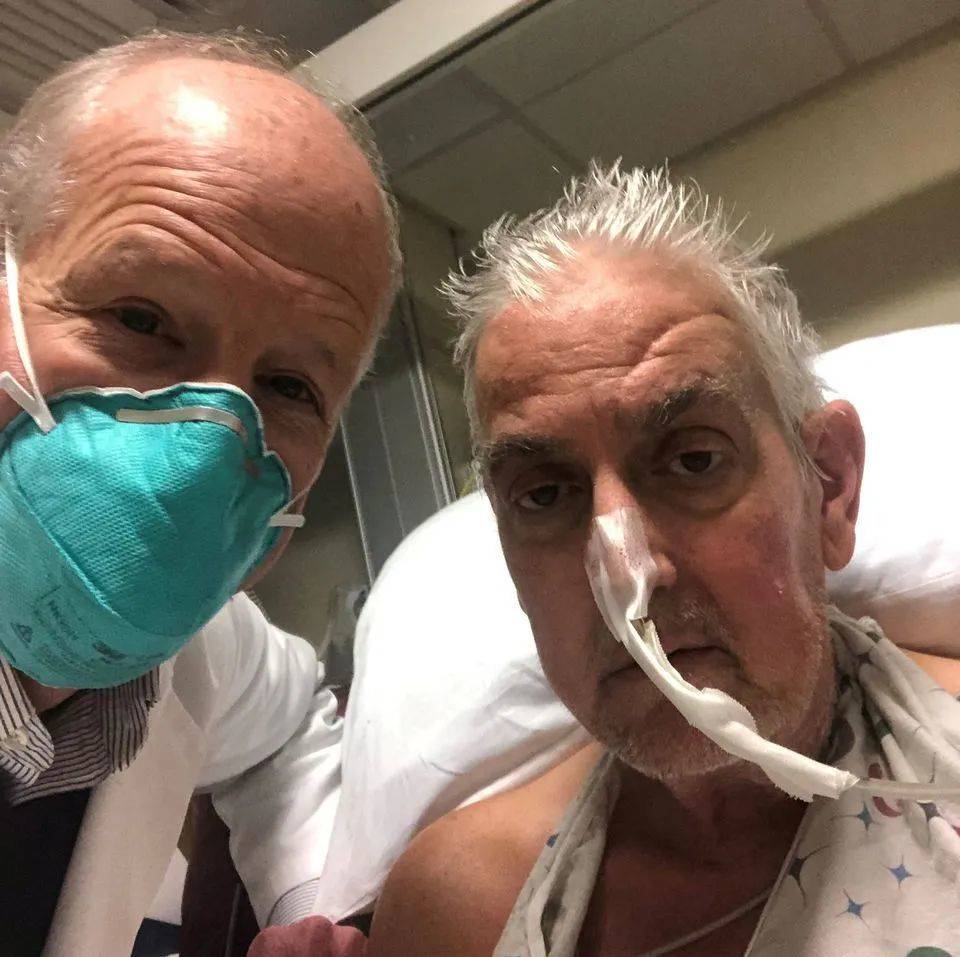
之后的几周,移植心脏也在贝内特体内工作得很好,没有出现排斥现象。那段时间,贝内特可以与家人共度时光、接受康复治疗,还曾坐起来与理疗师一起观看了超级碗比赛,并常聊到想回家去照顾他的狗Lucky。
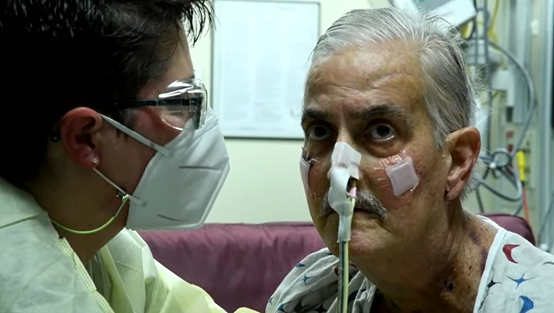
几天前贝内特的病情开始恶化,经过姑息治疗,他最终在术后两个月时去世。在生命的最后几小时,他仍能与家人交流。
医院发言人表示,在贝内特去世时没有发现明确的死亡原因,研究人员计划进行详细的分析并将结果发布于专业期刊上。
虽然这次手术只为贝内特延长了两个月的生命,但已经超越了上一个心脏异种移植的里程碑,1984年美国婴儿移植狒狒的心脏后仅存活了21天。
马里兰大学医学院心脏异种移植项目的外科教授穆罕默德·M.毛希丁(Muhammad M. Mohiuddin)表示:“我们感谢贝内特先生独特而具历史性的帮助,他为异种移植领域贡献了大量的知识。”“我们保持乐观,并计划在未来的临床试验中继续我们的工作。”
为贝内特进行移植的医生补充:“与世界上任何首例移植手术一样,这次手术带来了宝贵的见解,有望支持移植外科医生改善手术预后,并可能帮助挽救未来患者的生命。”
二、猪心换人心,困难重重
移植,是很多终末期器官衰竭的治疗方法。中国的器官移植等待名单上有超过30万人,但每年只有约1.6万个器官可用。如果异种移植可以实现,将明显缓解器官紧缺的问题。
至于提供器官的物种,猪并不是最初的首选。从20年代到90年代,人们一直在尝试使用狒狒等灵长类动物的心脏、肾脏和肝脏进行移植,但由于繁殖困难、器官大小差异、跨物种传染疾病及伦理等问题,移植并不成功。
而猪产仔数量大、成熟期短、体型大小及生理特点与人类比较接近,异种动物病风险低,基因工程技术便于实施。于是,90年代之后,猪逐渐成为最有潜力的提供器官物种。
数十年前,猪的心脏瓣膜已经被成功用于治疗人类心脏病,可以在心脏中替代人类瓣膜的作用。然而,用整个猪心脏顶替人类心脏的手术一直没有获得成功。
移植排斥反应
困难主要在于猪与人类的基因差异很大,跨越物种的异种移植会导致严重的免疫排斥反应。猪心瓣膜中的猪细胞已经被去除,但完整猪心脏进入人体后,会受到攻击和损伤。
人体内储备着多种对抗外来异物的抗体,其中也包括抗猪抗体,在猪心脏进入人体后几分钟到几小时内,这些抗体会与猪细胞上的抗原结合,激活一系列因子,迅速导致猪细胞损伤及血管破坏,猪心脏失去功能,最终移植失败。这个过程也被称为超急性异种移植排斥。
之后的数天至数周,人体内的免疫细胞也会参与攻击,直接导致猪细胞死亡及炎症反应(细胞异种移植排斥),其后还有更为长久的慢性排斥反应。相对于人与人之间的同种异体移植,人体对猪器官的排斥反应更加强烈。
据马里兰大学医学院称,为了避免排斥反应,研究人员为猪敲除了3个导致人类排斥的基因,并添加了6个帮助人类免疫系统接受猪心脏的基因。另外,贝内特术后可能需要通过药物抑制免疫系统,以保护移植猪心脏。
传染性疾病
人与人之间的器官移植存在传播疾病的风险,猪心脏进入人体后,也可能会将猪携带的病原体传递给人,使人患病。为狒狒进行猪心脏移植的研究中,有狒狒术后因感染猪巨细胞病毒而死亡。
对于大多数猪的病毒、细菌和真菌,可以通过检测与挑选、控制繁殖条件、早期断奶和胚胎移植等消除。然而,猪内源性逆转录病毒可整合到猪基因组中,灭活难度更大。
降低感染风险需要严格的微生物监测和报告、传染性诊断分析的开发、移植源动物的繁殖和检疫工作。
其他困难
因为猪与人的凝血系统分子有差异,部分猪因子无法调节人体的凝血,血小板功能也受到影响。所以移植手术后,凝血障碍可能导致猪心脏血管内形成血栓,造成心脏的缺血与损伤。如果情况进一步进展,凝血物质消耗可能导致人体全身凝血障碍,成为影响人存活时间的主要问题。患者可能需要抗凝等治疗调整凝血功能。
在之前的研究中,猪心脏被移植到灵长动物体内后出现了异常的心肌肥大与心脏体积增大。为预防心脏功能因此降低,研究人员为猪敲除了一个与之相关的基因。
面对这些问题,研究人员不断在灵长类动物中进行猪心脏移植的尝试,贝内特的手术医生在5年内为约50只狒狒进行了猪心移植。最初,未经基因编辑的猪心脏仅能在受体动物体内存活4~6小时。之后,经过基因编辑、免疫及凝血功能调节等各方面改进,移植成功率明显提高,而且接受移植的灵长类动物可存活半年以上,为人类的异种移植提供了可能。
三、猪的肾、肝、肺,也在研究中
贝内特并不是第一个接受猪器官移植的人,在2021年10月,纽约大学朗格尼健康医疗中心首次将猪的肾脏移植给人类。外科医生将基因编辑猪的肾脏与脑死亡患者的血管相连,观察到肾脏开始工作,没有立即发生排斥反应。近期,研究者将基因编辑猪的肾脏移植至恒河猴体内,已将最长生存期延长至一年以上。
相对于心脏和肾脏,猪肝移植更难进行,因为涉及的异种排斥相关分子机制更为复杂,血栓性微血管病和凝血病似乎更严重。目前,猪肝移植物的存活时间在狒狒中约为一个月。猪肺是受凝血功能障碍损害最严重的器官,近期,接受基因编辑猪肺移植的灵长类动物存活时间约为半个月。另外,以移植治疗糖尿病、帕金森病等疾病的研究也在进行中。
因此,心脏和肾脏可能是最先用于临床异种移植的两个实体器官,其他器官的移植在应用到人体之前,可能需要进一步的基因工程和免疫抑制治疗调整。
在贝内特去世后,他的儿子代表家人感谢了医院和医生的照顾,希望父亲的经历最终能帮助移植猪器官的患者延长生命:“我们希望这个故事可以成为希望的开始,而不是结束。”
很多新的治疗方式都经历过漫长的试验阶段,对于最先尝试新治疗的患者来说,他们本人的生活可能不会发生巨大改变,但最终他们的贡献也许将改变整个医学发展方向。
贝内特提供的详细资料,将提示我们距离缓解器官紧缺还有多远。

参考文献
1] https://www.theguardian.com/us-news/2022/jan/10/maryland-pig-heart-transplant-human-medical-first
[2] https://apnews.com/article/pig-heart-transplant-6651614cb9d73bada8eea2ecb6449aef
https://edition.cnn.com/2022/01/10/health/genetically-modified-pig-heart-transplant/index.html
[3] Lu T, Yang B, Wang R, Qin C. Xenotransplantation: Current Status in Preclinical Research. Front Immunol. 2020;10:3060.
[4] Platt JL, Piedrahita JA, Cascalho M. Clinical xenotransplantation of the heart: At the watershed. J Heart Lung Transplant. 2020;39(8):758-760.
[5] Reichart B, Längin M, Radan J, et al. Pig-to-non-human primate heart transplantation: The final step toward clinical xenotransplantation? J Heart Lung Transplant. 2020;39(8):751-757.
[6] Cooper DKC, Gaston R, Eckhoff D, Ladowski J, Yamamoto T, Wang L, Iwase H, Hara H, Tector M, Tector AJ. Xenotransplantation-the current status and prospects. Br Med Bull. 2018;125(1):5-14.
[7] https://www.bbc.com/news/health-58993696
[8] https://www.usatoday.com/story/news/health/2022/03/09/human-pig-heart-transplant-patient-dies/9437650002/
[9] https://www.medschool.umaryland.edu/news/2022/IN-MEMORIAM-David-Bennett-Sr.html
本文来自微信公众号:果壳 (ID:Guokr42),作者:代天医、黎小球,编辑:odette

