本文来自微信公众号:每日经济新闻(ID:nbdnews),编辑:孙志成、王嘉琦、易启江,校对:段炼,原文标题:《术后约2个月,全球首位“猪心移植”患者离世,术前曾说:要么死,要么做移植》,头图来自:视觉中国
3月9日,马里兰大学医学院在其官网发布消息称,人类历史上首个移植基因编辑猪心的患者David Bennett(大卫·贝内特)已经于周二(3月8日)去世,距离其接受手术约两个月。
院方表示,几天前他的状况出现恶化。
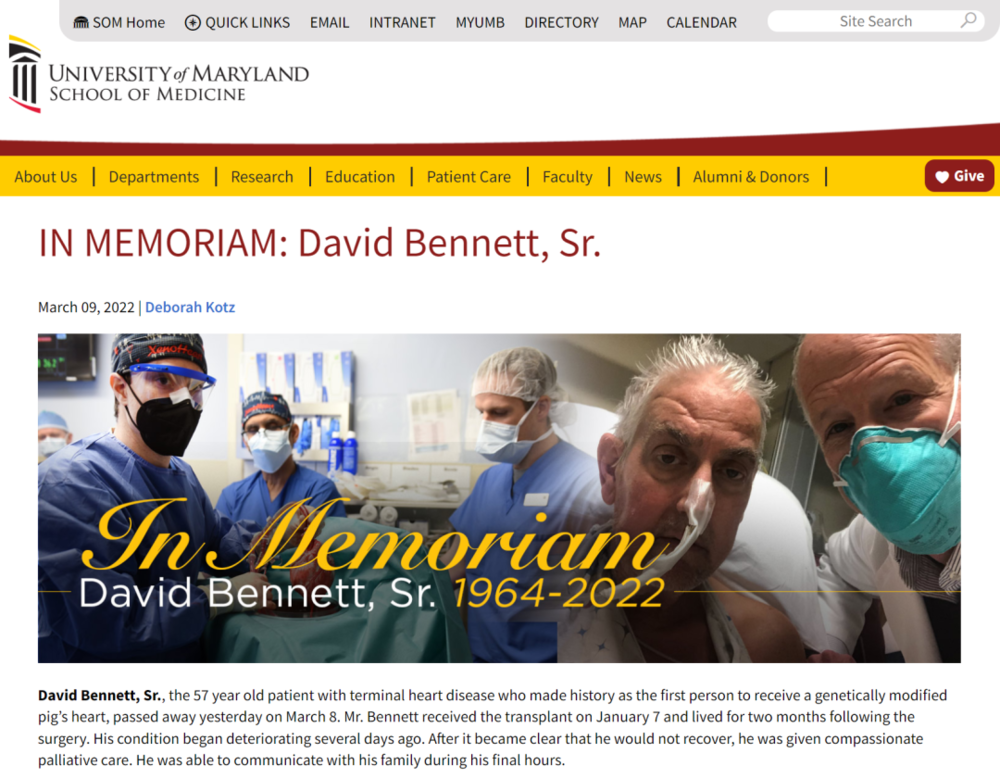
医院方面还表示,目前无法对死因作进一步评论,因为医生还没有进行彻底检查。院方计划在一份同行评审的医学杂志上公布结果。
一、人类首次将转基因猪心脏移植到患者体内
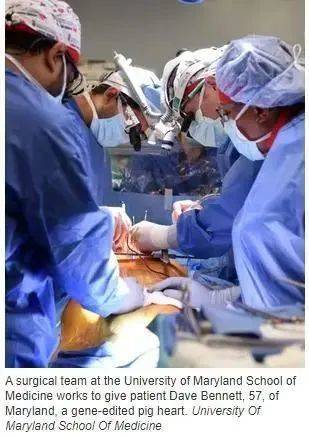
据海外网1月10日综合《今日美国》、美国广播公司等外媒消息,美国马里兰大学医学院当地时间10日在新闻发布会上表示,一名57岁的马里兰男子在接受转基因猪心脏移植手术3天后情况良好。
据报道,这是人类首次成功将转基因猪心脏移植到患者体内。
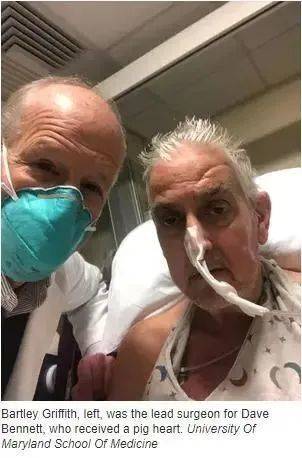
这名美国男子名叫大卫·贝内特,现年57岁。其主治医生说,手术在美国巴尔的摩进行,时长7小时,术后病患状况良好。外媒称,移植手术中使用的猪已经过基因改造,但贝内特接下来的情况未知。贝内特的儿子也称,当时一切处于未知状态。
心脏移植是挽救贝内特生命的最后希望,贝内特在手术前一天也表示:“要么死,要么做移植手术。这是我最后的选择。”手术前,他已卧床六周,处于心脏病晚期,他表示“期待自己康复后能下床行动”。
对于负责手术的医疗团队来说,这场手术标志着其多年研究的成果,该成果很可能改变全球许多人的命运。马里兰大学医学院在一份新闻稿中提到,这项手术将使世界“距离解决器官短缺危机更近一步”。
二、猪心移植背后的基因编辑
值得一提的是,本次手术中移植的猪心脏并非普通猪心脏,而是经过转基因培育的猪心脏。供体猪总共进行了10项基因编辑。其中,猪体内3个会导致人体产生快速免疫排斥反应的基因被剔除,人体中6个帮助免疫系统接受猪器官的基因被插入猪的基因组。为防止猪心过度生长,还有1个猪基因也被剔除。
转基因猪的器官一直是异种移植研究的重点。“现在我们拥有CRISPR基因工程,可以用于修饰动物基因,再加上移植后使用的免疫(排斥)抑制药物,使动物器官更容易在人体中发挥作用。”纽约大学兰贡(Langone)医学中心生物伦理学系主任亚瑟·卡普兰(Arthur L. Caplan)告诉《每日经济新闻》记者。
(编者注:CRISPR是一种基因组编辑技术,对生物的DNA序列进行修剪、切断、替换或添加。)
记者注意到,90年代中期,猪器官的一个主要问题是猪的内源性逆转录病毒(PERV),即动物基因组中的潜在致病 DNA 链,可能会感染人类患者并最终导致疾病。
被誉为“合成生物学之父”的美国国立卫生研究院基因科学卓越中心主任、哈佛大学基因工程学教授乔治·丘奇(George Church)领导的研究团队致力于通过CRISPR基因工程技术改善猪的基因以使其与人体更兼容,从而推动异种移植的临床应用。
贝内特接受的猪心脏正是基于乔治·丘奇团队的技术突破,进行了基因编辑。乔治·丘奇告诉每经记者,“我们已经淘汰了所有内源性逆转录病毒,约为25~60 个,具体数量取决于供体猪的品种,从而降低了(通常是)免疫抑制患者的人畜共患感染风险。”
乔治·丘奇团队的这一成果最早于2015年发表,《科学》杂志在当时称其为“迄今为止最广泛的CRISPR编辑壮举”,这一成果也为本次的猪心脏移植打下了基础。
此外,乔治·丘奇还向每经记者介绍了其实验室对猪进行的其他基因编辑工作,“严重、快速的免疫排斥反应是由非人类糖类介导的,因此我们已经修饰了猪体内3个这样的基因——GGTA1、CMAH和β4GalNT2。在人类器官的移植中,会发生严重但较为缓慢的免疫排斥反应,这与主要组织相容性(major histocompatibility, MHC)基因相关,基于此,我们也修饰了猪的类似基因。”
“除了上述基因之外,还有参与逃避自然杀伤细胞(如 HLAE/G)和抗炎基因(如 A20)的基因,以及与血液补体和凝血级联有关的基因。”乔治·丘奇补充道。
三、器官短缺的解药?
器官移植是许多器官衰竭患者的唯一希望。据官方数据,目前美国有超过11万人在等待器官移植,每年约有6000人在等待中死亡。如果异种移植能够实现,将可以挽救数万人的生命。
贝内特的案例给科学界带去了莫大的鼓舞,许多科学家将其视为一项具有开拓意义的手术,为解决器官短缺提供了潜在的巨大希望。
除了转基因猪心脏之外,转基因猪肾脏和猪肝脏也有希望用于临床异种移植。亚瑟·卡普兰在采访中透露,其所在的纽约大学兰贡医学中心在最近展开了研究,在已死亡并使用呼吸机维持的患者中移植了转基因猪肾。初步结果表明,在最初几天可以预防异种移植的排斥反应。
在被问及转基因动物器官的异种移植前景时,乔治·丘奇告诉《每日经济新闻》记者:“我们已经发现动物体内对病原体、衰老、渐冻人症和癌症的抵抗性,这些特性也将在猪的异种移植体系中得到改进。”不过他也强调,这并非说明猪已经对各种人类特异性病原体具有抗药性,如艾滋病毒、脊髓灰质炎、梅毒等。
虽然本次移植让全世界看到了希望,但异种移植充满了困难和风险,若触发严重免疫排斥反应,将对患者造成致命的后果。
亚瑟·卡普兰认为,即便通过基因工程对猪基因进行了修饰,结果仍然是不确定的。“移植手术后的几周内,(贝内特)仍然有发生免疫排斥反应和病毒感染的风险。”
四、异种移植任重道远
实际上,在此之前,猪的心脏瓣膜早已被成功用于治疗人类心脏病,它与猪心脏移植有何不同?是如何解决免疫排斥问题的呢?亚瑟·卡普兰告诉《每日经济新闻》记者,“猪的心脏瓣膜几乎没有血液,它的主要构成是软骨,并不会产生任何免疫排斥反应。”
乔治·丘奇则补充道,“到目前为止,猪心脏瓣膜并非存活的器官,功能如同皮革,并且随着受体(心脏)的增长需要更换。”
据报道,在进行猪心脏瓣膜手术时,其中所有的猪细胞在移植前都已被去除,因此患者也不必服用免疫抑制药物。
此外,在亚瑟·卡普兰看来,猪和人的寿命并不相同,猪心脏的衰老速度可能将比人类更快。对此,乔治·丘奇透露,“我的实验室正在努力延长狗和人类的寿命,(这种方法)可能也适用于猪。”
每日经济新闻综合海外网、每经app
本文来自微信公众号:每日经济新闻(ID:nbdnews),编辑:孙志成、王嘉琦、易启江

