2020年10月5日,华中科技大学同济药学院李华教授、张勇慧教授等领导的科学团队在Cell子刊iScience上发表了一篇重磅论文:
Furin A Potential Therapeutic Target for COVID-19(Furin,COVID-19的潜在治疗靶点)
https://www.cell.com/iscience/fulltext/S2589-0042(20)30834-8?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS2589004220308348%3Fshowall%3Dtrue
论文的部分要点包括:
1、在新冠所属的冠状病毒β谱系B支系,只有一种病毒具有S1/S2处(S蛋白S1、S2亚基交界处)的furin酶切位点,该病毒就是新冠病毒;
2、通过在线软件搜索发现,所有与新冠病毒刺突蛋白同源性(相似度)大于40% 的冠状病毒都不具有(S1/S2处的)furin酶切位点;
3、新冠S1/S2处(刺突蛋白S1、S2亚基交界处)特有的furin酶切组合“RRAR”(精氨酸-精氨酸-丙氨酸-精氨酸)在其家族中是独一无二的,该组合的出现是新冠异于所有近亲的独特插入“PRRA”(脯氨酸-精氨酸-精氨酸-丙氨酸)导致的。
注:furin酶切位点指符合furin蛋白酶“RXXR”识别标志的氨基酸组合;后续内容还将多次提及新冠中的furin酶切组合“RRAR”,及导致这一furin酶切组合出现的四氨基酸组合“PRRA”,请大家注意区分。

新冠病毒(SARS-2)与SARS病毒S1/S2处氨基酸差异对照图
4、新冠的furin酶切位点不太可能是从MERS、HCoV-HKU1 等病毒进化而来的,从生物信息数据库目前可用的序列中,我们很难找到来源,或许还有很多进化的中间序列有待发现。

新冠病毒(Wuhan-Hu-1毒株)与进化树中其它冠状病毒在S1/S2附近氨基酸序列对比图
上图来自其它论文。由图可见,进化树中其它病毒在S1/S2处都空缺新冠独有的“PRRA”,新冠相比其所有近亲“凭空”多出的这四个氨基酸在图中极为刺眼、突兀。
很多人认为新冠病毒进化自蝙蝠冠状病毒,然而,在新冠所在的β谱系,没有一种蝙蝠冠状病毒具有furin酶切位点(更别说具有新冠特有的RRAR酶切标志);有人认为新冠病毒的中间宿主是穿山甲,但是,同样地,没有一种穿山甲冠状病毒具有furin酶切位点。
那么,新冠的furin酶切位点--其特有的furin酶切组合“RRAR”到底有没有出处?它是从石头缝里蹦出来的吗?是新冠的首创吗?它真的毫无出处可寻吗?
找出“RRAR”的出处,并判断其来源,这就是本文要解决的核心问题。
II 蝙蝠冠状病毒RmYN02刺突蛋白中的“P-AA”组合
2020年5月10日,来自山东第一医科大学、中国科学院北京生命科学研究所、中国科学院西双版纳热带植物园、中国科学院武汉病毒研究所、澳大利亚悉尼大学等7所机构的学者在《细胞》(Cell)旗下子刊《现代生物学》(Current Biology)在线发表了如下论文:
A novel bat coronavirus closely related to SARS-CoV-2 contains natural insertions at the S1/S2 cleavage site of the spike protein
(一种与SARS-CoV-2 密切相关的新型蝙蝠冠状病毒在刺突蛋白的S1/S2切割位点含有天然插入物)
https://www.cell.com/current-biology/fulltext/S0960-9822(20)30662-X?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS096098222030662X%3Fshowall%3Dtrue
论文指出:
去年(2019年)在云南勐腊县的蝙蝠样本中发现了一种蝙蝠冠状病毒RmYN02,该病毒S蛋白S1、S2亚基交界处也存在三个插入氨基酸残基PAA。因此,新冠S1、S2交界处的“PRRA”组合在近亲中并非独一无二;RmYN02病毒S1/S2处PAA组合的发现,是新冠病毒相同位置处的“PRRA”组合不是“人工插入”,及新冠起源于自然的有力证据。

RmYN02与新冠S1/S2处氨基酸(残基)对照图(摘自论文)
提供一些背景说明。RmYN02是与新冠第二相似的病毒,仅次于相似度为96.2%的另一蝙蝠冠状病毒RaTG13。RmYN02与新冠的全基因组序列一致性为93.3%,二者在最长编码基因区1ab的一致性达到97.2%。
虽然整体相似度较高,但二者刺突蛋白(S蛋白)基因序列的相似度仅为71.8%,二者RBD(Receptor Bind Domain,受体结合域,S蛋白S1亚基的一部分,决定冠状病毒的ACE2结合能力,细胞进入能力)的相似度更低至62.4%。RmYN02不可能是新冠的直接或较近进化祖先。
7所机构的上述论文靠谱吗?非常非常不靠谱。为啥?
1、RmYN02病毒只有基因序列,没有病毒毒株(RaTG13也是如此),它的基因序列不是对病毒毒株测序得出的,而是“分析”蝙蝠遗留物(排泄物)中的RNA片断,用不完整的残片结合人为推测“拼装”出来的,其“分析”、“拼装”过程是不透明的。RmYN02很可能根本没有物理存在过。
2、研究发现,RmYN02的基因序列很可能存在数据造假或数据污染的问题;
3、论文未提供对齐算法,按照多种对齐算法,都得不出RmYN02在S1/S2处有PAA插入的结果。
2021年5月27日,加拿大Youthereum 遗传学公司的Yuri Deigin,奥地利因斯布鲁克大学微生物学系的Rossana Segreto在BioEssays上发表了一篇论文:
SARS-CoV-2′s claimed natural origin is undermined by issues with genome sequences of its relative strains
Coronavirus sequences RaTG13, MP789 and RmYN02 raise multiple questions to be critically addressed by the scientific community
(SARS-CoV-2 声称的自然来源受到其相关毒株基因组序列问题的破坏
冠状病毒序列RaTG13、MP789 和RmYN02 引出了多个需要科学界认真解决的问题)
https://onlinelibrary.wiley.com/doi/full/10.1002/bies.202100015
注:论文发表的时间,恰恰是拜登宣布启动美国情报机构新冠溯源调查的第二天。
论文对中国科学家、学者在疫情发生后抛出的,用来证明新冠病毒来自自然界的三个病毒RaTG13、MP789 (一种马来亚穿山甲冠状病毒,其RBD与新冠病毒高度相似)、RmYN02提出了强烈质疑。
其中一个重要质疑是,论文指出,前述7所机构的RmYN02相关的论文未公开对齐算法,使用几种简洁、合理的对齐算法,都得不出中国学者的对比图。RmYN02中的PAA应该在什么位置呢?两位学者的质疑论文提供的对比图不够直观,另一篇新冠furin酶切位点相关论文中的如下对比图更直观、清晰。图中的Wuhan-Hu-1是复旦张永振团队测序并最早上传基因序列(约在2020年1月5日)所用的新冠毒株,其序列因测序的极高质量而被作为新冠病毒的参考序列。
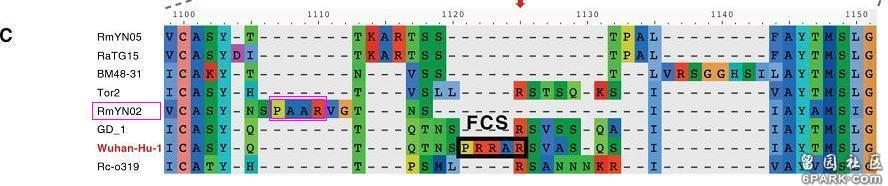
由图可见,按常用对齐算法,RmYN02的“PAA”插入根本不在S蛋白S1、S2亚基交界处;在S1/S2处,RmYN02不仅没有新增氨基酸,而且其缺失的氨基酸比新冠其它近亲病毒还要多。
为排除实验室来源论,中国科学家、学者急着抛出有问题的证据,落下了捂盖子的口实。中国、中国科学家确实有一些捂盖子的动机;但是,很少有人认识到,中国科学家的所作所为,与疫情发生第一年全球病毒学界的行为完全一致,他们更是在配合全球病毒学界的捂盖子集体行动。
病毒学界为什么要捂盖子?如果新冠病毒被证实是病毒学家设计、制造出来的,病毒学界的领导者人物们都将罪责难逃;所有病毒学家都将受到严重影响,他们的研究将受到极严格的法律约束和全社会的时刻审视、监督,他们不能再随心所欲地进行危险研究,扮演造物主,他们的科研项目将大幅萎缩,他们申请研究经费将难度倍增。。。;病毒学界集体捂盖子,也是全球病毒学界的领导者--美国的需要。
2020年2月18日,国际顶级医学期刊《柳叶刀》(The Lancet)在线发表了一篇由8个国家(英、德、美、澳、荷兰、西班牙、马拉西亚、中国)的27名著名病毒学家、流行病学家联合签署的一份声明:
Statement in support of the scientists, public health professionals, and medical professionals of China combatting COVID-19
支持中国抗击COVID-19 的科学家、公共卫生专业人员和医疗专业人员的声明
这份声明表面上是支持中国,实际上,它的真正目的是第一时间堵口“实验室来源论”。声明中说:在这次疫情中相关数据迅速、公开且透明的共享如今正受到关于该疾病起源的谣言和错误信息的威胁。“我们在此共同强烈谴责认为该新型冠状病毒疾病COVID-19并非自然起源的阴谋论。”
这27名顶尖病毒学、流行病学家以其科学权威的身份将“自然来源论”定义为正确的唯一可能,将“实验室来源论”定义为谣言、错误信息和“阴谋论”,振振有词地打着科学的幌子反科学,冠冕堂皇地强力禁止科学讨论、辩论。他们假装不知道病毒学界完全有能力设计、制造新冠病毒,假装不知道美国在疫情发生两年前的2017年12月19日全面重启了危险病原体的功能增益改造研究,假装不知道以美国的科技水平和以往的经验积累,在两年的功能增益改造研究中足以制造出新冠病毒。疫情发生后。他们不去深入分析、全面探究新冠病毒来源的各种可能性,而是第一时间去堵质疑者的嘴,迫不及待地污名质疑者,给“实验室来源论”扣上“阴谋论”的大帽子。他们为什么那么惧怕“实验室来源论”?为什么那么惧怕有人质疑美国等国的功能增益研究?他们是在为谁捂盖子,他们是在为哪个国家捂盖子?他们是在为中国病毒学家捂盖子吗?他们是在为中国捂盖子吗?
他们不是在帮中国捂盖子,他们中的大多数人非常清楚,新冠病毒根本就不是中国制造的。
新冠病毒产生,新冠疫情发生的复杂、曲折程度恐怕超出了绝大多数人的想象。但是,完全可以确定,新冠病毒根本不是武汉病毒研究所泄漏的,也根本不是武汉病毒研究所设计、制造的。关于前者,详尽分析可参见:
武汉病毒研究所是否泄漏了新冠病毒
https://club.bbs.com/bolun/index.php?app=forum&act=threadview&tid=15945493
下文则对两个问题都给出了简明分析:
美国之音年终谎言报道(二)
https://web.bbs.com/index.php?app=forum&bbsid=2060&act=view&tid=2471452
新冠疫情发生后,中美两国都第一时间积极地甩锅动物(重启美国危险病原体功能增益研究,迫切需要替罪羊的川普及共和党除外),但两者甩锅的目的有重大区别,中国的目的是证明,新冠不是(武汉本地)实验室泄漏的;美国的目的是证明,新冠不是实验室制造的。
在疫情发生后头一年,中美主流各界共同的甩锅目的是,证明新冠疫情不是人为造成的。
新冠溯源应该分解为两个方面的调查、分析:
1、新冠病毒源自何处;
2、新冠病毒是如何来到或出现在武汉的。
本文及我最近几篇文章聚焦的都是第一个问题。
III 小鼠肝炎病毒MHV-A59的furin酶切位点与新冠非常相似
小节I、II已指出,β谱系B支系除新冠外的所有冠状病毒,β谱系中的所有蝙蝠冠状病毒,新冠的所有近亲病毒(S蛋白相似度>40%)无一具有S1/S2处的酶切位点,无一在S1/S2处具有与新冠相同或相近的氨基酸插入。
把视野扩展到新冠的近亲之外,扩展到其它支系,其它谱系,能不能有所发现呢?
除了新冠所在的B支系,冠状病毒β谱系还有另外三个谱系,这些谱系有一些病毒在S1/S2处也有furin酶切位点,其中,最知名的是A支系的小鼠肝炎病毒MHV(Mouse Hepatitis Virus)的几个株系。小鼠肝炎病毒MHV有超过25个株系,其中被最研究最多、毒性(致病力)最强的三个株系是MHV-JHM、MHV-3、MHV-A59。这三种病毒之所以毒性强,就是因为它们在S1/S2处都有furin酶切位点。
先看 MHV-A59。
小鼠肝炎病毒MHV-A59的感染始于呼吸道,而后它将扩散至肝脏、肺、脑等器官。肝脏是它最主要的感染器官,感染结果是导致重型肝炎;大脑也是它的重要感染器官,它将引发脑膜脑炎及各种急、慢性神经性症状;它还能刺激小鼠自身的免疫反应,使急性感染后存活的小鼠患上神经元慢性脱髓鞘病(demyelination)。
MHV-A59(GenBank ID:YP_009824982.1)在S蛋白的S1/S2处也有furin酶切位点,它的furin酶切组合为“RAHR”,而新冠的furin酶切组合为“RRAR”;MHV-A59在S1/S2处的完整多元酶切组合为“RRAHR”,除了后四个RAHR组合可被furin蛋白酶识别切割之外,包括第一个R在内的每一个精氨基酸“R”还可被胰蛋白酶切割。“RRAHR”对应的新冠S1/S2处的五个氨基酸为“PRRAR”,二者都含有符合“RXXR”格式的furin酶切组合,都含有“RRA”组合。见下图。

新冠与MHV-A59 S蛋白aa(amino acid,氨基酸)序列对照图。
图中,Query序列对应新冠,Sbjct(Subject)序列对应MHV-A59。Query序列与Sbjct序列之间还有一行,这一行标出了二者相同的氨基酸,并用+号标出了二者不同但性质类似的氨基酸。
新冠病毒(及其S1/S2的furin酶切位点)可能是MHV-A59自然进化产生的吗?这是不可能的。虽然它们S1/S2处的furin酶切位点很相像,虽然它们同处冠状病毒的β谱系,但分处B、A两个支系这两种病毒基因结构、亲缘关系相去甚远,它们很可能500万年前就已经分家了,它们的进化距离相差十个银河系以上。二者结构的具体比较情况如下:
新冠的全基因组序列仅有26%与MHV-A59的全基因组序列具有可比对性(即二者74%的序列毫无相似之处),这26%的可比对部分的一致性仅为66.02%;
新冠S蛋白的aa(amino acid,氨基酸)序列有70%与MHV-A59可比对,二者70%的aa序列可比对部分的一致性仅为36.45%。
MHV-A59不是与新冠furin酶切位点最相像的病毒。
IV 最毒鼠肝炎病毒MHV-JHM S1/S2处含有新冠的“RRAR”酶切组合。
在小鼠肝炎病毒的20多个株系中,有两个株系毒性比MHV-A59毒性强得多:MHV-JHM和MHV-3。
其中,MHV-JHM是毒性最强的小鼠肝炎株系,具有高度的神经毒性,它引发的强烈脑炎能使小鼠瘫痪、死亡。在MHV各株系中,MHV-JHM毒性最强,被研究的也最多。
MHV-JHM(GenBank ID:YP_209233.1)在S1/S2处完整包含新冠的“RRAR”furin酶切组合,见下图:

新冠与MHV-JHM S蛋白aa序列对比图。Query:新冠;Sbjct:MHV-JHM
MHV-JHM S1/S2处的“RRAR”是该处多元furin酶切组合“RRARR”的一部分(前四个氨基酸,该组合还含另一个furin酶切组合“RARR”)。注意,MHV-A59的多元酶切组合是“RRAHR”,二者只有一个氨基酸不同,A59多元酶切组合的倒数第二个氨基酸是组氨酸(H),而JHM中则是精氨酸(R)。后文将说明,这一区别对它们的致病力影响巨大。
MHV另一毒性非常强的株系MHV-3(GenBank ID: ACN89743.1)在S1/S2处也含有“RRAR”furin酶切组合。见下图:

新冠与MHV-3 S蛋白aa序列对比图。Query:新冠;Sbjct:MHV-3
MHV-3在S1/S2处的多元酶切信号也是“RRARR”,与MHV-JHM相同。
新冠病毒可能是MHV-JHM或MHV-3自然演化产生的吗?这同样是不可能的。小鼠肝炎病毒各株系都位于β谱系的A支系,它们与B支系的“邻居”新冠的亲缘关系其实非常非常远,它们的结构与新冠差异非常巨大。具体而言,
新冠v.s.MHV-JHM:
新冠的全基因组序列仅有23%与MHV-JHM的全基因组序列具有可比对性(即二者77%的序列毫无相似之处),这23%的可比对部分的一致性仅为66.79%;
新冠S蛋白的aa(amino acid,氨基酸)序列有92%与MHV-JHM可比对,但可比对部分的一致性仅为36.65%。
新冠v.s.MHV-3:
新冠的全基因组序列仅有24%与MHV-3可比对(即二者76%的序列毫无相似之处),这24%的可比对部分的一致仅为66.27%;
新冠S蛋白的aa序列有91%与MHV-3可比对,但可比对部分的一致性仅为37.42%。
在小鼠肝炎病毒的二十多个株系中,被研究最多的就是毒性最强的MHV-JHM(研究次多的是MHV-A59和MHV-3)。诡异的是,在本文之前,我从未发现有论文或科学文章明确指出:新冠病毒使用了与两种鼠肝炎病毒一致的furin酶切组合,“RRAR”酶切组合在MHV-JHM、MHV-3的S1/S2处早已存在。
V 某些猫冠状病毒S蛋白中也有“RRAR”组合
猫是鼠的天敌。有趣的是,某些猫冠状病毒的S蛋白中也存在“RRAR”四氨基酸组合。见下图:

新冠、一种猫冠状病毒(Genbank ID:AIL54258.1 )S蛋白中的“RRAR”对照图
注:猫冠状病毒的S蛋白与新冠S蛋白整体差异太大,几无可比之处,不便对S蛋白aa序列全长比对,上图是比较二者“RRAR”周围各长约100的一段氨基酸序列所显示的结果。
猫冠状病毒中的“RRAR”应该不在其S蛋白的S1/S2位置(除非其S1蛋白非常短), 上图中“PRRARR”组合的起始位置是S蛋白的第65个氨基酸,而新冠的“PRRAR”组合的起始位置是S蛋白的第681个氨基酸,二者错位了600多个氨基酸。
新冠病毒可能自然演化自猫冠状病毒吗?更不可能。猫冠状病毒与新冠病毒不仅不属于同一支系,而且不属于同一谱系。新冠属于β谱系,而猫冠状病毒属于α 谱系。
VI 新冠S1/S2处的furin酶切位点是自然重组引入的吗?
新冠病毒不可能是MHV-JHM、MHV-3、MHV-A59、猫冠状病毒等有相同“RRAR”组合或相近furin酶切组合的冠状病毒自然演化而来的;那么,它可能是MHV-JHM、MHV-3或猫冠状病毒与新冠的近亲病毒自然重组产生的吗?
这恐怕也没有可能。理由如下:
1、MHV-JHM或MHV-3或猫冠状病毒与新冠病毒的某一近亲发生自然重组需要以下条件:双方感染一个共同的宿主。然而,三种病毒的宿主是小鼠或猫,而新冠近亲的宿主是蝙蝠(主要是菊头蝠),鼠冠状病毒、猫冠状病毒感染蝙蝠,或蝙蝠冠状病毒感染鼠、猫的情况未见报道过,他们感染同一宿主的条件很难满足;
2、自然重组是随机的、无目的的。如果新冠S1/S2处的“PRRA”是自然重组得来的,那么新冠在重组时应当获得包含“PRRA”在内的一截氨基酸序列,而不是只获得“PRRA”。然而,前文列出的所有aa序列对比结果都显示,在“PRRA”或“RRAR”两侧,新冠与相关病毒的氨基酸序列明显不同(包括四氨基酸组合在内,不存在长于7个氨基酸的相同序列片断)。这样的重组相当于是说,我只要你的PRRA或“RRAR”,其它的统统不要。如此精准、有目的的重组在自然界中极难发生;但在实验室中,把借鉴自其它病毒的氨基酸组合设计、插入到改造病毒中,则能轻而易举地促成这种“重组”。
3、2020年1月29日,一组希腊科学家在Elsevier上发表了如下论文:
Full-genome evolutionary analysis of the novel corona virus (2019-nCoV) rejects the hypothesis of emergence as a result of a recent recombination event
2019-nCoV的全基因组进化分析拒绝了(该病毒)因最近的重组事件而出现的假设
https://www.sciencedirect.com/science/article/pii/S1567134820300447
由论文标题即知,希腊科学家的全基因组进化分析结果显示,新冠病毒不是最近的重组事件产生的。
基于论文可判断,如果“PRRA”组合是重组得来的,那么获得“PRRA”的重组应该是较早前发生的。如果新冠祖先通过自然重组获得“PRRA”组合已经有一段时间了,那么,这一组合应该也会在新冠祖先的其它后代,也就是新冠的某些近亲中存在。但是,文首已经明确指出,新冠的近亲病毒无一具有“PRRA”组合。
因此,新冠S1/S2处的“PRRA”组合也不会是重组获得的。
新冠病毒不是鼠(猫)冠状病毒自然变异产生的,其S1/S2处的“PRRA”组合也不是鼠(猫)冠状病毒与新冠的近亲病毒重组引入的,那么,它来自哪里?只能是实验室设计、插入的。
VII RRAR是得到病毒学研究反复证明的非常优异的furin酶切组合
论文一
1995年12月20日,荷兰莱顿大学医学院病毒学系的四位科学家在Elsevier上发表了如下论文:
Mutational Analysis of the Murine Coronavirus Spike Protein: Effect on Cell-to-Cell Fusion
鼠冠状病毒刺突蛋白的突变分析:对细胞间融合的影响
https://www.sciencedirect.com/science/article/pii/S0042682285700566?via%3Dihub
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7131709/pdf/main.pdf
论文指出:
MHV-A59的切割信号为“RRAHR”,MHV-JHM的切割信号为“RRARR”,它们的切割信号只有一个氨基酸差异。如果将A59切割信号中的组氨酸(H)替换为精氨酸(R),那么,得到的切割信号与JHM相同的A59人工变异体S蛋白的切割效果将显著提高。这表明,JHM切割信号中的倒数第二个精氨酸R对其S蛋白的切割效果非常重要。

上图是论文中的配图。图中的wt(wild-type)指未改造的MHV-A59,论文设计了7个人工变异体,最下方的m7就是用精氨酸(R)替换组氨酸(H)得到的,用来模拟JHM切割信号的变异体。
论文二
1998年2月,三位费城宾夕法尼亚大学的科学家在Journal of Virology发表了如下论文:
The Spike Protein of Murine Coronavirus Mouse Hepatitis Virus Strain A59 Is Not Cleaved in Primary Glial Cells and Primary Hepatocytes
小鼠肝炎病毒MHV-A59 的刺突蛋白在原代神经胶质细胞和原代肝细胞中不会被裂解
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC124642/
论文指出:
1、MHV-3与MHV-JHM共有的furin切割信号“RRARR”可能比MHV-A59的furin切割信号“RRAHR”更好,前二者的S蛋白更容易被细胞内的furin样蛋白酶切割;
2、MHV-3的S蛋白在原代肝细胞中被切割,但MHV-A59的S蛋白在原代肝细胞中不被切割;
3、在成纤维细胞系中,MHV-3 S蛋白的切割似乎比MHV-A59更完整;
4、如果将MHV-A59的切割信号“RRAHR”突变(人工改造)为MHV-3的切割信号“RRARR”,将导致更完全的切割,突变体的切割效果与MHV-3的切割效果一致。
论文三
2020年10月5日,华中科技大学同济药学院李华教授、张勇慧教授等领导的科学团队在Cell子刊iScience上发表了一篇重磅论文:
Furin A Potential Therapeutic Target for COVID-19(Furin,COVID-19的潜在治疗靶点)
https://www.cell.com/iscience/fulltext/S2589-0042(20)30834-8?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS2589004220308348%3Fshowall%3Dtrue
论文指出:新冠S蛋白S1/S2处的“RRAR”基序是一个非常高效的furin酶切组合,它很容易被furin蛋白酶识别和水解,相比经典的furin酶切组合“RVRR”,“RRAR”在furin蛋白酶作用下的水解、裂解效率是“RVRR”的2倍。
VIII 结论
本文结论如下:
1、新冠病毒S1/S2处的furin酶切位点是人为设计、插入的;
2、有人将最毒小鼠肝炎病毒MHV-JHM(及MHV-3)S1/S2处的非常高效,对病毒毒性至关重要的酶切组合“RRARR”中的后四个氨基酸“RRAR”设计、应用到了新冠病毒中,以赋予新冠病毒强大的致病能力。
3、对新冠病毒与MHV-JHM(、MHV-3)S1/S2处酶切组合的明显关联,病毒学界始终一言不发,一直在集体隐瞒。隐瞒这一关联,就是为了掩盖有人借鉴MHV-JHM、MHV-3,设计新冠furin酶切位点的真相。
(正文完)
相关文章:
谁设计、制造了新冠病毒(二 上)
https://web.bbs.com/index.php?app=forum&bbsid=2060&act=view&tid=2490727

