本文来自微信公众号:中国工程院院刊(ID:CAE-Engineering),作者:胡渊、田志刚(免疫学家,中国工程院院士)、张彩,本文选自中国工程院院刊《Engineering》2019年第1期,原文标题:《基于自然杀伤细胞的癌症免疫疗法研究进展与前景丨Engineering》
自然杀伤细胞是重要的先天免疫细胞,是机体抵御病毒感染和癌症的第一道防线。自然杀伤细胞可以区分“自身”和“非自身”,识别异常细胞,并实时清除恶性转化的细胞和肿瘤。自然杀伤细胞一旦被活化,无需事先致敏即可快速裂解恶性细胞或病毒感染细胞,而且不受主要组织相容性复合体的限制,还可作为调节性细胞通过分泌多种细胞因子来启动和增强针对肿瘤或感染细胞的适应性免疫应答。
中国工程院田志刚院士科研团队在中国工程院院刊《Engineering》2019年第1期撰文指出,目前临床试验正在应用各种类型的自然杀伤细胞治疗不同类型的肿瘤,包括自体或同种异体自然杀伤细胞、脐带血或诱导性多能干细胞来源的自然杀伤细胞、记忆样自然杀伤细胞和自然杀伤细胞系NK-92 细胞。近年来,嵌合抗原受体修饰的自然杀伤细胞因其再导向特异性和有效的抗肿瘤活性而展现出巨大潜力。
文章总结了肿瘤逃逸自然杀伤细胞识别的机制、自然杀伤细胞免疫疗法的现状和进展、提升自然杀伤细胞体内抗肿瘤能力的途径以及该领域在临床实践中所面临的重大挑战。最后,文章指出,今后要进一步精心设计理想策略并与先进的技术相结合,改善自然杀伤细胞的增殖、持久性和效应功能,克服临床转化瓶颈,最大限度提高过继自然杀伤细胞免疫疗法的疗效。
一、引言
自然杀伤(natural killer,NK)细胞为先天免疫的主要细胞,为抵抗病原体和恶性肿瘤的入侵提供第一道防线。一旦被活化,NK细胞无需事先致敏即可快速裂解恶性细胞或病毒感染细胞,而且不受主要组织相容性复合体(major histocompatibility,MHC)的限制,还可作为调节性细胞通过分泌多种细胞因子来启动和增强针对肿瘤或感染细胞的适应性免疫应答。
NK细胞的效应功能受抑制性受体和刺激性受体间平衡的严格控制。NK细胞通过利用杀伤细胞免疫球蛋白样受体(killer cell immunoglobulin-like receptor,KIR)识别正常组织的主要组织MHC I类分子,向NK细胞传递抑制信号,以阻止NK细胞的活化。一旦病毒感染细胞或恶性转化细胞失去其主要组织MHC I类分子,活化的NK细胞受体,如NKG2D、NKp30、NKp46和NKp44,即可识别靶细胞上表达的压力诱导配体,从而为NK细胞杀伤靶细胞提供阳性信号 。
NK细胞通常被认为是先天免疫细胞的组分之一,识别抗原无特异性。然而,值得关注的是,一些研究人员发现,NK细胞在特定情况下可能具有适应性免疫细胞的特征,如具有免疫记忆。研究发现位于小鼠肝脏中的一群独特的组织驻留性CD49a+ DX5– NK细胞在皮肤接触性炎症和流感病毒感染期间具有记忆特征。
最近,研究发现CD49a+ NK细胞亚群(可能是与小鼠CD49a+ DX5– 肝脏驻留NK细胞对应的人肝脏驻留NK细胞亚群)在人肝脏中具有适应性免疫细胞的特征。通过在体外用白细胞介素-2(interleukin-2,IL-2)、IL-12和IL-15刺激,可从外周血(peripheral blood,PB)NK细胞诱导生成这些CD49a+ NK细胞;其具备与肝脏CD49a+ NK细胞相当的表型特征和功能特征,如高表达干扰素-γ(interferon-γ,IFN-γ)和NKG2C。此外,巨细胞病毒(cytomegalovirus,CMV)及不同细胞因子的组合可诱导NK细胞的记忆性应答。
研究发现,鼠Ly49H NK细胞亚群发挥记忆性应答,并在小鼠CMV感染期间发挥关键的病毒清除作用。同样的,已在急性人CMV(HCMV)感染的接受造血细胞移植的受者体内鉴定出HCMV诱导的对HCMV再次感染产生应答的记忆性NK细胞。这些CMV特异性记忆NK细胞的表型是NKG2C+ 、KIR+ 、CD57+ 和NKG2A– 。这些记忆NK细胞在同种异体移植后的第一年内会在体内存续很长时间,且在急性感染和二次感染期间可有效产生IFN-γ。
此外,利用IL-12、IL-15和IL-18进行短暂的预活化,诱导人体NK细胞分化成具有CD94、NKG2A和NKG2C表达但缺乏CD57和KIR表达的记忆样NK细胞。这些细胞因子诱导的记忆样NK细胞受到再刺激后分泌的IFN-γ有所增加。值得关注的是,这些有关适应性NK细胞的研究结果在癌症或感染性疾病的免疫治疗中颇具应用前景。在过继转输细胞因子诱导的记忆样NK细胞的I期临床试验中,NK细胞对急性髓样白血病(acute myeloid leukemia,AML)表现出强大的抗肿瘤能力。
基于嵌合抗原受体(chimeric antigen receptor,CAR)-T细胞的免疫治疗已成为癌症治疗领域的新突破。接受靶向CD19的CAR-T细胞输注的急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)患者临床完全缓解率高达70%~90%。事实上,相较于T细胞或CAR-T细胞疗法,基于NK细胞的免疫疗法有极大的优势。I期和II期临床试验表明,同种异体NK细胞的过继转输安全且耐受性好,并且不会导致移植物抗宿主病(graft-versus-host disease,GVHD)。T细胞的来源通常局限于自体细胞,但NK细胞可通过从骨髓或脐带血(umbilical cord blood,UCB)获得的自体或同种异体外周血制备,或由人胚胎干细胞或多能干细胞诱导;此外,可直接使用NK-92细胞系。
另外,已研发出许多药物来增强NK细胞的活性以取得更好的疗效。例如,命名为ALT-803的IL-15超级激动剂(IL-15与IL-15Rα复合物)可与NK细胞表面IL-15受体结合而活化NK细胞,从而促进NK细胞增殖及对血液恶性肿瘤和实体瘤(包括多发性骨髓瘤、卵巢癌、膀胱癌、乳腺癌和结肠癌)的细胞毒性。在I期临床研究中,19%的血液癌症患者在给予ALT-803后有缓解,包括一例持续7个月的完全缓解病例。这些例子表明,基于NK细胞的肿瘤免疫疗法颇有前景。本文总结了肿瘤逃逸NK细胞识别的机制、NK细胞免疫治疗的现状和研究进展、提升NK细胞的体内疗效的策略以及该领域临床应用所面临的重大挑战。
二、肿瘤逃逸自然杀伤细胞免疫监视的机制
尽管NK细胞是先天抗肿瘤免疫的主要成员,但肿瘤也形成了各种逃逸NK细胞攻击或损害NK细胞活性和功能的策略。这些策略会严重影响NK细胞治疗的效果。据报道,各种血液恶性肿瘤和实体瘤均存在NK细胞的功能失调。例如,在免疫应激下,肿瘤细胞通常会上调抑制性NK受体配体的表达,如KIR2DL4、免疫球蛋白样转录物2(immunoglobulin-like transcript 2,ILT2)和ILT4的配体——人类白细胞抗原-G(human leukocyte antigen-G,HLA-G),以逃逸NK细胞介导的杀伤。
研究发现,异常HLA-G表达与肿瘤患者不良预后相关,这意味着该分子在逃逸肿瘤免疫的过程中起作用。HLA-G通过与ILT2的结合抑制NK细胞的增殖和细胞毒性,并减少IFN-γ和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的产生。据报道,在尤文肉瘤上表达的HLA-G抑制GD2特异性CAR-NK细胞的活性。阻断慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)患者肿瘤细胞上的HLA-G可增强肿瘤对NK细胞杀伤的敏感性。
肿瘤逃逸NK细胞监视的另一个重要机制涉及肿瘤细胞产生的可溶性分子或配体。NK细胞增殖和活化需要IL-2。然而,肿瘤产生的可溶性IL-2Rα可以与IL-2结合,阻止其与NK细胞表面的IL-2R结合,导致NK细胞对外源性IL-2给药不敏感而影响NK细胞活性。据报道,NK细胞功能受损还与血清中高水平的NKp30的可溶性配体BAG6以及NKG2D的可溶性配体主要组织MHC I类相关链A(MHC class I-related chain A,MICA)和ULBP1-3相关。从肿瘤细胞脱落的可溶性配体阻止特异性NK细胞识别肿瘤细胞膜上的配体。肿瘤细胞通过蛋白质二硫键异构酶ERp5、去整合素及金属蛋白酶ADAM10和ADAM17的活性使配体从细胞膜上脱落。Ferrari de Andrade等最近设计了针对MICA和MICB的蛋白水解切割位点的抗体,证实这些抗体能有效地防止MICA和MICB从肿瘤细胞表面脱落,从而重新激活NK细胞的抗肿瘤能力。
肿瘤逃逸的主要机制与肿瘤微环境(tumor microenvironment,TME)有关,TME由免疫抑制细胞[如调节性T细胞(Treg)、肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)和髓源性抑制细胞(myeloid-derived suppressor cell,MDSC)、可溶性因子、在肿瘤细胞或抗原呈递细胞上表达的抑制性分子以及细胞外基质组成。
免疫抑制微环境不仅促进肿瘤的生长和迁移,而且还帮助肿瘤细胞逃逸宿主免疫的监视并抵抗免疫治疗。肿瘤细胞分泌各种免疫抑制因子,如转化生长因子-β(transforming growth factor-β,TGF-β)、IL-10、吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)和前列腺素E2(prostaglandin E2,PGE2),而抑制NK细胞的抗肿瘤活性。
许多研究已经证明,来源于肿瘤细胞的IDO和PGE2可显著抑制NK细胞产生细胞毒性和细胞因子。几种抑制性细胞(如调节性T细胞、MDSC和M2型巨噬细胞)可通过分泌IL-10和TGF-β削弱肿瘤内NK细胞的细胞毒性。TME中的肿瘤细胞、抗原呈递细胞和基质细胞表达高水平的程序性死亡配体1(programmed-death ligand 1,PD-L1)等抑制分子,通过与NK细胞上各自的抑制性受体结合来阻止NK细胞活化,从而导致NK细胞功能抑制甚至耗竭。
因此,肿瘤浸润的NK细胞通常表现出耗竭状态且易于凋亡,其特征为活化受体的表达降低,抑制性受体NKG2A、TIGIT以及T细胞免疫球蛋白和黏蛋白域分子3(Tim-3)表达上调,IFN-γ和TNF-α分泌水平较低。阻断这些抑制性检查点受体可以使NK细胞从耗竭中恢复过来,显著提高NK细胞免疫治疗的疗效。
设计合理的策略以攻克肿瘤免疫逃逸机制,特别是克服免疫抑制微环境,以获得理想的NK细胞的抗肿瘤免疫疗效极为重要。
三、基于自然杀伤细胞的肿瘤免疫疗法现状
(一)外周血来源的自体或异体自然杀伤细胞用于肿瘤免疫治疗
最早用于治疗肿瘤的NK细胞过继免疫疗法是转输来自外周血的IL-2活化自体NK细胞,动物实验已经证明这种疗法可抑制小鼠肺转移瘤的生长。然而,该方法应用于临床时,仅观察到有限的抗肿瘤效果。效果有限的主要原因是肿瘤细胞上的自身HLA分子与自体NK细胞上的KIR相匹配,导致NK细胞活性受到抑制。后来,采用KIR配体错配的同种异体或半相合NK细胞来克服这种抑制作用。输注同种异体NK细胞减少了宿主对移植物的排斥,同时可消除白血病复发,从而确保了疗效和安全性。
一些临床试验表明,NK细胞输注GVHD、细胞因子释放综合征(cytokine release syndrome,CRS)或神经毒性,因而具有良好的耐受性;然而,NK细胞输注对不同类型的癌症的治疗效果迥异。对于顽固性非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)、骨髓增生异常综合征( myelodysplastic syndrome, MDS)和AML等血液恶性肿瘤,客观临床缓解率为25%~100%。
最近一项临床试验表明,所有患高风险MDS和AML的可评估患者(5/+5可评估)在接受半相合NK细胞输注后达到了客观缓解。同种异体NK细胞输注通常与抗体治疗联用用于实体瘤的治疗,其功效亦得到了评估。
例如,过继性NK细胞疗法与曲妥珠单抗或西妥昔单抗化疗联用进行晚期胃癌或结直肠癌患者治疗I期临床试验治疗。6名评估患者中有4名患者的疾病进程稳定。值得注意的是,联合疗法显著促进了IFN-γ的产生,并减少了外周调节性T细胞的数量,因此,这4名稳定患者中,有3名患者的肿瘤变小。
在另一项I期临床试验中,同种异体NK细胞输注与西妥昔单抗联合用于治疗胃肠道肿瘤造成的肝转移,9名患者中,有3名患者出现客观临床缓解。在这些试验中,缓解不佳的常见问题与供体NK细胞在体内的存活时间有限(通常为两周)有关,同时也与IL-2给药会导致调节性T细胞增加有关。两项临床试验(NCT00274846和NCT01106950) 在 输 注 半 相 合NK细胞的过程中使用了IL-2-白喉毒素融合蛋白,以消除AML治疗期间出现的调节性T细胞。
结果表明,采用IL-2-白喉毒素融合蛋白治疗可提高完全缓解率和无病生存率,这与调节性T细胞的有效清除、供体NK细胞扩增以及血清IL-15水平升高有关。给予外源IL-15而非IL-2能够进一步提高疗效,因为IL-15不会促进调节性T细胞的存活和扩增。
(二)脐带血或诱导性多能干细胞来源的自然杀伤细胞用于肿瘤免疫治疗
除了来自外周血的NK细胞外,目前已将脐带血和诱导性多能干细胞(induced pluripotent stem cell,iPSC)通过与支持性饲养细胞共培养或通过不同细胞因子的组合进行刺激后用作功能性NK细胞的来源。脐带血或iPSC的突出优势包括来源丰富和容易按照药品生产质量管理规范(Good Manufacture Practice of Medical Products,GMP)进行临床级扩增,这些优点将使脐带血或iPSC来源的NK细胞有希望成为肿瘤免疫治疗的“即用型”产品。
目前,脐带血和iPSC来源的NK细胞的大规模临床级扩增技术已经成熟,已建立了从CD34+ 脐带血进行高对数级体外扩增NK细胞的方法,并可用作过继免疫治疗的临床级方案。该方法可达到15 000倍以上的扩增效率,纯度可达100%。来自脐带血的CD34+ 造血祖细胞用补充有多种细胞因子组合的新型临床级培养基扩增,可制备出表达NK细胞受体且能有效杀伤肿瘤细胞(包括白血病和实体瘤)的功能性CD56+ NK细胞。使用无外源性基质细胞、多种细胞因子组合(包括IL-3、IL-7、IL-15、SCF和Flt3L)诱导培养的两阶段培养体系,可将iPSC来源的NK细胞扩增100~1000倍。现已对脐带血或iPSC来源的NK细胞对各种类型的肿瘤(包括血液和实体瘤)的抗肿瘤活性进行了评估。
然而,与外周血单个核细胞(PB mononuclear cell,PBMC)来源的NK细胞相比,从脐带血或iPSC扩增的NK细胞的抗肿瘤活性更弱或相当。此外,脐带血和iPSC来源的NK细胞表达低水平的KIR;这就使人们要考虑到NK细胞驯化的问题,驯化是指NK细胞获得多种效应能力而同时保持对自身人类白细胞抗原耐受的过程。驯化的NK细胞通常具有较低的活化或抑制性信号的阈值,而未驯化的NK细胞则对活化或抑制信号具有低反应性。
相比之下,最近的一项研究表明,来自脐带血的未驯化NK细胞比来自PBMC的驯化的NK细胞对表达人类白细胞抗原宫颈肿瘤细胞系具有更强的细胞毒活性。因此,NK细胞驯化是否对癌症免疫疗法至关重要仍有待研究。
目前,有5项临床研究正在进行脐带血来源的NK细胞对复发性或难治性的血液和实体肿瘤的治疗。4项研究(NCT01729091、NCT03019640、NCT02280525和NCT03539406)目前正在招募患者。NCT00354172临床试验已完成研究。这项临床研究旨在找到CLL患者化疗时可输注的NK细胞最高耐受剂量,并了解联合NK细胞治疗是否能取得更好的治疗效果。临床结果显示,采用脐带血来源的NK细胞进行输注治疗后,15名血液癌症患者中,有两名患者无病存活了6个月。
(三)基于自然杀伤细胞系的肿瘤免疫治疗
已建立的NK细胞系有NK-92、NKL、YT、NK-YS和NKG。其中,NK-92细胞对恶性肿瘤细胞具有很强的广谱细胞毒活性,是唯一被美国食品药品监督管理局批准用于临床试验的细胞系。
NK-92细胞在临床应用中有几大优势。与同种异体或脐带血来源的NK细胞相比,NK-92细胞易在GMP条件下扩增,能减少患者的用药成本,可用病毒载体或非病毒载体有效操纵NK-92细胞,以增强其靶向、归巢和杀伤活性。临床试验结果证实,即使剂量为1 × 1010 个细胞·m–2,输注NK-92细胞也是安全的。NK-92细胞输注治疗肿瘤的功效已在黑素瘤、肉瘤、结直肠癌、肾癌、肺癌和AML患者进行评估。从综合缓解率或疾病稳定性方面来看,肺癌患者(4人中有3人)或肾细胞癌患者(11人中有5人)的临床缓解情况优于其他患者。
最近一项使用IL-2活化的NK-92细胞治疗顽固性和复发性AML的I期临床试验证明了该细胞的安全性和有效性,而且在7名患者中有3名显示出短暂的活性。然而,由于这些NK细胞在体内的存活时间有限,即使重复输注,NK-92疗法的功效仍然有限。
此外,由于NK-92细胞来自NHL患者,因此NK-92细胞在输注前必须予以照射,以便完全消除细胞增殖。然而,这种照射过程严重损害了它们在体内的持久性,因此通常数天内即无法在体内循环中检测到这种细胞。虽然增加细胞输注频率可能是一种改善持久性的简单方法,但反复细胞输注可能引发对NK-92细胞上表达的人类白细胞抗原的体液免疫应答。因此,一些研究团队目前试图通过基因修饰(如CAR修饰的NK-92细胞)来再导向其特异性和改善临床效果。
(四)记忆样自然杀伤细胞的潜在免疫治疗优势
尽管NK细胞是先天免疫的主要成员,但最近的研究证据表明,NK细胞显示出记忆样适应性免疫的特征。已报道了3种具有记忆样免疫反应特征的NK细胞:细胞因子诱导的记忆样NK细胞、CMV特异性NK细胞和肝脏驻留NK细胞。记忆样NK细胞的共同特征是:表达更高水平的NKG2C;长期体内增殖和持久性;用抗原或细胞因子进行再刺激后或与肿瘤细胞接触后,IFN-γ分泌增加。
这3种NK细胞的不同之处在于:细胞因子诱导的记忆样NK细胞和CMV特异性NK细胞对靶细胞具有更强的细胞毒活性,而肝脏驻留NK细胞则显示出较弱的脱颗粒水平。虽然NK细胞免疫治疗取得了长足进展,但由于NK细胞在体内寿命短,细胞毒活性低,因此临床疗效仍然有限。记忆样NK细胞的记忆功能以及长期体内增殖和持久性使其可能带来突破,成为基于NK细胞肿瘤免疫治疗的新来源。
通过用细胞因子IL-12、IL-15和IL-18的各种组合预活化人PB来源的NK细胞,可获得人细胞因子诱导的记忆样NK细胞。目前正在临床研究中评估这些记忆样NK细胞,且已完成I期临床试验。在短暂的预活化和过继转输后,这些NK细胞在异种移植小鼠模型中对AML显示出强抗肿瘤活性。
在临床研究中,转输的记忆样NK细胞增殖并在第7天至第14天达到峰值;此外,输注后第7天和第1天的结果比较表明,第7天的细胞平均增殖了419倍。值得注意的是,增殖的记忆样NK细胞显示出强效抗白血病功能。转输记忆样NK细胞的9名AML患者中,有5名患者取得了临床缓解,其中4名完全缓解。到目前为止,仅在AML患者中测试了细胞因子诱导的记忆样NK细胞的功效。记忆样NK细胞对其他类型肿瘤(尤其是实体肿瘤)的功效仍有待评估。
在HCMV感染期间也发现了记忆NK细胞反应。Fole等表示,在同种异体造血移植受者体内,供体来源的NK细胞表现出类似记忆的特征,当再次受到CMV感染时,NKG2C+NK细胞的频率增加,IFN-γ产量更高,这些在降低疾病复发中起关键作用。配体为HLA-E的活化性受体NKG2C可作为这些记忆样NK细胞的标志。研究显示,CMV诱导的NKG2C+ NK细胞通过增加脱颗粒和IFN-γ分泌在体外对高表达HLA-E的肿瘤显示出强的细胞杀伤活性。
此外,已建立了体外扩增NKG2C+ NK细胞的有效方法。通过用HLA-E转染的721.221细胞作为饲养细胞,并用IL-15刺激两周,对来源于健康供者的NKG2C+ NK细胞进行体外扩增。扩增的NKG2C+ NK细胞显示出分化的表型,其中包括NKG2A、CD7、CD16和siglec-7的低表达以及CD2、CD57、CD226和颗粒酶B的高表达。
值得注意的是,这些扩增的NKG2C+ NK细胞携带单个自身特异性KIR,使其能够完全克服HLA-C屏障,并对错配的肿瘤细胞发挥更强的细胞毒活性。尽管还有一些挑战仍需具体的解决方案(如扩增效率低,14 d仅扩增2~4倍),单一KIR表达的NK细胞亚群的特异性扩增以及NKG2C+ 适应性NK细胞的高细胞毒活性等特征颇具吸引力,因此这些NK细胞有望成就下一代NK细胞癌症免疫治疗。
值得注意的是,用第三代抗CD19-CAR修饰的NKG2C+ 适应性NK细胞已展示出与所有其他NK亚群相比更优异的细胞杀伤能力,从而证实了其可行性,亦显示出CAR修饰的原代适应性NK细胞在癌症免疫治疗中蕴藏的巨大的应用前景。
肝脏抗原特异性记忆NK细胞首先在小鼠体内发现,并进行了表型特征的鉴定。肝脏含有两种不同类型的NK细胞:肝脏驻留CD49a+ DX5– NK细胞和常规的CD49a– DX5+ NK细胞。肝脏驻留CD49a+ DX5– NK细胞具有记忆潜能,在皮肤接触性超敏反应模型中表现出强烈的记忆应答。随后,在人体内鉴定出一群具有类似记忆特征的肝内CD49a+ NK细胞亚群。人肝内CD49a+ NK细胞表达高水平NKG2C及低水平NKG2A、CD16、CD57和穿孔素。受到刺激后,CD49a+ 细胞会产生大量的炎症性细胞因子,但脱颗粒能力差。
最近的研究表明:IL-12和IL-15可在体外刺激外周血NK细胞,使其分化为CD49a+ CXCR6+ NK细胞。这些CD49a+ CX-CR6+ NK细胞表达高水平的NKG2C并产生IFN-γ,具有与肝脏驻留CD49a+ NK细胞相似的表型和功能。人肝内CD49a+ NK细胞有可能成为有前景的候选NK细胞用于肝癌或相关慢性肝病的免疫治疗。
(五)CAR NK 细胞用于肿瘤免疫治疗
CAR-T细胞的过继免疫治疗在血液恶性肿瘤治疗中已经取得了显著且积极的临床效果。美国食品药品监督管理局已批准使用CD19靶向的CAR-T细胞治疗复发性急性B淋巴细胞白血病和某些类型的复发性NHL。然而,CD19靶向CAR-T细胞的临床应用仍面临重重障碍。输注CAR-T细胞通常伴有副作用,如CRS、神经毒性和脱靶效应。
CAR-T细胞通常由患者自体血中的T细胞制备,以预防GVHD。由此使个体化的制备过程既耗时又昂贵。CAR NK细胞具备几大优点,能够克服这些局限性。CAR NK细胞可以制备成“现成的”产品,而不受自体细胞的限制,因为其足够安全且在同种异体输注时极少引发GVHD。NK细胞通常分泌有限水平的IFN-γ和GM-CSF,但不分泌引发CRS的主要细胞因子IL-1和IL-6。此外,CAR NK细胞表达天然识别受体,如NKp46、NKp30、NKp44、NKG2D和CD226, 这 些受体能识别不依赖CAR的应激诱导配体,由此可降低与CAR靶向抗原丢失相关的疾病复发的可能性。
鉴于NK细胞的上述优点,目前研究人员正在探索将CAR NK细胞应用于血液和实体瘤治疗,且前景广阔。在临床前研究中,CAR NK细胞在小鼠荷瘤模型中显示出强大的抗肿瘤功效。例如,与转输未修饰的NK-92细胞相比,转输野生型表皮生长因子受体(epidermal growth factor receptor,EGFR)和EGFR vIII靶向的CAR-NK-92细胞能够显著抑制恶性胶质瘤的生长,并有效延长荷瘤小鼠的生存期。用磷脂酰肌醇蛋白聚糖3(GPC3)靶向的CAR-NK-92细胞治疗肝细胞癌也显著降低了原位异种移植模型中的肿瘤负荷。
然而,目前仍存在若干影响CAR NK细胞的临床转化的因素。与T细胞不同,用CAR武装NK细胞存在一定的挑战性,因为外周血来源的NK细胞转染率低,且在体内存活时间短。许多研究人员正在探索提高原代NK细胞转染效率的方法,但尚未取得显著进展。Shimasaki等使用电穿孔方法将抗CD19-CAR mRNA传递到人原代NK细胞中。在电穿孔后24 h,抗CD19-CAR的表达水平在新鲜纯化的NK细胞中达到40.3%,在扩增的NK细胞中达到61.3%,细胞存活率为90%。这种NK细胞修饰方法在体外显著增强了NK细胞对CD19+ 肿瘤细胞的特异性杀伤。治疗后小鼠的肿瘤负荷明显减少,但由于抗肿瘤疗效短暂,后期疾病复发。迄今为止,正在进行两项用mRNA电穿孔生产CAR NK细胞的临床试验,以评估该疗法的安全性和可行性。一项试验由新加坡国立大学健康组织发起,靶向CD19治疗B细胞淋巴恶性肿瘤(NCT01974479),另一项试验(NCT03415100)于2018年由广州医科大学第三附属医院发起,采用靶向NKG2D配体的CAR NK细胞治疗转移性实体瘤患者。
为克服CAR瞬时表达和低转染效率的问题,并获得稳定的CAR表达的NK细胞,几个研究团队已开始使用NK-92细胞或UCB/iPSC衍生的NK细胞作为优选的CAR NK细胞的来源。CAR-NK-92细胞表现出靶向杀伤肿瘤的能力。许多肿瘤抗原被用作CAR NK细胞研究中的靶标,包括来自血液恶性肿瘤的肿瘤抗原(如CD19、CD20、CD33、CD138和CS-1)以及实体瘤(如HER2、erbB2、EpCA、间皮素、GD2、GPA7、GPC3、PSCA、EGFR和EGFR vIII)。I期和II期开展的5项临床研究(NCT02892695、NCT02742727、NCT02944162、NCT03383978和NCT02839954)主要包括靶向CD19、CD7和CD33的CAR-NK-92细胞用于淋巴瘤和白血病的治疗;靶向HER2的CAR-NK-92细胞用于胶质母细胞瘤的治疗;靶向MUC1的CAR-NK-92细胞用于MUC1+ 复发性或顽固性实体瘤的治疗。
尽管CAR修饰可以增加NK-92细胞对靶细胞的杀伤能力,但由于输注前需要进行照射,因此NK-92细胞在体内的存活时间仍然有限。Liu等提出了一种用脐带血来源的NK细胞制备CD19特异性CAR NK细胞的新方法,可提高体内NK细胞的转染效率和持久性。用含有CD19特异性CAR基因和IL-15基因的逆转录病毒载体对NK细胞进行修饰,以促进NK细胞的扩增和存留,还采用诱导性半胱天冬酶-9对NK细胞进行了基因修饰,以便在必要时消除转染的细胞。这种修饰,特别是IL-15的引入,显著改善了体内NK细胞的增殖和存活;与仅转染CAR的NK细胞相比,这种修饰具有更强的抗肿瘤活性。值得注意的是,CAR NK细胞在输注后能够在体内存活至少68 d。于2017年获准的由MD安德森癌症中心发起的临床试验(NCT03056339)旨在评估输注脐带血来源的CD19特异性CAR NK细胞是否会改善复发性或顽固性B细胞恶性淋巴瘤干细胞移植患者的病情。
四、挑战与前景
越来越多的研究和临床试验证明了NK细胞在癌症治疗临床应用中的优越性。目前研究者正在采用各种方法来增强NK细胞的体内增殖、持久性和抗肿瘤能力(图1)。然而,在实体瘤的治疗中,NK细胞的疗效仍不够理想。许多因素限制了NK细胞免疫疗法的功效,尤其是有限的体内增殖和持久性以及肿瘤微环境的免疫抑制。已提出多种不同组合的策略来增强NK细胞的抗肿瘤功效,延长其在体内的存活和持久性,恢复肿瘤微环境中NK细胞的功能,避免其发生耗竭。
NK细胞是包含有不同功能亚群的异质性细胞群,如组织驻留性NK细胞、记忆样NK细胞和表达单一特异性KIR的NK细胞。选择性扩增合适的NK细胞亚群并应用于适当类型肿瘤治疗值得探索。脐带血来源的NK细胞或记忆样NK细胞的寿命比外周血来源的NK细胞长,因此可能是NK细胞治疗的理想来源。联合应用IL-12、IL-15和IL-21等细胞因子的组合可进一步增强这些NK细胞在体内的增殖和持久性。CAR是改善NK细胞杀伤活性的有力工具;然而,仅有少数研究基于NK细胞特征进行CAR结构的设计。
因此,大多数CAR NK细胞只是沿用CAR-T细胞的设计,而没有考虑NK细胞的独特特征。一个前景较好的研究领域是设计适用于NK细胞的优化的CAR结构,然后将CAR转染入记忆样NK细胞或某一特定的NK细胞亚群。Kaufman及其同事最近设计并比较了9种不同的包含有不同的NK细胞特异性激活结构域的NK细胞特异性CAR构建体,并利用人iPSC制备间皮素靶向的CAR NK细胞。NK特异性CAR NK细胞,特别是优化的NKG2D-2B4ζ-iPSC NK细胞,在卵巢癌异种移植模型中显示出显著增强的杀伤能力,肿瘤生长得到明显抑制,并且存活时间得到延长。值得注意的是,NK细胞特异性CAR介导的信号转导活性有效地改善了NK细胞在体内的扩增和存活。
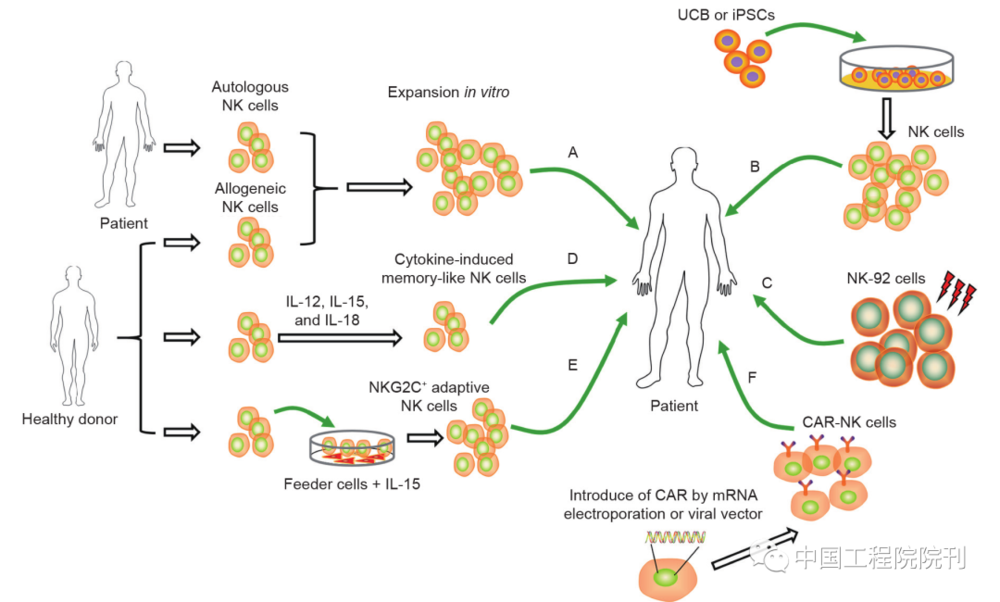
此外,NK细胞通常在肿瘤微环境中被诱导呈功能障碍或耗竭的状态,这大大影响了NK细胞的持久性和细胞毒活性。针对肿瘤微环境制定相应的策略有助于提高NK和CAR NK细胞免疫疗法的疗效。
一些研究表明,通过阻断PD-1通路可部分逆转NK细胞的功能障碍和耗竭。各种肿瘤模型中均发现肿瘤浸润NK细胞的PD-1水平呈特异性上调,且PD-L1 + 肿瘤细胞和PD-1的结合有效地抑制了NK细胞介导的抗肿瘤免疫反应。因此,可通过阻断PD-1和PD-L1恢复NK细胞受损的抗肿瘤活性。值得注意的是,发现肿瘤浸润性NK细胞和T细胞高表达抑制性受体TIGIT,并且TIGIT的水平与肿瘤进展及T细胞和NK细胞的功能耗竭呈正相关,这使得TIGIT成为重要的检查点受体。阻断TIGIT显著逆转了NK细胞耗竭,恢复了不同实体瘤模型中NK细胞和T细胞的细胞毒活性和细胞因子分泌能力,最终也延长了荷瘤宿主的整体存活率。
据报道,还有另一种共抑制性受体Tim-3在来自不同类型实体瘤(如转移性黑素瘤、肝细胞癌、乳腺癌和结肠癌)患者的肿瘤浸润性NK细胞中有高表达,并发现肿瘤浸润性NK细胞上的Tim-3水平与黑素瘤患者的肿瘤进展和不良预后呈正相关。用抗体阻断Tim-3可逆转NK细胞耗竭并显著恢复NK细胞的抗肿瘤功效。因此,CAR NK细胞与检查点抑制(如PD-1、TIGIT、NKG2A或Tim-3阻断)相结合可能进一步加强对癌症的抗肿瘤免疫反应能力。类似的策略包括通过与消除或阻断来自MDSC、调节性T细胞、TAM、TGF-β或其他肿瘤微环境中的免疫抑制进行联合治疗。
总之,NK细胞的强大的抗肿瘤活性最终被转化应用到临床,并已展示出广阔的应用前景。精心设计理想策略并与先进的技术相结合,以改善NK细胞的增殖、持久性和效应功能,克服临床转化的瓶颈,将最大限度地提高过继NK细胞免疫疗法的疗效。
改编原文:
Yuan Hu, Zhigang Tian, Cai Zhang.Natural Killer Cell-Based Immunotherapy for Cancer: Advances and Prospects[J].Engineering,2019,5(1):106-114.
本文来自微信公众号:中国工程院院刊(ID:CAE-Engineering),作者:胡渊、田志刚(免疫学家,中国工程院院士)、张彩

