本文来自微信公众号:中国工程院院刊(ID:CAE-Engineering),作者:李爱花,杨雪梅,孙轶楠,苑亚坤,杨俊涛,原文标题:《核酸疫苗研发态势与发展建议丨中国工程科学》,题图来自视觉中国
一、前言
疫苗是人类防控传染病及部分非传染性疾病(如肿瘤)的重要“武器”。疫苗接种作为有效的控制手段,已经消灭了天花、脊髓灰质炎等疾病,但未能有效防控人类免疫缺陷病毒(HIV)、疟疾等对人类健康具有重大威胁的传染病。
一些新型传染病,如传染性非典型性肺炎、人感染高致病性禽流感、新型甲型流感病毒、埃博拉病毒、寨卡病毒等导致的感染,传播速度快、致死率高,给居民生命健康带来了极大威胁;全球尚未有治疗上述疾病的特效药,需要综合采用多种不同类型的候选疫苗来进行相应疾病的控制和预防。因此,我国需要提前开展疫苗方面的研发布局与技术储备,才能应对潜在的重大挑战。
近年来,在传统的减毒疫苗、灭活疫苗技术基础上,采用生物化学合成、人工变异、分子微生物学、基因工程等现代生物技术,开发出了多种类型的新型疫苗,代表性的有基因工程亚单位疫苗、重组疫苗、病毒样颗粒疫苗(VLP)、多糖结合疫苗、合成肽疫苗、基因工程载体疫苗、核酸疫苗(分为脱氧核糖核酸疫苗、核糖核酸疫苗)等。
核酸疫苗尽管研究历史较长,特别是DNA疫苗的研发可追溯到1990年,但相关工作并未获得生物技术领域的足够关注。
当前,全球新型冠状病毒肺炎疫情仍在持续,信使核糖核酸(mRNA)疫苗在疫情防控中发挥了较为重要的作用,因相较于传统疫苗更加高效的特点而成为疫苗研发领域的关注热点,也促进了业内对核酸疫苗的重新审视。有研究分析了冠状病毒疫苗的研发态势,发现在冠状病毒疫苗研发中运用较多的有核酸疫苗、病毒载体疫苗、蛋白亚单位疫苗等技术路线;梳理了针对COVID-19疫情的DNA疫苗、mRNA疫苗关键技术与产品研制进展;综述了mRNA疫苗的潜在生物学机制及在某些传染病、肿瘤中的应用情况。
本文分析了DNA疫苗、RNA疫苗、结合疫苗、亚单位疫苗、病毒样颗粒疫苗相关的科学引文索引(SCI)论文发表情况:核酸疫苗和其他新型疫苗在近20年来备受关注;RNA疫苗技术是2000年以来新兴开展的研究方向,仍处于研究上升阶段,且在2020年以来研究关注度得到显著提升;DNA疫苗处于研究发展的成熟期,但2010年之后研究热度已呈现出下降趋势(见图1)。
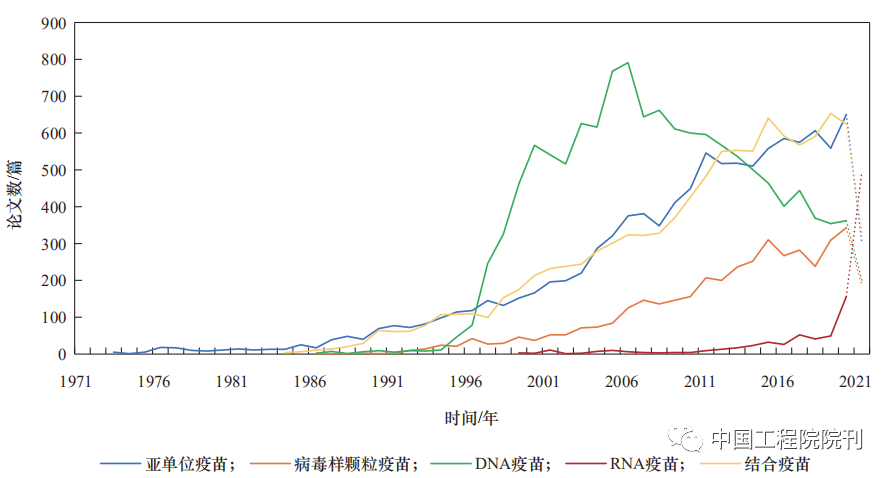
注:数据来自PubMed数据库,时间截至2021年6月30日。
也要注意到,就已经发表的核酸疫苗研究综述论文来看,尚未对核酸疫苗的整体发展轨迹、DNA疫苗与RNA疫苗研发之间的关联及演化等进行比较分析,也未开展系统性的研究产出数据比对。
针对于此,本文着重开展核酸疫苗的发展历程梳理、应用态势分析、发展趋势研判,提出我国核酸疫苗的发展建议,以期为相关研发布局和管理政策研究提供基础性参考。
二、核酸疫苗技术概述
核酸疫苗也称基因疫苗,将编码某种抗原蛋白的外源基因(DNA或RNA)直接导入动物体细胞内(如以经肌肉注射、微弹轰击等方式),通过宿主细胞的表达系统合成抗原蛋白,诱导宿主产生对该抗原蛋白的免疫应答,进而达到预防和治疗疾病的目的。根据主要成分的不同,核酸疫苗分为DNA疫苗、RNA疫苗,其中RNA疫苗主要指mRNA疫苗。
(一)DNA 疫苗技术
DNA疫苗可分为不需要任何化学载体的“裸疫苗”、将编码某种蛋白质抗原的基因重组到真核表达载体后的DNA质粒;直接或经包装后导入宿主体内,被细胞(组织细胞、抗原递呈细胞或其他炎性细胞)摄取,即可在细胞内表达病原体的蛋白质抗原,通过刺激机体产生细胞免疫和体液免疫反应。
与传统的蛋白质疫苗相比,DNA疫苗的免疫原性受到抗原表达水平偏低的限制,在30多年的研发过程中人体临床试验结果并不理想。新技术的引入有望进一步提高DNA疫苗的功效,如通过密码子优化、基因修饰、佐剂和复杂的启动–促进方案等来提高疫苗免疫原性,采用电穿孔、脂质纳米颗粒等更好的疫苗传递技术。
(二)mRNA 疫苗技术
mRNA疫苗是在体外合成的含有编码特定抗原的mRNA序列,被注射至体内后,首先需要通过细胞膜进入细胞内;因mRNA序列结构不稳定且细胞内外含有较多核酸水解酶,需要特殊的保护措施来防止mRNA序列降解,还需兼顾跨膜的效率。mRNA疫苗通常以内涵体的形式进入细胞,释放到细胞质内发挥作用;为避免过早降解,mRNA翻译过程也需要一些工具的调节。
当前的mRNA疫苗主要有传统mRNA疫苗、自我扩增型mRNA疫苗两种形式:前者的开放阅读框(ORF)只含有编码抗原的基因;后者的ORF不仅包含编码抗原的基因,还包括RNA扩增需要的非结构蛋白,可使mRNA进行扩增并增加目的抗原的表达量。除了ORF之外,两种疫苗均含有由5′端非翻译区(5′UTR)、3′端非翻译区(3′UTR)、5′端帽子结构(Cap)、3′端多聚腺苷酸结构(Poly-A),通过对mRNA的人工修饰,可增强mRNA稳定性并提高mRNA翻译的准确性和效率,也可降低mRNA自身的免疫原性,提高安全性。
递送载体对mRNA疫苗的稳定性、翻译效率同样起着重要作用,可分为病毒载体、非病毒载体。病毒载体本身具有免疫原性,以之为载体可能会使机体产生干扰抗体,影响mRNA疫苗的功效。
非病毒载体以脂质体载体在mRNA疫苗的递送中应用最为广泛,主要优势有:脂质体呈囊状,通过脂质纳米粒包裹mRNA的递送技术,可将mRNA包裹在空腔中,避免接触核酸水解酶以防止降解;脂质体性状与细胞膜相似,可促进载体与细胞膜融合,提高mRNA进入细胞的效率;脂质体可促进mRNA从内涵体中释放至细胞质中,最终大幅提高mRNA在体内的表达效率,易于量化生产,可应用于批量生产疫苗。
(三)核酸疫苗的特征
与传统的灭活疫苗、亚单位疫苗相比,核酸疫苗具有突出优点。就理论层面而言,核酸疫苗可以合成表达几乎所有的蛋白质抗原,为抗原设计提供了极大的灵活性;得益于数据挖掘技术,进一步优化现有抗原、设计独立于天然基因、实现核酸疫苗的优化和个性化,有可能成为现实。
相关优点有:
1. 免疫保护力强,接种后蛋白质在宿主细胞内表达,直接与组织相容性复合Ⅰ类或Ⅱ类分子结合,同时引起细胞和体液免疫;
2. 制备简单,省时省成本,只需对编码抗原的基因进行设计和克隆,生产工艺和质量控制体系可以通用,不随抗原基因的改变而变化,不需体外蛋白质表达和纯化,在流行病暴发期可快速开发新的疫苗;
3. 免疫应答较持久,如19个月后仍可检测到外源基因相当数量的表达;
4. 同种异株交叉保护,选择病原体的编码保守蛋白的核酸序列作为疫苗,因其不会变异而对同一种病原产生交叉免疫;
5. 兼具预防性和治疗性功能,如在防治肿瘤应用中,基因疫苗接种后可诱发机体产生细胞毒性T淋巴细胞免疫应答,对细胞的恶变进行免疫监视,对癌变的细胞产生免疫应答;
6. 易于储存和运输,主要指DNA疫苗在室温下相对稳定。
核酸疫苗虽然有优于传统疫苗的诸多优点,但也存在一些不足。一方面,DNA疫苗诱导产生的抗体,可能不是针对编码的抗原,而是针对双链质粒DNA分子或mRNA本身,促使自身免疫性疾病的发展并导致机体产生免疫耐受,外源DNA有整合到宿主基因组的潜在风险;DNA疫苗在小动物体内可产生明显的效果,但在大型动物、人类体内的免疫原性相对较低。
另一方面,近年来兴起的RNA疫苗具有与活病毒类似的免疫应答机制、简单快速的化学合成制备方法、良好的热稳定性、无整合和干扰基因组转录的风险等优势,但仍偶发原因不明的不良反应;筛选新抗原时重要的新抗原有可能被研发人员错过,被选中的反而是低效或脱靶的抗原,会导致潜在安全问题;突变克隆可能差异很大,因此很难确定产生足够抗原免疫应答的抗原需求量;在合成某些不常见序列、降低相关试剂生产成本方面仍存在障碍。
三、核酸疫苗研发轨迹和趋势
(一)DNA 疫苗研发相对成熟,mRNA 疫苗研发崭露头角
核酸疫苗研究始于20世纪80—90年代,在经过灭活疫苗、减毒疫苗、亚单位疫苗等多次疫苗变革后最终走向实际应用。
1990年,Wolff等构建了外源性重组质粒,注射入小鼠肌肉后可被细胞摄取并能在体内稳定地表达编码蛋白。
1991年,Williams等发现外源基因输入体内的表达产物可诱导产生免疫应答。1992年,Tang等发现外源质粒的体内表达能够诱发机体产生针对表达基因产物的抗体反应,产生特异性抗体标志着基因疫苗概念的确立。
1993年,Ulmer等将含有编码甲型流感病毒核蛋白的重组质粒注射到小鼠肌肉,质粒可有效地保护小鼠抵御流感病毒异源株的攻击。此后的大量动物实验表明,在适当的条件下,DNA进入体内能引起细胞免疫和体液免疫。
1994年在日内瓦召开的专题会议上将这种疫苗命名为核酸疫苗,后被称为继灭活疫苗和减毒疫苗、亚单位疫苗之后的“第三代疫苗”。
早在1990年,Wolff等将体外合成的mRNA经肌肉注射至小鼠骨骼肌内,发现在骨骼肌细胞内有特定表达的蛋白质生成并产生免疫反应,展示了mRNA的治疗潜力。
然而,mRNA容易被无处不在的RNA酶降解,具有不稳定的固有特点,一般认为实用性较低,多年来mRNA疫苗及药物研究进展缓慢。随着RNA稳定技术、递送系统的发展,近年来RNA疫苗技术得到进一步发展,如德国美因茨大学研究团队针对不同黑色素瘤患者,研发了含有多种肿瘤新抗原的个性化mRNA疫苗。
从整体趋势来看,DNA疫苗技术研究处于稳中有降的状态;RNA疫苗步入上升期,自2014年起相关论文数和专利申请量增长明显(见图1、图2)。RNA疫苗的研发技术趋于完善,基本满足了COVID-19疫情对快速高效疫苗的需求,在2020年两款RNA疫苗有效性迅速得到验证后,研究热度明显超过其他类型(见图1)。
值得指出的是,在2020年以前,国家级研究基金资助的RNA疫苗研究明显少于DNA疫苗。国家自然科学基金委员会(NSFC)、美国国立卫生研究院(NIH)是世界各国资助核酸疫苗研究最多的机构;资助产生的DNA疫苗研究论文占DNA疫苗论文总量的80%~90%,资助产生的RNA疫苗研究论文不足DNA疫苗的1/10。
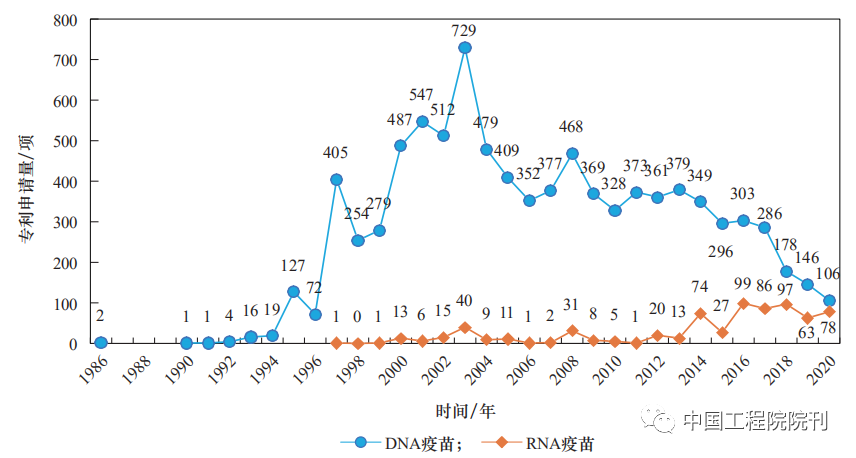
注:数据来源于incoPAT专利数据库,时间截至2020年;因专利公开时间存在滞后,2019—2020年数据仅供参考。
(二)COVID-19 疫情促进 mRNA 疫苗研究提速
在2020年以前,虽有多项核酸疫苗研发进入临床Ⅲ期试验,但都以失败告终,世界范围内没有人用核酸疫苗上市;仅有7种兽用DNA疫苗获批上市,用于预防马西尼罗病毒感染的WestNile-InnovatorDNA是世界首个获准上市的DNA疫苗。
COVID-19疫情暴发后,对疫苗的需求显著推动了核酸疫苗的研发进程,相关疫苗方案有超过20%为核酸疫苗类型。截至2021年6月30日,核酸疫苗产品已有707项,一年半时间内的新增产品较之前24年总量增长了18%,有394项产品(含356项DNA疫苗、38项RNA疫苗)已终止研发。
目前,仍处于活跃研发阶段的疫苗产品有313项(含190项DNA疫苗、123项RNA疫苗),其中约10%的产品处于药物发现阶段,约88%的产品处于临床前或临床研究阶段;2项产品因经费或数据问题处于中止状态,1项产品处于预注册阶段,2项mRNA产品(mRNA-1273、BNT162b2)已通过紧急授权上市使用。
自2020年以来,新启动开发的核酸疫苗产品,有66项(约占60%)为针对COVID-19开发,其中44项为mRNA疫苗。目前在研的COVID-19预防性mRNA疫苗有41项,COVID-19预防性DNA疫苗有23项。
另外,针对流感病毒、HIV病毒、乙肝病毒、寨卡病毒及其他病毒感染,肿瘤等非感染性疾病开展研究的疫苗有44项。mRNA疫苗从启动研发到上市应用仅耗时1年,大大突破了通常情况下疫苗研发8~10年上市的周期,这为新发突发传染快速获取预防性疫苗带来了新希望。
(三)各国核酸疫苗产品研发态势不均衡
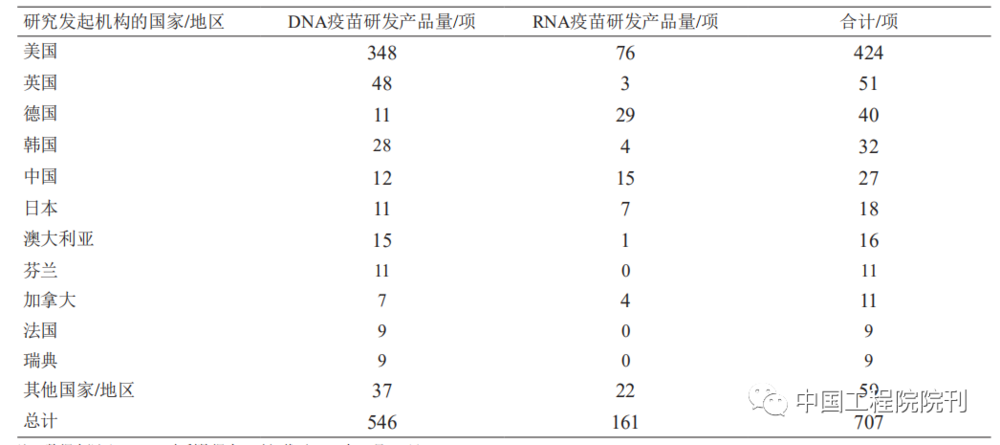
从核酸疫苗专利申请表征产品研发强度的角度看,美国在DNA疫苗和RNA疫苗领域均处于领先位置(见图3、表1),且自2015年起明显倾斜于RNA疫苗;德国近10年的mRNA疫苗研发显著增加。因此,美国、德国具备较好的mRNA疫苗研发技术储备,在COVID-19疫情暴发后能够迅速研发mRNA疫苗并保持领先态势。美国、德国的COVID-19mRNA疫苗产品数量分别占世界mRNA疫苗产品数量的10%、5%。
鉴于RNA疫苗研发风险较高,我国在新型疫苗研发方面偏重技术较为成熟的亚单位疫苗、病毒载体疫苗、DNA疫苗等。近20年来,我国在DNA疫苗领域的研发具有较强实力,专利申请量仅次于美国,但RNA疫苗研发相对滞后(见表1、表2、图3)。
但在COVID-19疫情暴发之后,鉴于RNA疫苗的良好应用潜力,我国高度重视并及时布局RNA疫苗研发,相关专利申请量已超越德国成为世界第二大RNA疫苗研发国(见图3)。
也要注意到,我国核酸疫苗研发产品数量增速慢于专利申请数量,需要比先发国家以更长时间才能体现出技术向产品的转化。目前,我国主导的DNA、RNA疫苗产品的研发数量分别约占世界的2%、9%。
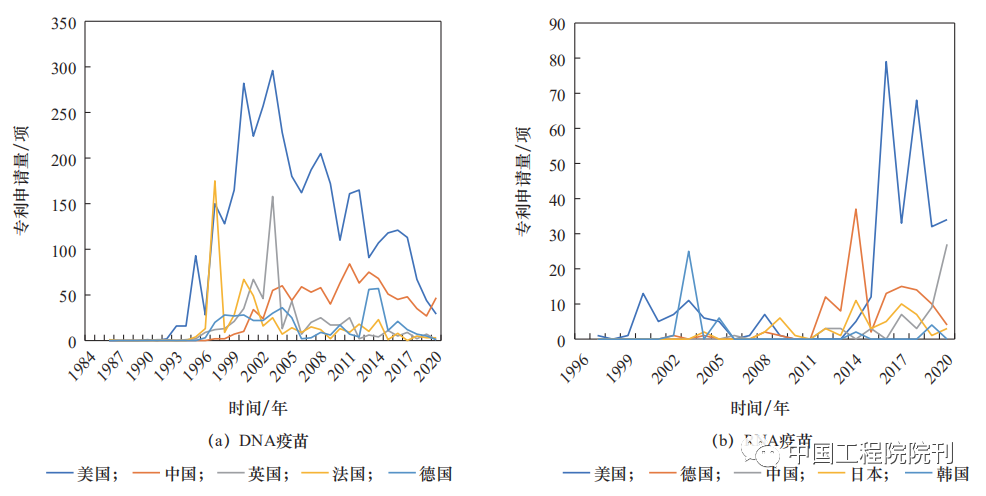
注:数据来源于incoPAT专利数据库,按照申请量前5名排序。
表1 核酸疫苗主要专利申请国家的分布情况
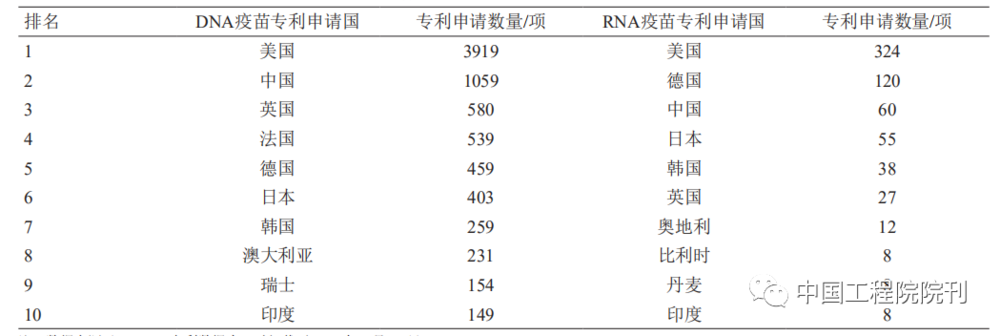
表2 核酸疫苗产品主要研究发起国家/地区的分布情况
(四)感染和肿瘤是核酸疫苗的主要应用方向
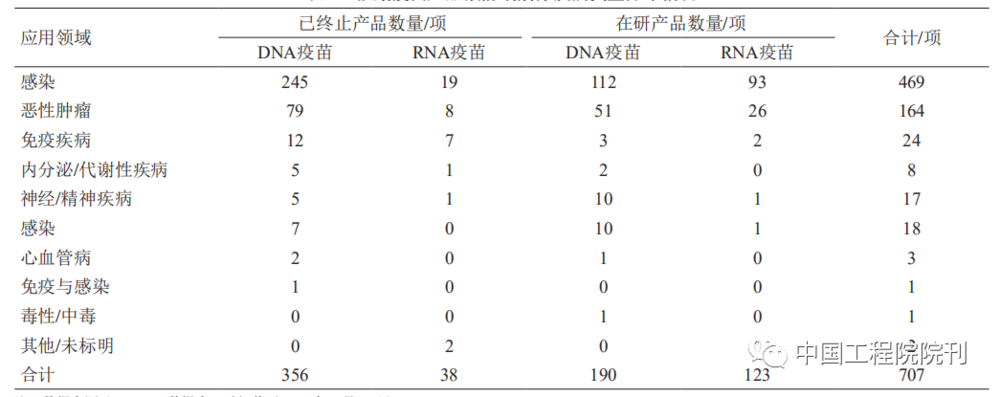
从基础性研究论文来看,核酸疫苗研发主要针对高致病性病毒(HIV、丙型肝炎病毒、寨卡病毒、西尼罗病毒等)、肿瘤,研究内容涉及疫苗结构及制备、免疫机制、有效性、安全性/毒性等。
核酸疫苗产品应用方向同样以病毒感染、肿瘤预防与治疗为主。病毒主要有流感病毒、乙型肝炎病毒(HBV)、HCV、HIV、SARS-CoV-2等,肿瘤主要有乳腺肿瘤、黑色素瘤、胶质母细胞瘤、非小细胞肺癌、卵巢肿瘤、前列腺肿瘤等。还有少量的核酸疫苗用于免疫疾病、神经/精神疾病、糖尿病视网膜病变等非传染性疾病的防治。
与其他应用方向不同,针对COVID-19的疫苗以mRNA疫苗为主,且相关疫苗的成功上市带动了流感病毒感染疫苗研发更多转为mRNA疫苗方向(见表3、图 4)。
表3 核酸疫苗产品预防或治疗疾病类型分布情况
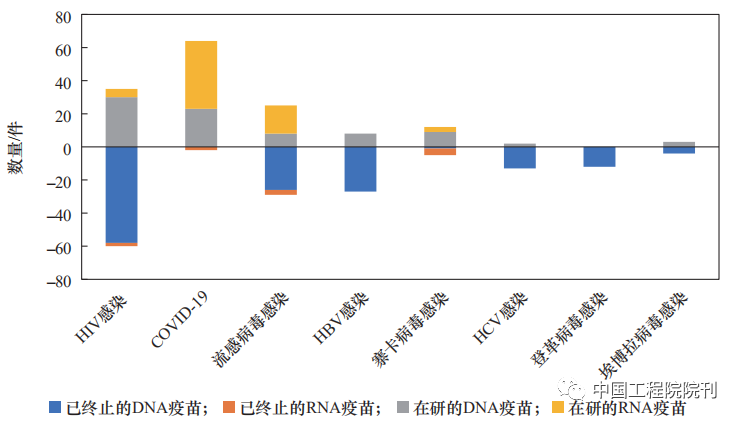
注:正数表示在研项目,负数表示已终止项目。
四、核酸疫苗发展建议
核酸疫苗特别是mRNA疫苗,在临床方面的成功应用显著增强了对新发传染病的反应和控制能力,从刺激人体自身免疫反应的角度考虑则显著增强了治疗经典和重新出现传染病与肿瘤的能力。
惟有从技术研发、安全监管、前瞻布局方面共同发力,才能较好解决核酸疫苗的技术成熟度、安全性等问题,从而有效应对急性传染病暴发,推动疫苗从预防性应用拓展至治疗性应用,为人类健康、经济社会发展创造更大价值。
(一)技术发展建议
1. 改良目的基因表达
核酸疫苗研究已进入精准设计阶段,应用保护组学分析、结构疫苗学、合成生物学等交叉学科技术,创新研究思路,预测靶标/靶点,进行新抗原再设计;通过优先使用优势密码子并避免使用稀有密码子、甲基化碱基等方式,改造骨架或添加免疫刺激序列优化目的基因;对质粒载体的启动子、增强子、内含子等转录调控元件进行优化,提高外源基因的表达。
2. 完善递送系统
对于将外源性DNA导入靶细胞,为克服常规方式的质粒转染效率低、在人体内难以引起有效免疫效果的问题,采取新型物理或化学方法来提高外源性DNA对细胞的转染效率,如电穿孔、基因枪、生物喷射器(无针注射)、微针阵列等。
对于mRNA疫苗,除了基于脂质纳米颗粒等载体进行递送外,探索脂质体运载、聚合物运载、脂质体聚合物纳米递送平台等新方式,实现高效包载并保护mRNA不被RNA酶降解。
3. 提高免疫应答
加入免疫佐剂是增强机体对抗原的免疫应答或改变免疫应答类型的有效途径。除了细胞因子、趋化因子、信号分子、模式识别受体配体等免疫佐剂类型外,开展纯化体外转录mRNA研究,在mRNA分子中引入修饰性的核苷基团或形成mRNA-载体分子复合物,优化编码mRNA的核心序列,提高翻译效率,延长mRNA半衰期,达到调节mRNA免疫刺激性的目的。
4. 增强 mRNA 稳定性及易存性
深入开展保持mRNA疫苗活性及保存期的研究,通过对DNA模板上的5′UTR、3′UTR区域序列、Poly-A尾,体外转录时的Cap、核苷三磷酸(NTP)等合成mRNA元件进行设计,或利用分离和纯化技术来优化mRNA,提高mRNA的稳定性和翻译效率。进一步改进递送系统,采用高效的mRNA递送载体来显著改善mRNA疫苗的稳定性和翻译效率。研究在冻结条件下与载体分子复合的mRNA储存效果,延长疫苗的保存期。
(二)行业政策建议
1. 严格监管核酸疫苗的安全性和有效性
尽管核酸疫苗在COVID-19疫情中因其高效快速的特点而得到国外监管机构破例批准上市,但该类疫苗技术的长期效果仍需进一步验证。在疫苗研制企业得出有效性、短期安全性的前提下,建议我国监管机构仍应严格依据审批制度,稳妥推动在传统疫苗已经上市条件下核酸疫苗的过渡使用,力求逐步完善长期安全性验证问题。
鉴于核酸疫苗在COVID-19疫情之前都未曾正式获批人体使用的实际情况,对于在疫情防控特殊情境下加速获批的人用核酸疫苗,我国监管机构应保持高度关注并持续跟踪,以准确掌握核酸疫苗的长期安全性、研发投入与综合产出效益。
2. 注重技术研发的前瞻布局并促进转化
核酸疫苗作为新型疫苗,相关技术仍处于不断完善的过程中,在疫苗结构、递送、免疫原性、稳定性等方面仍存在一些问题。面对传染病疫情对安全有效疫苗的亟需,国外优势机构及时调整研发重心,在mRNA疫苗研发方面取得了阶段性重大突破。
建议我国行业管理机构在此领域坚持前瞻性思维和问题导向,在把握成熟研发方向的同时,面向亟待解决问题(传染病防控、肿瘤治疗)开展前瞻布局,稳妥处置、积极扶持有关核酸疫苗的高风险研究;积累和打牢基础技术储备,注重技术转化与应用效能,形成产品批量生产能力,稳步提升我国疫苗研发综合实力。
本文来自微信公众号:中国工程院院刊(ID:CAE-Engineering),优先出版于中国工程院院刊《中国工程科学》2021年第4期,作者:李爱花,杨雪梅,孙轶楠,苑亚坤,杨俊涛

