本文来自微信公众号:学术头条(ID:SciTouTiao),撰文:ZS,编审:王新凯,排版:王落尘,原文标题:《〈细胞〉重磅!科学家成功培育全球首个人类自组织心脏类器官,可自主跳动且能自我修复》,题图来自:视觉中国
人体中结构最复杂、精密的器官有哪些呢?心脏绝对算得上其中之一。心脏结构的复杂性,远超我们的想象。长期以来,科学家成功在体外培养出了多种器官的类器官模型,却在心脏类器官上进展缓慢。
近日,来自维也纳奥地利科学院的科研团队,使用人类多能干细胞成功培养出全球首个体外自组织心脏类器官模型,该模型可自发形成空腔,自主跳动,无需支架支持。同时,这种心脏类器官在受伤后可以自主动员心脏成纤维细胞迁移修复损伤。

该研究以 “Cardioids reveal self-organizing principles of human cardiogenesis” 为题发表在最新一期的 Cell 杂志上。奥地利科学院的生物学大拿 Sasha Mendjan 教授为本文通讯作者。
艰难的心脏类器官发展历程
所谓类器官,是指一种能在体外环境培养的具有三位结构的微器官,拥有真实器官类似的复杂结构,能够部分模拟真实器官的生理功能。借助类器官,人们可以深入观察了解器官的生长发育过程,了解疾病的发生原因。同时,类器官在器官移植和药物筛选上也颇具前景。
此前,人们已经成功培养出脑、肠道、胃、肝脏、胰腺、皮肤、肺、肾脏、舌、甲状腺、胸腺、睾丸、视网膜等。然而,在心脏类器官领域一直进展缓慢。
与大多数人想象中的简单空腔结构不同,心脏的结构其实相当复杂。心脏由多层组织组成,包括许多不同类型的细胞:心肌细胞(心房肌和心室肌细胞)、非心肌细胞(浦肯野细胞、平滑肌细胞、内皮细胞)和神经元细胞,这些细胞协同工作,以确保心脏的正常运作,从而向身体的其他部位不断供应新鲜的含氧血液。
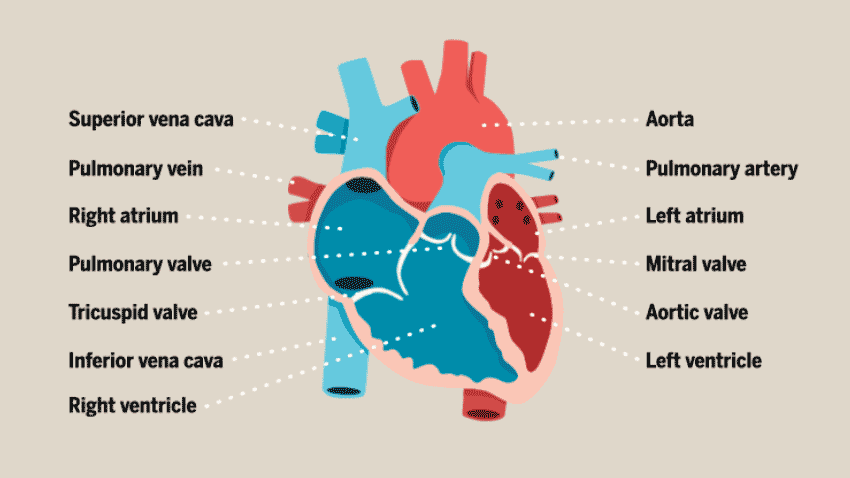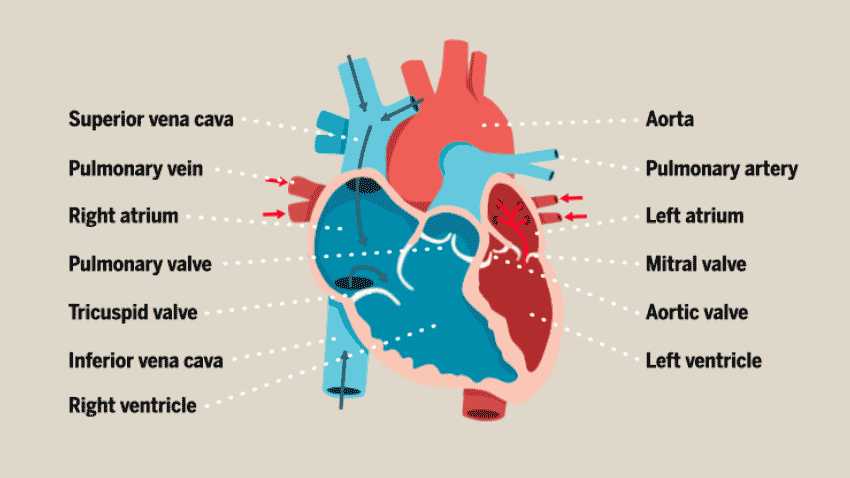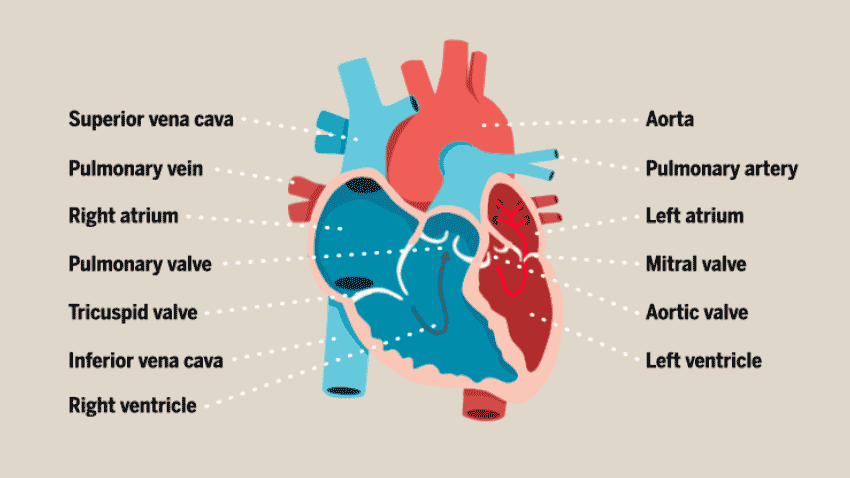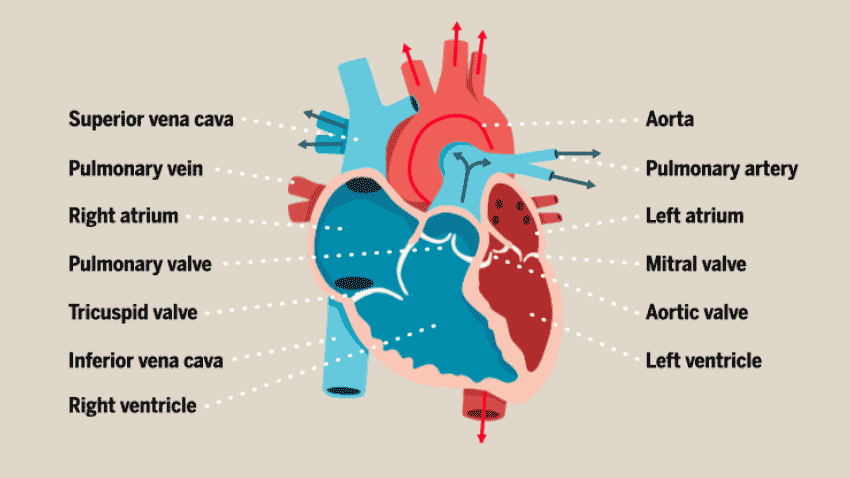
此前,在体外培养心脏类器官的过程中,研究人员发现,心肌细胞往往以团块形式存在,而不会形成体内常见的组织结构,因此无法很好地构建体外模型进行心脏疾病的研究。
直到 3D 类器官技术出现后,人们才成功在体外构建出心脏类器官。所谓 3D 类器官技术,就好比用砖和钢筋水泥盖房子,先用组织工程技术建造一个支架,然后让心肌细胞来填充,形成所谓的心脏类器官模型。
2020 年 9 月 18 日,来自东京医科牙科大学的研究人员,利用 3D 类器官技术,使用小鼠胚胎干细胞构建出了首个类似于正在发育的心脏三维功能性类器官,该类器官与发育中的心脏非常相似。构建成功的心脏类器官包括完整的四个腔室以及传导系统的细胞。同时,这种心脏类器官具有接近体内对应物的功能特性。
全球首个人体心脏类器官模型
虽然,以组织工程技术为基础的 3D 类器官技术可以帮助人类建立心脏类器官模型,但是由于类器官模型在搭建过程中不是细胞自发组织形成的,这种类器官在器官发育和药物筛选方面,用处十分有限。
正如 Mendjan 教授所说,“组织工程学对于生物研究的贡献自然是非常突出的。但是在自然过程中,器官的生成并不是人为控制的,而是细胞自发组织形成的。在这一过程中,各个细胞之间会彼此相互作用,随着器官结构的出现而生长移动并改变形状。换句话说,细胞自组织形成器官,就好比大自然让雪花晶体的自动形成,鸟儿自动成群结队的一起迁徙,很难通过人为工程设计来实现。”
为了在体外模拟正常的心脏发育过程,Mendjan 教授和他的团队通过特定的顺序激活目前已知的参与胚胎心脏发育的 6 个信号通路来诱使人类多能干细胞自我增殖分化。在实验过程中 Mendjan 教授发现,随着细胞分化的特定模式被激活,这些细胞会形成单独的细胞层,类似于人类的心脏壁结构。
经过一周的发展后,这些细胞会自发组织形成一个 3D 结构的类器官,该类器官具有一个封闭的空腔,类似人类心脏自发生长的轨迹。同时,研究人员发现,这个自发形成的空腔结构可以自主地有节奏地收缩和舒张,从而挤压腔内的液体。
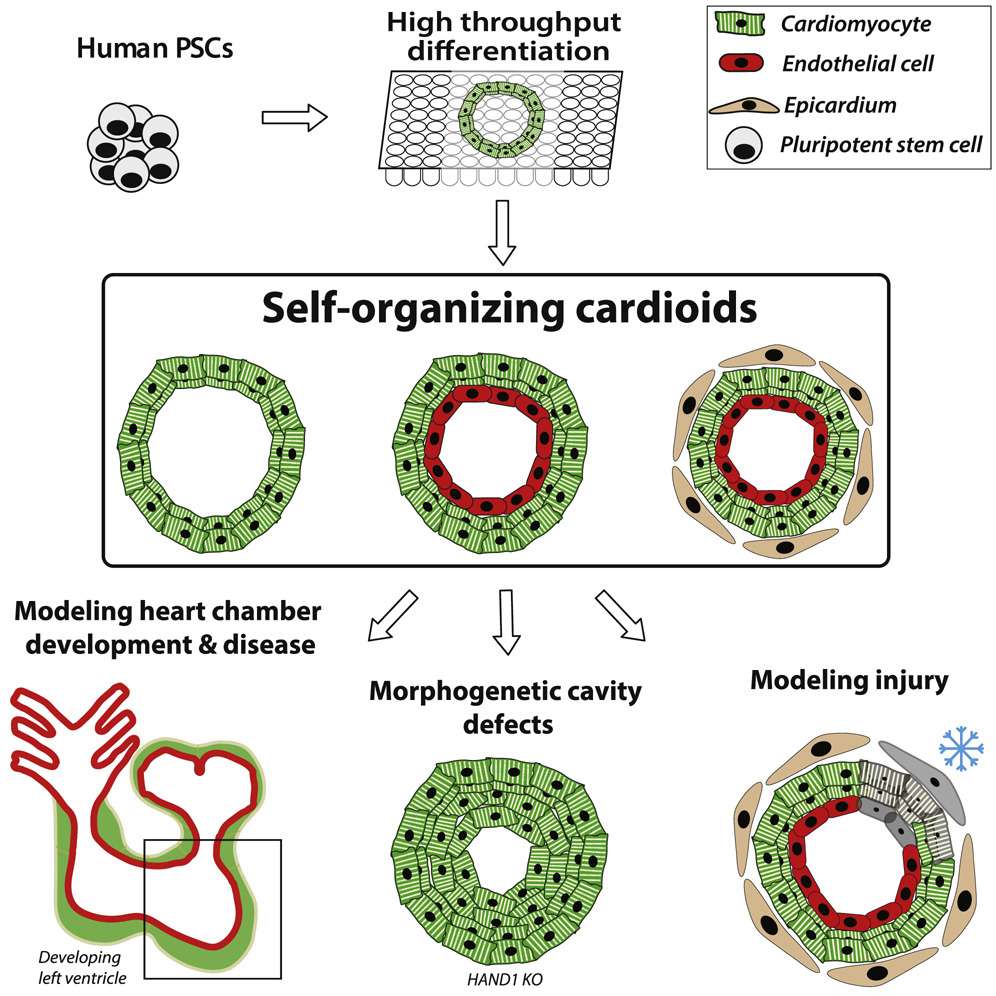
随后,研究小组还测试了这一自组织形成的心脏类器官对组织损伤的反应。他们用一根冷冻过的钢棒冻结了部分心脏类器官的细胞,来模拟心脏受伤后的细胞死亡场景。结果研究人员发现,心脏类器官中的心脏成纤维细胞会立刻向损伤部位迁移,并合成一些蛋白质来修复损伤。

Mendjan 教授表示,“我们并没有用到很多高深的技术,只是将目前已知的心脏发育信号用于心脏类器官的合成中。这表明,目前这些信号通路对于心脏发育是必须的,它们对于多能诱导干细胞自组织形成类器官非常重要。”
目前,这一研究仅生成了一个单腔的心脏类器官结构。下一步,该团队计划在体外合成具有多个腔室的心脏类器官,就像人类真实的心脏那样。一旦这种多腔室自组织心脏类器官形成,人们就可以了解先天性心脏病的病因,也就是胎儿发育缺陷的病因。这样一来,人们还可以更加针对性地开发新药,也对临床试验的结果有了更大的把握。
参考资料:
https://www.cell.com/cell/fulltext/S0092-8674 (21) 00537-7
https://www.sciencemag.org/news/2021/05/lab-grown-minihearts-beat-real-thing
https://www.eurekalert.org/pub_releases/2021-05/cp-shh051321.php
本文来自微信公众号:学术头条(ID:SciTouTiao),撰文:ZS,编审:王新凯,排版:王落尘

